
- •Гоу впо Кемеровский технологический институт
- •1 Пища человека – важнейшая социальная и экономическая проблема общества
- •2 Основные термины, определения и понятия
- •3 Пища и ее состав. Основные компоненты пищи, их характеристика
- •3.1 Вода в сырье и пищевых продуктах
- •3.1.1 Значение воды для организма человека
- •3.1.2 Вода как составная часть пищевых продуктов
- •3.1.3 Активность воды и стабильность пищевых продуктов
- •3.2 Белки в составе пищи
- •3.2.1 Состав и строение белков
- •3.2.3Основные технологические свойства белков
- •2.3 Липиды
- •2.3.1 Классификация и строение липидов
- •2.3.2 Значение жиров в питании человека
- •2.3.3 Основные технологические свойства жиров
- •Гидролиз триглицеридов
- •Реакции присоединения галогенов
- •Гидрогенизация масел и жиров
- •Переэтерефикация жиров
- •Физические свойства жиров
- •3.4 Углеводы в составе пищи, их превращение при переработке.
- •По строению и свойствам углеводы делятся на три основные группы: моносахариды, олигосахариды и полисахариды.
- •Моносахариды Олигосахариды Полисахариды
- •3.4.2 Значение углеводов в питании человека.
- •Глюкоза этиловый углекислый
- •3.5 Органические кислоты
- •3.6 Витамины
- •3.7 Минеральные вещества
- •Макроэлементы
- •Микроэлементы
- •4 Пищевые добавки
- •5 Вредные вещества пищи.
- •5 . 1 Природные токсиканты.
- •5 .2 Загрязнители
- •Контрольные вопросы
- •6 Биохимия пищеварения и основы рационального питания
- •6.1 Биохимия пищеварения
- •6.2 Основы рационального питания
3.2.3Основные технологические свойства белков
Наиболее важными технологическими свойствами белков являются гидратация, денатурация и пенообразование.
Гидратация.
Белки обладают способностью связывать воду, т.е. проявляют гидрофильные свойства. Гидрофильность белков обусловлена наличием на поверхности
мицелл, заряженных частиц: NH2+ , COO¯,PO¯4, OH¯ . В изоэлектрической точке (и.э.т.) заряд на поверхности мицеллы белка равен нулю, и поэтому белок теряет способность удерживать воду. При получении сыра и творога молоко подкисляют до и. э. т. казеина 4,6-4,7, образуется сгусток, который легко отдаёт воду с растворёнными веществами (сыворотку).
Гидрофильность белков зависит от структуры белка (сывороточные белки более гидрофильны чем казеины), от рН среды, от присутствия солей.
Связывая воду, белки набухают, увеличивается их масса и объем. Набухание - это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом. Этот процесс сопровождается увеличением массы и объёма полимера. Причиной набухания является диффузия молекул растворителя в высокомолекулярное вещество. Между молекулами полимера обычно имеются небольшие пространства, размер которых соизмерим с размерами молекул растворителя. Благодаря этому молекулы низкомолекулярной жидкости достаточно быстро проникают между макро молекулами, раздвигая сетку белка























 Н2О
Н2О

















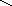

























 Н2О
Н2О



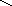





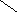







 -Н2О
+Н2О
-Н2О
+Н2О
Рис.3.2. Схема набухания белка и синерезиса
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не обладают текучестью, они упруги, обладают пластичностью, способны сохранять форму.
Гидрофильные свойства белков имеют большое значение в пищевой промышленности. От гидрофильных свойств белков зависят структурно-механические свойства молочных сгустков, их способность отдавать влагу, а так же консистенция готовых продуктов. В плавленых сырах белок имеет более высокие гидрофильные свойства, чем в натуральных сырах, за счёт введения солей-плавителей, поэтому консистенция у них более мягкая, пластичная, даже мажущаяся.
Денатурация – сложный процесс, при котором происходит изменение нативной пространственной структуры белка, т.е. изменение четвертичной, третичной и вторичной структуры макромолекулы белка. Первичная структура и химический состав белка при этом не меняются.


















Мицелла белка отдельные субмицеллы





Нативная форма хаотический клубок
Рис 3.2. Схема денатурации белка
Денатурация происходит под воздействием внешних факторов: температура, механическое воздействие, химические реагенты.
При денатурации изменяются физические и химические свойства белка (его влагоудерживающая способность, растворимость), меняется форма белковой молекулы, происходит их агрегирование, изменяется биологическая ценность и прежде всего усвояемость белка.
Большое практическое значение в пищевой промышленности имеет тепло-
вая денатурация. Белки зерна и других растений после тепловой обработки становятся более доступными для пищеварительных ферментов. В некоторых случаях, наоборот белки вступают в реакцию с другими компонентами пищи и образуют комплексы, которые трудно перевариваются.
Умеренная тепловая обработка не вызывает изменения аминокислот и несколько улучшает переваривание за счёт денатурации и инактивации ингибиторов ферментов. Это относится к сывороточным белкам и растительным белкам (белки злаковых, гороха, фасоли). Казеин сырого молока характеризуется рыхлой структурой и поэтому обладает высокой степенью перивариваемости без предварительной денатурации. Длительная высокотемпературная обработка может привести к снижению его биологической ценности.
Пенообразование - способность белков образовывать высококонцентрированные системы жидкость-газ. Такие системы называются пенами.
Образование пенообразующей структуры белками возможно в связи с их способностью понижать поверхностное натяжение на грани раздела жидкость-газ.
Хорошие пенообразующие свойства имеют белки яиц, казеинаты и некоторые растительные белки.
Пены образуются при интенсивном механическом воздействии: встряхивании, сбивании, перекачивании, перемешивании и кипении. При выработке масла методом сбивания перед появлением масляных зёрен образуется крупноячеистая пена.
В некоторых случаях образование пены является нежелательным процессом. Например: при перекачивании или наполнении ёмкостей пена легко переливается через край и с ней теряются сухие вещества. При выпаривании обезжиренного молока и сыворотки в вакуум-выпарной установке происходит сильное пенообразование, это затрудняет ведение процесса. В данном случае используют пеногасители .
Гидролиз белков. Важное значение в пищевой технологии имеет расщепление белков под действием ферментов на пептиды и аминокислоты
O
H
H
протеаза О






R – CH
– C
– N
- CR2
+ H2O
R1CHC
+ R2CH
- COOH
– CH
– C
– N
- CR2
+ H2O
R1CHC
+ R2CH
- COOH




NH2 COOH NH2 OH NH2
Протеиназа пентидаза


 Белок
пептид аминокислота
кето
Белок
пептид аминокислота
кето
кислоты, альдегиды, кетоны, NH3, CO2, и т.д.
При созревании сыров происходит протеолиз белков. В результате образуются вещества которые создают определённый вкусовой букет сыра.
Реакция меланоидинообразования. При длительной тепловой обработке пищевых продуктов ( при топлении молока, выпечке хлеба) они приобретают коричневый или бурый цвет за счёт образования меланоидинов – продуктов реакции Майара.
белок ( аминогруппа ) + углеводы ( альдегидная группа) t ° С
м еланоидины
еланоидины
Ферменты ( от лат. fermentum – закваска ) – биологические катализаторы белковой природы ускоряющие химические реакции. Белки в составе ферментов могут быть простыми или сложными. Небелковая часть в составе фермента называется коферментом.
Коферментами могут быть металлы, витамины и др. соединения.
Ферменты называют по тому веществу, на которое они действуют, (субстрат) и прибавляют окончание “ аза”. Протеаза, пептидаза, липаза, лактоза и т.д. Кроме этих рабочих названий имеются более сложные систематические названия, отражающие механизм действия ферментов.
Действие фермента строго специфично, т.е. каждый фермент катализирует только одну химическую реакцию. На первой стадии ферментативной реакции фермент соединяется с субстратом. При этом образуется фермент-субстратный комплекс, который затем преобразуется с разрывом химических связей субстрата. Продукты реакции затем отщепляются от фермента.

 А1А2 + Ф
А1А2Ф А1 + Ф + А2
А1А2 + Ф
А1А2Ф А1 + Ф + А2
Ферменты действуют при определённой температуре и рН cреды; их активность зависит от наличия химических веществ-активаторов и ингибиторов. Оптимальная температура действия ферментов 30 – 50°С. При дальнейшем повышении температуры активность ферментов снижается, потому что денатурирует белок, образующий фермент.
Важным фактором , влияющим на активность ферментов является рН среды. Ферменты различаются по оптимальным для их действия рН. Так, оптимум действия пепсина находится при рН 1,5 – 2 , амилазы слюны – 7,2 - 7,3.
Известно около 3 тысяч различных ферментов. По современной классификации их делят на 6 классов :
1)Оксиредуктазы катализируют окисление и восстановление веществ.
2)Гидролазы катализируют гидролитическое ращепление сложных соединений: протеазы, липазы, лактазы.
3) Изомеразы – ферменты изомеризации катализируют структурные изменения в пределах одной молекулы.
4) Трансферазы катализируют перенос различных групп от одной молекулы к другой.
5) Лиазы – ферменты отщепления групп.
6) Синтетазы катализируют образование связей С – N, C – O, C– S
Наибольшее значение в технологии имеют ферменты гидролазы и оксиредуктазы.
Контрольные вопросы
Как можно классифицировать белки?
Химическое строение белков.
Как образуется первичная, вторичная, третичная и четверичная структура белков?
Какова роль белка для организма человека?
Назовите функции отдельных аминокислот в организме человека.
Расскажите об основных технологических свойствах белков (гидратация, денатурация, пенообразование).
Какое значение имеют процессы гидролиза белков и меланоидинообразования в пищевой технологии?
Что такое ферменты, приведите их классификацию?
