
Крива ток - потенціал
Розглянемо електроліз в системі, де катодом служить ртуті ний капає електрод, а анодом є практично непо-лярізуемий каломельний електрод. Зміна зовнішньої ЕРС в такій системі буде повністю йти на зміну потенціалу катода. Якщо в розчині немає речовин, здатних восстанавли тися під дією електричного струму, сила струму I буде пропорційна прикладеній напрузі Е (Закон Ома):
I = E / R.
де R - Опір.
У присутності речовин, здатних відновлюватися на ртутному електроді в області досліджуваних напруг, вид кри вої залежності струму від напруги істотно зміниться. По досягненні потенціалу відновлення іони почнуть разря тулитися на ртутному катоді нерідко з утворенням амальгами:
M n + + n e - + Hg = M (Hg) (1.1)
Потенціал ртутного катода, на якому протікає оборотний процес (1.1), виражається рівнянням Нернста:
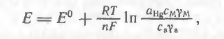 (1.2)
(1.2)
де з а-концентрація амальгами; g а - її коефіцієнт актив ності; з м - концентрація восстанавливающихся іонів в приелектродному шарі (заряд іона для простоти опущений); g м - його коефіцієнт активності; a Hg-активність ртуті в амальгамі; Е 0 - стандартний потенціал електрода (1.1).
В результаті процесу (1.1) сила струму в ланцюзі почне віз Растан і концентрація восстанавливающихся іонів у поверх ності ртутної краплі зменшиться. Проте за рахунок дифузії з маси розчину до поверхні краплі доставляються нові порції іонів. Сила струму в ланцюзі буде залежати від швидкості дифузії, яка пропорційна різниці концентрацій в масі розчину (з 0 м) і в приелектродному шарі (з м). Сила струму I буде пропорційна цієї різниці:
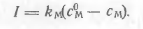 (1.3)
(1.3)
Вклад інших, недіффузіонних механізмів надходження ио нов в прікатодних шар в умовах великого надлишку індіф ферентного фонового електроліту пренебрежимо малий. Основне значення серед недіффузіонних процесів має міграція іонів до катода під дією електричного поля. Якщо не усунути викликається цим процесом міграційний струм, загальний струм виявиться неконтрольованим. Придушення міграційного струму досягається введенням у розчин в доста точної концентрації так званого індиферентного, тобто не приймає участі в електродної реакції, або фонового, електроліту зі значно більш від ріцательно потенціалом виділення, ніж у аналізованого іона.Катіони фонового електроліту екранують електрод, зменшуючи тим самим рушійну силу міграції під дією електричного поля практично до нуля.
При деякому потенціалі катода концентрація іонів у по верхности ртутної краплі з м зменшиться до мізерно малою порівняно з концентрацією в масі розчину, і швидкість раз ряду іонів на катоді стане рівною швидкості дифузії.
Концентрація відновлюється іона в глибині розчи ра постійна, так як електроліз йде при дуже невеликій силі струму (порядку 10 - 5 А), а концентрація в прікатодном шарі близька до нуля. Тому різниця концентрацій, визна ділячи швидкість дифузії при даній температурі, буде постійна, що і призводить до постійної швидкості надходження іонів до катода. Настало стан рівноваги буде ха характеризувати постійною силою струму, що не змінюється при подальшому збільшенні напруги. Цей постійний струм, контрольований дифузією, називають дифузійним і позначають I d. Вираз для сили дифузійного струму підлозі чає з рівняння (1.3) при См = 0:
I d = k м з 0 м (1.4)
Сила дифузійного струму прямо пропорційна концентра ції, що відновлюється іона в масі розчину. При сочета нии рівнянь (1.3) і (1.4) отримуємо
I = I d - k м з м
або
з м = I - I d / k м (1.5)
Концентрація амальгами, що утворилася в результаті процес са (1.1), пропорційна силі струму:
з а = k 'а I = I / K м. (1.6)
Співвідношення (1.5) і (1.6) підставляємо в рівняння (1.2).
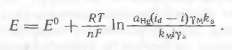 (1.7)
(1.7)
Деякі величини в цьому рівнянні постійні або залежать тільки від температури. Так, амальгама, що утворюється при електролізі на ртутному катоді, дуже розбавлена, тому ак тивность ртуті в амальгамі a Hg практично дорівнює активності чистої ртуті, тобто величина постійна. Коефіцієнт активності іонів g м при постійній іонній силі, яка створюється фоно вим електролітом, залишається постійним, так само як коефі ціент активності g а і коефіцієнти k м і k a. Виділимо в урав нении (1.7) величини, що залежать тільки від температури, і при дамо йому вид
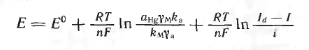 (1.8)
(1.8)
або
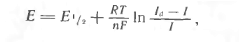 (1.9)
(1.9)
де
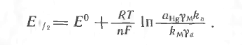 (1.10)
(1.10)
Рівняння (11.9) передає залежність сили струму від прикладений ного напруги при оборотному електродному процесі. Це рівняння полярографической хвилі, а величи ну Е 1/2 називають потенціаломнапівхвилі.
Типова залежність сили струму від прикладеної напруги ня дана на рис.1. Це полярографическая хвиль а (Полярограмма). З малюнка видно, що на початку процесу при невеликому потенціалі катода сила струму повільно збільшується із зростанням потенціалу - це так називає мий залишковий струм, його величина має порядок 10 - 7 А. По досягненні потенціалу відновлення на катоді починається розряд іонів і сила струму різко зростає, прагнучи до граничної величиною дифузійного струму.
При I = 1/2 I d рівняння (1.9) переходить в
Е = Е 1/2
Це співвідношення, так само як і (1.10), показує независи тість потенціалу напівхвилі від сили струму і, отже, від концентрації відновлюється іона. Потенціал полувол ни є, таким чином, якісної харак теристик іона в розчині даного фонового електролітів та і визначення потенціалу напівхвилі становить основу ка кількісний полярографічного аналізу.
Однак потенціал напівхвилі істотно залежить від середовища, природи і концентрації фонового електроліту. Особливе значен ня має наявність в розчині речовин, здатних до комплексоутворення з визначальним іоном. Присутність в досліджуваних мом розчині ліганда зміщує потенціал напівхвилі в отрица тельную область, що використовується для визначення складу і констант стійкості координаційних сполук. Зрушення по тенциала напівхвилі при введенні в розчин ліганда значитель але розширює можливості полярографічного аналізу, позво ляя створювати умови для визначення декількох компонентів тов в одному розчині без їх попереднього розділення. Наприклад, в 1 М К Cl іони свинцю (II) і талію (I) мають по потенціалів напівхвилі, відповідно, -0,435 і -0,483 В і на цьому тлі їх роздільне визначення нездійсненно. У 1 М NaOH потенціал напівхвилі свинцю стає рівним --- 0,755 В, а у талію залишається практично без змін, тому в лужному розчині ці іони можуть бути визначені при спільній присутності.
Якщо в розчині знаходиться кілька речовин, потенціали напівхвилі яких розрізняються на 100 мВ і більше, то на полярограма буде не одна хвиля, а кілька-за кількістю віднов навливал іонів (рис. 2), а можливо і більше, так як при ступінчастому відновленні один іон може давати дві хвилі. Наприклад, дві хвилі дає іон З u 2 + у присутності 1 М NH 3: перша при потенціалі напівхвилі - 0,20 В і другий;
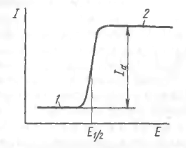
Рис.1 полярограма. 1-залишковий струм;
2-дифузний струм
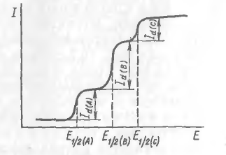
Рис. 2 полярограма при наявності в розчині відновлюють речовин A, B і С.
при -0,48 В. Можна отримати таким чином полярографический спектр іонів, а потім за цими даними і измеренному потенціалу
напівхвилі ідентифікувати невідому речовину. Цілком по Зрозуміло, що положення елемента в такому спектрі буде залежати від фонового електроліту: його природи і концентрації.
Полярограма, зображена на рис. 1, кілька ідеали зірованним, так як на ній не видно осциляції струму, викликаний ві періодичним відривом крапель ртуті. Іноді ці осцілля ції дуже ускладнюють роботу * особливо в області малих кон центраций визначається елемента.
Крім того, на полярограма нерідко виникають максі муми різної форми, що заважають визначенню справжнього потенціалу напівхвилі і сили струму. Розрізняють максимуми I і II роду. Теорія пов'язує їх появу з гідродінамі тичними явищами в розчині, що викликаються краплями ртуті, і адсорбційними процесами. Для придушення максимумів в по-лярографіруемий розчин зазвичай вводять поверхнево-активні речовини: желатин, агар-агар та ін Придушення максимумів поверхнево-активними речовинами лежить в основі декількох чутливих (до 10 - 9 моль / л) аналітичних методик визна ділення цих речовин в розчині.
Зв'язок дифузійного струму I d з концентрацією іона З м і іншими величинами передається рівнянням Ілько в і ч а:
I d = 605 Z D 1/2 m 2/3 t 1/6 З м (1.11)
де z - Заряд іона; D - Коефіцієнт дифузії; т - маса ртуті, що випливає з капіляра в 1 с, мг; t - Час образова ня краплі (період капання).
Серед величин, що входять в це рівняння, найважче піддається експериментальному визначенню коефіцієнт диф фузії D, а використання відповідних довідкових даних не завжди можливо. Тому коефіцієнт пропорційності між концентрацією речовини і силою дифузійного струму зазвичай встановлюють за допомогою стандартних розчинів. Дей ствительно, при постійних умовах полярографировании D, т і t постійні і рівняння (1.11) переходить в
I D = kс м . (1.12)
У зв'язку з цим в роботах по полярографии завжди вказується так звана характеристика капіляра, ви що значаться як m 2/3 t 1/6 . Лінійна залежність (1.12) є основою кількісного полярографічного аналізу.
СХЕМА полярографічного УСТАНОВКИ
Принципова схема полярографической установки перед ставлена на рис. З. Аналізований розчин 2 знаходиться в електролізері 3, на дні якого є шар ртуті 1, являю щійся анодом. Часто як анода використовують насичений ний каломельний електрод (НКЕ). Катодом служить ртутний капає електрод 4, з'єднаний з резервуаром ртуті 5. Внеш неї напругу, що подається на електроди, можна плавно ме няти за допомогою реохорда або дільника напруги 7и вимірюврять при цьому гальванометром 6 силу струму, що проходить через розчин.
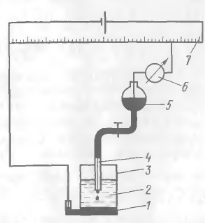
Рис.3 Схема полярографічної установки
Як вже зазначалося, напряже ня, яке подається на електрод, буде практично цілі ком визначати потенціал катода (капає ртутного електрода). У вольтамперометрии з успіхом застосовують також тверді мікроелектроди,що виготовляються з благородних металів (платини, золота та ін) або графіту. Основними гідний ствами твердих електродів явля ются можливість роботи в більш позитивній області потенциа лов (до 1,3 В), ніж з ртутним електродом (ртутний капає електрод використовується в області приблизно від 0,3 до --- 0,2 В), і їх нетоксичність (пари ртуті, як відомо, надзвичайно отруйні і робота з ртутним електродом вимагає суворого дотримання спеціальних правил техніки безпеки).
Проте використання твердих електродів також має свої труднощі, пов'язані, головним чином, з оновленням поверх ності електродів. Стаціонарні тверді електроди не знайшли широкого застосування в практиці через повільність встановлен ня граничного струму, невисокою чутливості та інших недоліків.
Значно більш широке застосування мають обертаю щіеся і вібруючі платинові мікроеле ктрод и, на яких стійка сила струму встановлюється швидко. При роботі таких електродів розчин безперервно пере перемішують, завдяки чому до поверхні електрода іони до представляються не тільки за рахунок дифузії, але і за рахунок механічного ського перемішування. Це значно (в 10 ... 20 разів) увеличи кість граничний струм порівняно з дифузійним. За точ ності методи із застосуванням твердих електродів часто поступаються методам, які використовують ртутний капає електрод, однак застосування обертового платинового мікроелектрода позво ляет істотно розширити область потенціалів, придатну для полярографічних вимірювань до 1,4 В в порівнянні з областю, в якій зазвичай застосовується ртутний капає електрод (до 0,3 В).
Проте ртутний капає електрод зберігає своє велике практичне значення, так як на твердих електродах обмежені катодні процеси за невеликого перенапруження ня водню на платині - з кислих розчинів на платині він починає виділятися при потенціалі близько
-0,1 В, а на ртуті тільки при -2,0 В. Промисловістю випускаються полярографи декількох марок, які придатні для виконання аналітичних робіт та проведення наукових досліджень (ПЕ-312, КАП-225у, ППТ-1 та ін.)
