
TOMP / Лекция_2
.pdf2 ПРОЦЕССЫ, ПРОТЕКАЮЩИЕ ПРИ ЗАТВЕРДЕВАНИИ СТАЛЬНЫХ СЛИТКОВ И ЗАГОТОВОК
2.1 Переохлаждение металла
Возможные варианты изменения температуры металла при кристаллиза-
ции показаны на рисунке 2.1. Затвердевание при постоянной температуре мо-
жет протекать только при очень малой скорости охлаждения. При достаточно высокой скорости охлаждения температура металла первоначально понижается ниже температуры затвердевания, т.е. имеет место так называемое переохлаж-
дение. При достижении определенной величины переохлаждения начинается кристаллизация металла. При этом в результате выделения теплоты кристалли-
зации температура расплава повышается и дальнейшее затвердевание протекает при неизменной температуре. Переохлаждение может наблюдаться во всем объеме металла или в локальной его области.
Описанный характер изменения температуры объясняется тем, что при возникновении в расплаве зародышей твердой фазы появляется новая межфаз-
ная поверхность «жидкий металл – кристалл», на которой действуют силы межфазного натяжения. Изменение энергии системы в результате выделения из расплава сферического зародыша твердой фазы будет равно
A = 4πr 2σк− р |
+ |
4 |
πr 3 ΔGж−т , |
(2.1) |
|
3 |
|||||
|
|
|
|
||
где r – радиус образующегося зародыша новой фазы; |
|
||||
σк− р – межфазное натяжение на границе раздела кристалла с расплавом;
– разница значений свободной энергии расплава и кристалла, отне-
сенная к единице объема металла.
При температуре кристаллизации жидкое и твердое состояние вещества энергетически эквивалентны и ΔGж−т = 0. Поэтому, когда включения новой фазы образуются в расплаве при температуре кристаллизации, энергия системы
увеличивается. Это означает, что такой процесс произвольно протекать не бу-
дет.
Устойчивое существование и рост включений твердой фазы становится возможными только по мере дальнейшего охлаждения расплава. В процессе охлаждения увеличивается значение ΔGж−т и при определенном переохлаж-
дении возникает ситуация, когда
A = 4πr 2σк− р |
+ |
4 |
πr 3 ΔGж−т < 0. |
(2.2) |
|
3 |
|||||
|
|
|
|
Начиная с этого момента в расплаве возникают устойчивые зародыши
новой фазы и начинается переход металла в твердое состояние. При этом в ре-
зультате выделения теплоты кристаллизации температура металла повышается и дальнейшее затвердевание протекает при температуре кристаллизации.
Устойчивый рост кристаллов возможен, только если их радиус превыша-
ет некоторое критическое значение rкр. Величина rкр уменьшается по мере роста переохлаждения расплава.
2.2 Усадка металла при затвердевании
Переход металла из жидкого состояния в твердое и дальнейшее охлаж-
дение его до комнатных температур сопровождается уменьшением объема, ко-
торое называется усадкой.
Величина усадки при затвердевании зависит от состава стали и увеличи-
вается с ростом интервала между температурами ликвидус и солидус. Наиболее сильное влияние на величину усадки стали при кристаллизации оказывает кон-
центрация углерода. В зависимости от содержания углерода усадка металла при
затвердевании составляет: |
|
|
|
|
Содержание углерода, % |
0,10 |
0,35 |
0,45 |
0,70 |
Уменьшение объема стали при |
2,0 |
3,0 |
4,3 |
5,3 |
затвердевании, % |
|
|
|
|

Для оценочных расчетов величину объемной усадки металла при затвер-
девании можно принимать равной 3 – 3,5%.
2.3 Скорость затвердевания стали
Толщину слоя затвердевшего металла при кристаллизации в изложнице с достаточной точностью можно определить по формуле
D = k |
|
, |
(2.3) |
τз |
где D – толщина слоя затвердевшего металла, см;
τз – продолжительность затвердевания, мин; k – коэффициент затвердевания, см/мин0,5.
При затвердевании спокойной стали в изложницах величина коэффици-
ента затвердевания обычно составляет 2,2 – 2,9 см/мин0,5 в зависимости от со-
става и условий затвердевания металла.
2.4 Ликвация при затвердевании стальных слитков и заготовок
2.4.1 Причины возникновения ликвации
Ликвацией называется неравномерное распределение примесей в твердом металле, возникающее в процессе затвердевания. Различают макро ликвацию – неравномерное распределение примесей между отдельными зонами слитка и микро ликвацию – неравномерное распределение примесей в пределах каждого кристалла.
Сталь представляет собой расплав сложного состава, затвердевание кото-
рого протекает в интервале температур между температурами ликвидус и соли-
дус. В этом температурном интервале в расплаве одновременно присутствуют кристаллы затвердевшего металла и остаток жидкой фазы. Растворимость большинства примесей в твердом и жидком металле различна. Это приводит к
перераспределению примесей между затвердевшим металлом и остатком рас-
плава, т.е. к появлению ликвации.
Отношение концентраций элемента в твердой и жидкой фазах, которые находятся в состоянии равновесия, принято характеризовать величиной равно-
весного коэффициента распределения
Ko = Cc /C л , |
(2.3) |
где Сс – концентрация примеси в твердом металле;
C л – концентрация примесей в жидкой фазе.
Возможные варианты распределения примесей между твердым металлом и расплавом при затвердевании показаны на рисунке 2.2. В расплавах на основе железа для большинства примесей характерным является случай, когда из рас-
плава первоначально выделяются наиболее чистые кристаллы, а остаток жид-
кости обогащается примесями.
2.4.2 Склонность элементов к ликвации в расплавах железа
Для количественной характеристики склонности различных примесей к ликвации введено понятие коэффициента ликвации K , который численно ра-
вен отношению максимальной растворимости элемента в δ − Fe или γ − Fe
вблизи температуры ликвидус к концентрации его в последней порции затвер-
девающего металла.
В качестве примера на рисунке 2.3 показан фрагмент диаграммы состоя-
ния системы Fe − C . Из рисунка видно, что максимальная растворимость угле-
рода в твердом δ − Fe (точка H ) равна 0,075%. При той же температуре содер-
жание углерода в находящемся в равновесии с твердой фазой расплаве (точка
B ) равно 0,59%. Следовательно, для δ − Fe величина коэффициента ликвации будет равной 0,13.

Склонность примеси к ликвации тем больше, чем меньше численное зна-
чение коэффициента K или больше разность (1− K ). Значения коэффициентов
K и 1− K для различных примесей в железе приведены в таблице 2.1.
Таблица 2.1 – Коэффициенты ликвации примесей в железе
Коэффициент ликвации
Элемент |
t , оС* |
K |
|
1− K |
|
|
|
|
|
|
|
|
|
δ − Fe |
δ − Fe |
|
γ − Fe |
|
|
|
|
|
|
S |
30 |
0,02 |
0,98 |
|
0,98 |
O |
65 |
0,02 |
0,98 |
|
0,98 |
B |
90 |
0,05 |
0,95 |
|
0,96 |
P |
28 |
0,13 |
0,87 |
|
0,94 |
C |
73 |
0,13 |
0,87 |
|
0,64 |
Ti |
18 |
0,14 |
0,86 |
|
0,93 |
N |
– |
0,28 |
0,72 |
|
0,46 |
H |
– |
0,32 |
0,68 |
|
0,55 |
Cu |
7 |
0,56 |
0,44 |
|
0,12 |
Si |
12 |
0,66 |
0,34 |
|
0,50 |
Mo |
2 |
0,80 |
0,20 |
|
0,40 |
Ni |
3,5 |
0,80 |
0,20 |
|
0,05 |
Mn |
3 |
0,84 |
0,16 |
|
0,05 |
Co |
1,8 |
0,90 |
0,10 |
|
0,05 |
Y |
2 |
0,90 |
0,10 |
|
– |
Al |
3 |
0,92 |
0,08 |
|
– |
W |
<1 |
0,95 |
0,05 |
|
0,50 |
Cr |
1 |
0,95 |
0,05 |
|
0,15 |
|
|
|
|
||
Примечание: |
t – понижение температуры плавления металла при введении |
||||
1% элемента |
|
|
|
|
|
Из приведенных данных видно, что в расплавах железа более других склонны к ликвации сера, кислород, бор, фосфор, углерод, титан.
2.4.3Влияние условий затвердевания на развитие ликвационных процессов
Качественные выводы о влиянии условий затвердевания на характер лик-
вационных процессов можно сделать с помощью рисунка 2.4.
На рисунке 2.4а показан характер распределения примеси в затвердевшем и жидком металле при очень малой скорости охлаждения. Первоначально из расплава с концентрацией примеси Co выделяются наиболее чистые кристаллы с Сс = KoCo , а жидкость перед фронтом затвердевания обогащается приме-
сью. При очень малой скорости кристаллизации успевает завершиться вырав-
нивание состава металла в объеме жидкой фазы. Поэтому в процессе затверде-
вания концентрация примеси в жидкой фазе C л непрерывно увеличивается.
Одновременно увеличивается и содержание примеси в выделяющихся из жид-
кости кристаллах. Следовательно, малые скорости затвердевания металла спо-
собствуют развитию зональной ликвации.
На рисунке 2.4б показан характер распределения примесей в затвердев-
шем и жидком металле при затвердевании с высокой скоростью охлаждения при отсутствии перемешивания жидкой фазы затвердевающего слитка. В этом случае из расплава с концентрацией примеси Co первоначально также выде-
ляются наиболее чистые кристаллы с Сс = KoCo . Но, при высокой скорости затвердевания примеси не успевают отводиться от фронта кристаллизации в объем расплава. Поэтому непосредственно перед фронтом затвердевания жид-
кий металл обогащается примесью до концентрации Скр . При большой скоро-
сти затвердевания и малой скорости отвода примеси в объем жидкого металла
Скр быстро увеличивается, достигая величины Скр = C л / Ko . Соответственно увеличивается и концентрация примеси в затвердевающем металле, достигая концентрации ее в исходном жидком металле Co . После этого затвердевание
металла происходит при C л = Сс = Co . Следовательно, высокие скорости за-
твердевания металла подавляют развитие ликвационных процессов.
Скорость затвердевания металла при прочих равных условиях определя-
ется сечением отливаемого слитка. По этой причине, например, легированную и качественную углеродистую сталь предпочтительно разливать в слитки мало-
го и среднего развеса, при затвердевании которых скорости кристаллизации выше, чем при отливке крупных слитков. Еще более высокие скорости кри-
сталлизации достигаются при разливке металла в заготовки малого сечения на МНЛЗ.
На рисунке 2.4в показан характер распределения примесей в затвердев-
шем и жидком металле при ограниченной скорости охлаждения и перемешива-
нии жидкой фазы слитка. Первоначально из жидкого металла выделяются наи-
более чистые кристаллы, а жидкость перед фронтом затвердевания обогащается примесями. Но, перемешивание жидкой фазы слитка способствует росту скоро-
сти отвода примесей от фронта кристаллизации в объем жидкого металла. При ограниченной скорости кристаллизации и интенсивном перемешивании вели-
чина Скр увеличивается с малой скоростью. Поэтому в процессе кристаллиза-
ции постепенно увеличивается Сс и одновременно происходит накопление примесей в жидкой фазе слитка. Следовательно, активное перемешивание за-
твердевающего металла способствует развитию зональной ликвации.
Типичным примером затвердевания с интенсивным перемешиванием жидкой фазы слитка является разливка кипящей стали. Поэтому, чтобы избе-
жать чрезмерного развития ликвации, технология разливки кипящей стали обя-
зательно включает операцию механического или химического закупоривания.
Главной задачей этой операции является прекращение кипения после формиро-
вания плотной наружной зоны слитка.
2.5 Концентрационное переохлаждение при затвердевании металла
Если ликвирующие примеси не вступают между собой в химические ре-
акции, то в результате обогащения примесями жидкости у фронта затвердева-
ния температура плавления металла понижается (см. таблицу 2.1). В результате этого непосредственно перед фронтом затвердевания температура плавления металла может существенно понижаться. Это приводит к появлению так назы-
ваемого концентрационного переохлаждения.
Рассмотренные выше примеры соответствуют случаю, когда ликвирую-
щие примеси между собой не взаимодействуют. Но, часто при обогащении рас-
плава примесями у фронта кристаллизации возникают условия для протекания химических реакций, образования новых фаз. Примером может служить кипе-
ние металла в изложнице при разливке кипящей стали.
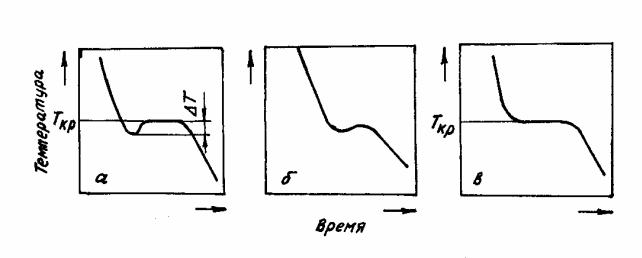
Рисунок 2.1 – Изменение температуры металла при кристаллизации
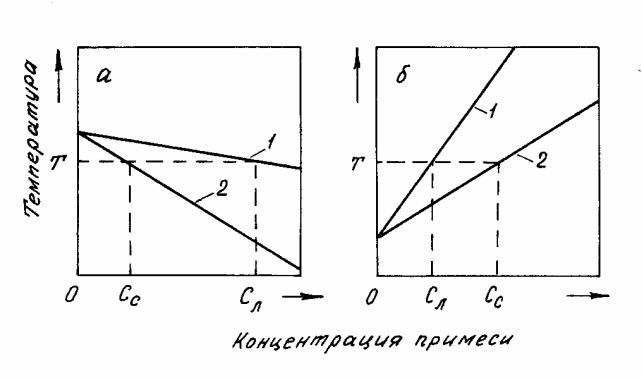
1 – линия ликвидус; 2 – линия солидус
Рисунок 2.2 – Распределение примесей при кристаллизации металла
