
TOMP / Лекция_3
.pdf3 ОКИСЛЕНИЕ ПРИМЕСЕЙ СТАЛЕПЛАВИЛЬНОЙ ВАННЫ ПРОДУВКОЙ ГАЗООБРАЗНЫМ КИСЛОРОДОМ, КИСЛОРОДОМ ГАЗОВОЙ ФАЗЫ АГРЕГАТА И ТВЕРДЫХ ОКИСЛИТЕЛЕЙ
3.1 Окисление примесей металла продувкой газообразным кислородом
3.1.1 Механизм реакций
При продувке металла газообразным кислородом в его объеме обычно выделяют первичную и вторичную реакционные зоны. Деление ванны на пер- вичную и вторичную реакционные зоны является условным. Четких границ между ними не существует, они различаются характером протекающих в них процессов.
В первичной реакционной зоне газообразный кислород непосредственно взаимодействует с жидким металлом. При этом в первую очередь окисляются примеси, обладающие наиболее высоким химическим сродством к кислороду, по реакциям
[C] |
+ |
0,5{O2 } |
= |
{CO} , |
(3.1) |
[Si] |
+ |
{O2 } = |
|
(SiO2 ) , |
(3.2) |
[Mn] |
+ |
0,5{O2 } |
= |
(MnO) |
(3.3) |
и др., которые принято называть реакциями прямого окисления.
Реакции (3.1) – (3.3) являются сильными экзотермическими реакциями. В результате выделения большого количества тепла в ограниченном участке ван- ны первичная реакционная зона характеризуется высокими температурами, ко- торые согласно данным различных исследователей могут достигать 2500 – 3000оС и более.
При таких температурах химические реакции обычно протекают в диф- фузионной области, т.е. их лимитирующими звеньями является массоотдача примесей из объема металла. Поэтому спустя очень короткое время непосред-
ственно на поверхности раздела фаз и на небольшом расстоянии от нее обла- дающие наиболее высоким химическим сродством к кислороду примеси метал- ла будут окислены, в результате чего при наличии избытка кислорода возника- ют условия для окисления железа по реакции
[Fe] + 0,5{O2 } = (FeO) . |
(3.4) |
Таким образом главная особенность реакций, протекающих в первичной реакционной зоне, заключается в том, что в ней по реакциям прямого окисле- ния одновременно окисляются все без исключения компоненты жидкого метал- ла в тех соотношениях, в которых они присутствуют в расплаве.
В традиционных сталеплавильных процессах содержание железа в жид- ком металле обычно составляет 90% и более, поэтому главным продуктом ре- акций в первичной реакционной зоне является FeO . Образовавшийся в пер- вичной реакционной зоне оксид железа частично растворяется в металле по ре- акции
(FeO) = Fe + [O] , |
(3.5) |
оставшееся его количество поступает в шлак.
Во вторичной реакционной зоне происходит перераспределение кисло- рода между образовавшимся в первичной реакционной зоне оксидом железа и обладающими более высоким химическим сродством к кислороду примесями металла по реакциям
|
[C] + [O] |
= {CO} , |
|
(3.6) |
|||
[Si] + 2(FeO) = |
(SiO2 ) |
+ |
2Fe , |
(3.7) |
|||
[Mn] |
+ |
(FeO) |
= |
(MnO) |
+ |
Fe , |
(3.8) |
2[P] |
+ |
5(FeO) |
= |
(P2O5 ) |
+ |
5Fe |
(3.9) |
и др. В отличие от реакций, протекающих в первичной реакционной зоне, реак- ции (3.7) – (3.9) принято называть реакциями косвенного окисления.
Исследования показывают, что при продувке ванны газообразным кисло- родом удаление из металла основного количества примесей протекает во вто- ричной реакционной зоне по реакциям косвенного окисления.
Таким образом главной особенностью механизма окисления примесей металла при продувке газообразным кислородом является то, что оно является результатом последовательного протекания двух процессов. В первичной реак- ционной зоне вдуваемый в ванну кислород расходуется главным образом на окисление железа по реакции (3.4). А удаление основного количества примесей металла протекает во вторичной реакционной зоне и является результатом ре- акций косвенного окисления.
3.1.2 Последовательность окисления примесей
Из описанного выше механизма реакций следует, что при продувке ванны газообразным кислородом происходит одновременное окисление всех без ис- ключения компонентов металлического расплава. При этом с наиболее высо- кими скоростями протекают реакции, которые максимально удалены от состоя- ния термодинамического равновесия. Мерой отклонения системы от равновес- ного состояния может служить величина изменения энергии Гиббса, которая для реакции
m[E] + n(FeO) = (EmOn ) + nFe |
(3.10) |
определяется из выражения
G = RT (ln X |
o |
− ln K ) = |
Go + RT |
a(EmOn) |
. |
(3.11) |
|
||||||
|
|
|
am *an |
|
||
|
|
|
|
[E] (FeO) |
|
|
Из уравнения (3.11) видно, что изменение энергии Гиббса реакции зависит от химического сродства элемента по отношению к кислороду, которое можно ха-
рактеризовать величиной ΔGo , а также от соотношения активностей взаимо- действующих веществ в металле и шлаке. Поэтому по ходу продувки скорости окисления компонентов металлического расплава могут меняться в широких пределах.
Изменение расхода кислорода на протекание различных реакций при продувке чугуна показано на рисунке 3.1.
В начальном периоде рафинирования основное количество вдуваемого в ванну кислорода расходуется на окисление примесей, имеющих наиболее вы- сокое химического сродство к кислороду (кремний, марганец, фосфор и др.). Поэтому по ходу продувки содержание их в металле быстро уменьшается, что приводит к снижению скорости реакций по мере приближения остаточных кон- центраций примесей к равновесным значениям.
После окисления марганца и кремния основное количество вдуваемого в ванну кислорода расходуется на окисление углерода. Эта реакция остается ве- дущей до достижения остаточного содержания углерода 0,05%. Вместе с тем при концентрации углерода в менее 0,2 – 0,3% быстро увеличивается доля ки- слорода, который расходуется на окисление железа. При этом скорость окисле- ния углерода снижается, а концентрация оксидов железа в шлаке и содержание растворенного в металле кислорода увеличиваются.
При остаточном содержании углерода менее 0,05% основное количество вдуваемого в ванну кислорода расходуется на окисление железа. При концен- трации углерода менее 0,02% на окисление железа расходуется практически весь вдуваемый в ванну кислород. По этой причине концентрация углерода, равная 0,02%, обычно считается пределом обезуглероживания металла в откры- тых сталеплавильных агрегатах.
3.1.3 Скорость реакций во вторичной реакционной зоне и способы ее регулирования
В пункте 3.1.1 показано, что в первичной реакционной зоне вдуваемый в ванну кислород расходуется преимущественно на окисление железа. Образо- вавшийся при этом FeO частично растворяется в металле по реакции (3.5), а оставшееся его количество поступает в шлак.
Во вторичной реакционной зоне протекает перераспределение кислорода между оксидами железа шлака и примесями металла, обладающими более вы- соким химическим сродством к кислороду в сравнении с железом. Скорость

перераспределения кислорода зависит от интенсивности перемешивания ме- талла и шлака, которую в первом приближении можно охарактеризовать мощ- ностью перемешивания ванны всплывающими пузырями оксида углерода.
При подъеме пузырей CO с начальной глубины H к поверхности металла мощность перемешивания металла в результате изотермического расширения газа можно определить из уравнения
W = 0,267vC M MeT lg |
Po + ρgH |
, |
(3.12) |
Po |
где vC – скорость окисления углерода, %/мин;;
M Me – масса металла, т;
T – температура, К;
Po – давление над поверхностью металла, Па;
ρ – плотность металла, кг/м3;
g – ускорение свободного падения, м/с2.
Анализ уравнения (3.12) показывает, что при неизменной интенсивности продувки мощность перемешивания ванны определяется скоростью окисления углерода и глубиной проникновения струи кислорода в металл. При помощи этого уравнения можно объяснить ряд явлений, которые наблюдаются при ра- финировании металла продувкой кислородом:
1. Для обеспечения высокой скорости растворения извести в шлаке в на- чальном периоде кислородно-конвертерной плавки необходимо получить шла- ки с высоким содержанием FeO .
С этой целью продувку начинают при помощи фурмы, расположенной над уровнем спокойного металла на высоте 1,5 – 3,0 м. При этом уменьшается глубина проникновения струи кислорода в расплав, снижается интенсивность перемешивания металла и шлака и скорость реакций во вторичной реакционной зоне. Это способствует обогащению шлака поступающими из первичной реак- ционной зоны оксидами железа.
2.При выплавке стали в кислородных конвертерах в середине продувки обычно наблюдается значительное понижение содержания FeO в шлаке.
Это явление объясняется тем, что в середине продувки основное количе- ство вдуваемого в ванну кислорода расходуется на обезуглероживание распла- ва. При этом увеличивается количество выделяющегося из ванны газа, повыша- ется интенсивность перемешивания металла и шлака и скорость реакций во вторичной реакционной зоне.
3.При выплавке стали в кислородных конвертерах после подачи в рас- плав расчетного количества кислорода возможна ситуация, когда концентрация углерода в металле соответствует марке выплавляемой стали, а температура металла не позволяет нормально провести операции выпуска и разливки. При этом возникает необходимость в дополнительной продувке, которая позволит нагреть металл без значительного изменения концентрации углерода.
Эта задача решается продувкой металла при помощи фурмы, располо- женной на большой высоте над уровнем расплава. При этом в первичной реак- ционной зоне окисляется железо и за счет тепла, выделяющегося при протека- нии этой реакции, происходит нагрев ванны. А малая скорость реакций во вто- ричной реакционной зоне способствует обогащению шлака оксидами железа при незначительном изменении химического состава металла.
4.При выплавке стали в кислородных конвертерах донного дуться окис- ленность шлака при прочих равных условиях значительно ниже, чем в конвер- терах верхнего дутья.
Это объясняется тем, что при продувке металла кислородом через донные фурмы струя кислорода проникает в расплав на максимально возможную глу- бину. При этом интенсивное перемешивание ванны способствует высокой ско- рости реакций во вторичной реакционной зоне, что ведет к понижению концен- трации FeO в шлаке.
Уменьшение содержания FeO в шлаке наблюдается также в конвертерах комбинированного дутья при использовании дополнительной продувки ванным газом через днище и др.
3.2 Окисление примесей металла кислородом газовой фазы агрегата
Окисление примесей металла за счет поступления кислорода из газовой фазы получает наибольшее развитие при выплавке стали в мартеновских печах. Газовая фаза этих агрегатов содержит 2 – 5% кислорода, который вносится воз- духом, подаваемым с некоторым избытком для сжигания топлива и дожигания выделяющегося из ванны CO . Кроме того, окислительной способностью по от- ношению к железу и низшему его оксиду обладают продукты горения топлива
( CO2 и H 2O ).
Основные реакции, протекающие при окислении примесей металла ки- слородом газовой фазы мартеновской печи, показаны на рисунке 3.2. Согласно приведенной схеме этот процесс включает следующие основные звенья:
1.Массоотдача кислорода из объема газовой фазы к поверхности раздела газ – шлак;
2.Окисление кислородом газовой фазы (FeO) до (Fe2O3) у поверхности раз-
дела газ – шлак;
3.Массоперенос (Fe2O3) в объеме шлака от поверхности раздела газ – шлак к поверхности раздела шлак – металл;
4.Восстановление (Fe2O3) железом жидкого металла по реакции
(Fe2O3 ) + Fe = 3(FeO) ; |
(3.13) |
5.Растворение кислорода в жидком металле по реакции (3.5);
6.Окисление примесей металла растворенным в металле кислородом и (FeO) ;
7.Массоперенос (FeO) в объеме шлака от поверхности шлак – металл к по-
верхности шлак – газ, после чего описанные выше процессы повторяются. Реакции окисления примесей металла кислородом газовой фазы стале-
плавильного агрегата включает большое количество звеньев, связанных с мас- сопередачей кислорода через поверхности раздела фаз, а также массопереносом его в объеме газовой фазы, металла и шлака. По этой причине скорости окисле-
ния примесей при поступлении кислорода из газовой фазы агрегата имеют ми- нимальные значения.
В учебной литературе последних лет издания приводятся сведения о том,
что в объеме жидкого шлака кислород переносится в виде иона (FeO2− ) . Это
утверждение основано на том, что при температурах сталеплавильных процес- сов Fe2O3 ввиду высокой упругости диссоциации является неустойчивым со-
единением. По этой причине присутствие его в шлаке возможно в виде химиче- ских соединений типа ферритов ( MeO*Fe2O3 ). В основных сталеплавильных
шлаках наиболее устойчивым соединением этого типа является феррит каль- ция, который согласно ионной теории строения шлаков диссоциирует на катион
(Ca2+ ) и два аниона (FeO2− ) .
3.3 Окисление примесей металла кислородом твердых окислителей
При отсутствии возможности продувки ванны кислородом увеличить скорости реакций окислительного рафинирования можно путем присадки в ванну твердых окислителей (железная руда, прокатная окалина, агломерат и др.).
В этом случае первым звеном реакции является растворение твердого окислителя в шлаке
Fe2O3 |
= (Fe2O3 ) , |
(3.14) |
после чего процесс протекает согласно схеме, описанной в предыдущем разде- ле.
Главная особенность окисления примесей металла кислородом твердых окислителей заключается в том, что результатом последовательного протекания реакций (3.14), (3.13) и (3.5) является реакция
Fe2O3 |
= |
2Fe |
+ 3[O] , |
(3.15) |
G o = 396000 |
− |
218,67T Дж/моль. |
(3.16) |
|
Реакция (3.15) является сильной эндотермической реакцией. Поэтому для про- цессов окисления примесей металла кислородом твердых окислителей харак- терны значительно меньшие тепловые эффекты экзотермических реакций окисления кремния, марганца и фосфора, а реакция окисления растворенного в железе углерода кислородом твердых окислителей является сильной эндотер- мической реакцией.
В этих условиях рафинирование металла присадками твердых окислите- лей может проводиться только при наличии в рабочем пространстве печи ис- точника тепла (факел, электрическая дуга и др.), а возможная скорость окисле- ния примесей обычно определяется эффективностью тепловой работы стале- плавильного агрегата.
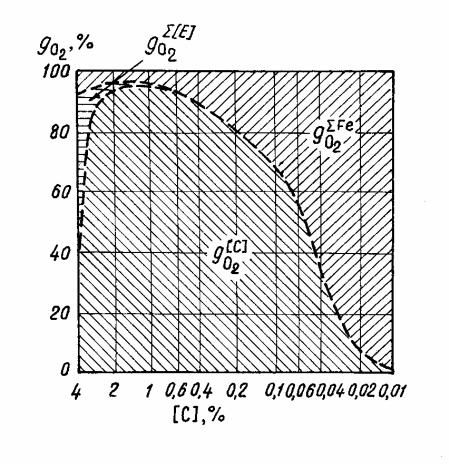
|
|
|
|
|
|
|
g |
Σ[E] – расход кислорода на окисление кремния, марганца, фосфора и др.; |
|||||
|
O |
|
|
|
|
|
|
2 |
|
|
|
|
|
g |
[C] |
– расход кислорода на окисление углерода; g |
ΣFe |
– расход кислорода на |
||
|
O |
|
|
O |
|
|
|
2 |
|
|
2 |
|
|
окисление железа и растворение в металле
Рисунок 3.1 – Изменение расхода кислорода на окисление компонентов металла при рафинировании чугуна кислородом дутья:
