
TOMP / Лекция_8
.pdf8 ВЛИЯНИЕ ПОВЕРХНОСТНОЙ ЭНЕРГИИ ГРАНИЦЫ РАЗДЕЛА ФАЗ НА ПРОТЕКАНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
8.1Пересыщение раствора при протекании гетерогенных химических реакций
Протекание реакций окислительного рафинирования сопровождается об- разованием нерастворимых в жидком металле оксидов, которые выделяются из расплава в виде включений новой фазы. По этой причине реакции окислитель- ного рафинирования должны быть отнесены к числу гетерогенных реакций.
Протекание любой гомогенной химической реакции возможно в том слу- чае, когда оно сопровождается понижением энергии Гиббса системы. Это усло- вие может быть записано уравнением
ΔG = RT ln X |
|
− ln K |
= |
RT ln |
X o |
< |
0 , |
(8.1) |
|
o |
K |
||||||||
|
|
|
|
|
|
|
|||
где K – константа равновесия реакции; |
|
|
|
|
|
||||
X o – величина подобная константе равновесия, |
но составленная из |
||||||||
фактических активностей взаимодействующих веществ.
Для обозначения фактических активностей реагентов в дальнейших фор- мулах будет использован индекс «ф».
Если протекание химической реакции сопровождается образованием кон- денсированных или газообразных оксидных включений, в расплаве возникает новая поверхность раздела фаз. На этой поверхности действуют силы межфаз- ного натяжения, в результате чего общий уровень энергии системы увеличива- ется. При этом соотношение (8.1) с достаточной точностью может быть исполь- зовано для определения возможности протекания реакции только при больших размерах выделяющихся из раствора включений и малой величине их удельной

поверхности.
Если возникающие в растворе частицы новой фазы малы, они обладают большой удельной поверхностью и высокими значениями поверхностной энер- гии
|
Gпов = σS уд , |
(8.2) |
где G |
– поверхностная энергия включений новой фазы, Дж/м3; |
|
пов |
|
|
σ – величина межфазного натяжения на границе расплав – включе- ние, Дж/м2;
S уд – удельная поверхность включений, м-1.
Поэтому при малых размерах выделяющихся из расплава включений пре- небрегать величиной их поверхностной энергии при определении общего изме- нения энергии системы в результате протекания химической реакции нельзя.
Согласно существующим представлениям при протекании реакций осаж- дающего раскисления диаметр зародышей оксидной фазы составляет 10-6 – 10-7 см. В этом случае произвольное протекание химической реакции будет воз- можным, если изменение энергии Гиббса системы, рассчитанное без учета по- верхностной энергии частиц новой фазы, по абсолютной величине превышает Gпов . Это условие может быть записано уравнением
ΔG + Gпов = |
RT ln |
X o |
+ Gпов < 0 , |
(8.3) |
K |
из которого следует
RT ln |
K |
> |
G |
|
, |
(8.4) |
|
|
|
||||||
|
|
X o |
|
пов |
|
|
|
K |
> |
G |
|
RT |
|
|
|
e пов |
|
. |
(8.5) |
||||
|
|
|
|||||
X o |
|
||||||
|
|
|
|
|
|
||
Выясним физический смысл отношения K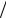 X o при протекании реакции
X o при протекании реакции
m[R] |
+ |
n[O] |
= (RmOn ) . |
(8.6) |
|||||||||
Для реакции (8.6) |
|
|
|
|
|
|
|
|
|
|
|
||
|
K |
= |
|
|
a(RmOn ) |
|
, |
|
|
(8.7) |
|||
|
|
|
|||||||||||
|
|
|
|
|
|
am |
an |
|
|
|
|
||
|
|
|
|
|
|
[R] |
|
[O] |
|
|
|
|
|
|
X o |
= |
|
|
a(RmOn )ф |
|
. |
(8.8) |
|||||
|
|
am |
|
an |
|
||||||||
|
|
|
|
|
|
[R]ф |
[O]ф |
|
|||||
Если химический состав продуктов реакции остается неизменным, получим |
|||||||||||||
|
|
|
|
|
am |
|
an |
|
|
|
|
||
|
K |
= |
|
|
[R]ф |
[O]ф |
. |
(8.9) |
|||||
|
|
|
|
|
a m |
|
|
||||||
|
X o |
|
|
|
|
an |
|
|
|
|
|||
|
|
|
|
|
|
[R] |
[O] |
|
|
|
|
||
Из уравнения (8.9) видно, что отношение K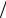 X o показывает во сколько раз фактическое произведение активностей взаимодействующих веществ пре- вышает произведение их активностей в состоянии термодинамического равно- весия. В связи с этим отношение K
X o показывает во сколько раз фактическое произведение активностей взаимодействующих веществ пре- вышает произведение их активностей в состоянии термодинамического равно- весия. В связи с этим отношение K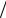 X o принято называть пересыщением сис-
X o принято называть пересыщением сис-
темы.
Таким образом, соотношение (8.5) свидетельствует о том, что выделение из расплава нерастворимых продуктов реакции возможно только при наличии некоторого пересыщения системы взаимодействующими веществами, величина которого быстро увеличивается с ростом поверхностной энергии на границе раздела фаз.
Величина Gпов в уравнении (8.5) определяется соотношением |
|
||||
|
G |
= |
σSM |
, |
(8.10) |
|
|
||||
|
пов |
|
ρV |
|
|
где S – |
площадь поверхности, м2; |
|
|
|
|
V – |
объем, м3; |
|
|
|
|
ρ – плотность, кг/м3;
M– молекулярная масса включений, кг/моль;
σ– межфазное натяжение на границе включения с металлом, Дж/м2. Из выражений (8.5) и (8.10) нетрудно видеть, что величина пересыщения,
необходимого для образования в растворе включений новой фазы, возрастает при увеличении межфазного натяжения на границе расплав-включение, отно- шения площади поверхности частиц новой фазы к их объему (то есть при уменьшении размеров образующихся включений), а также при уменьшении плотности продуктов реакции.
Особенно трудно выделить из гомогенного расплава газообразные про- дукты реакции, например, оксид углерода. Это объясняется тем, что межфазное натяжение на границе раздела CO с металлом и составляет 1200 – 1500 мДж/м2. Эта величина в 2 – 3 раза превышает межфазное натяжение на границе между металлом и твердыми или жидкими оксидными включениями. Вместе с тем плотность оксида углерода при температурах сталеплавильных процессов на четыре порядка меньше плотности конденсированных оксидов.
Расчеты показывают, что, если размер зародыша новой фазы принять равным 10-7 см, то для выделения из расплава MnO и CO потребуется пересы- щение его взаимодействующими веществами равное соответственно 5 и 105.
8.2 Критический радиус неметаллических включений в стали
При выделении из раствора сферического включения новой фазы радиу- сом r суммарная величина изменения энергии Гиббса системы составит
|
G = (µ |
2 |
− µ )n + 4πr 2σ = |
|
|
||||
|
|
|
|
1 |
|
|
|
|
|
= |
|
4 |
πr3 ρ(µ |
− µ ) |
N A |
+ 4πr 2σ |
, |
(8.11) |
|
3 |
|
||||||||
|
|
2 |
1 M |
|
|
|
|||
где µ2 и µ1 – химические потенциалы веществ в новой фазе и в раство-
|
ре, Дж; |
|
n – число молекул во включении новой фазы; |
|
N A – число Авогадро (6,023·1023 моль-1). |
При |
анализе уравнения (8.11) следует учитывать, что величина |
(µ2 − µ1 ) |
< 0 . Поэтому при выделении из расплава продуктов реакций харак- |
тер изменения энергии Гиббса системы существенно меняется в зависимости от размеров образующихся неметаллических включений. Выделение из раствора включений малого размера сопровождается увеличением энергии системы, в связи с чем они являются термодинамически неустойчивыми. При достижении некоторого критического радиуса образующихся в расплаве включений rкр
дальнейшее увеличение размеров частиц будет сопровождаться уменьшением энергии системы. При этом рост частиц новой фазы становится энергетически выгодным. Характер изменения энергии Гиббса системы в зависимости от ра- диуса выделяющихся из раствора частиц иллюстрируется схемой на рис. 8.1.
Для определения величины rкр необходимо приравнять к нулю первую
производную уравнения (8.11) по радиусу частиц. При этом получится:
|
d G |
|
= |
4πr 2 |
ρ(µ |
2 |
− µ ) |
N A |
|
+ |
|
8πr σ = 0 |
, |
(8.12) |
|||||
|
dr |
M |
|||||||||||||||||
|
|
кр |
|
1 |
|
|
|
кр |
|
|
|
||||||||
|
rкр |
= |
− |
|
2σM |
|
|
= |
|
2σM |
. |
|
(3.13) |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
(µ1 − µ2 )ρN A |
|
||||||||||||
|
|
|
|
(µ2 − µ1 )ρN A |
|
|
|
|
|||||||||||
Учитывая, что при Gпов = 0 выполняются соотношения: |
|
|
|
||||||||||||||||
|
|
|
|
(µ1 − µ2 )N A |
= |
|
− |
|
G , |
|
|
(8.14) |
|||||||
|
|
|
|
|
− ΔG |
= |
RT ln |
K |
|
, |
|
|
|
(8.15) |
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
X o |
|
|
|
|||
уравнение (8.13) можно привести к виду
rкр = |
2σM |
|
||
|
|
. |
(8.16) |
|
ρRT ln |
K |
|||
|
X o |
|
||
|
|
|
||
Анализ уравнения (8.16) показывает, что критический радиус включений новой фазы уменьшается при увеличении пересыщения раствора взаимодейст- вующими веществами. При отсутствии пересыщения раствора ( K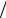 X o = 1) проте-
X o = 1) проте-
кание реакции возможно только на плоской поверхности раздела фаз. Уменьше- нию критического радиуса неметаллических включений в стали способствует также малая величина межфазного натяжения на границе расплав-включение, рост плотности частиц новой фазы или уменьшение их молярного объема ( M/ρ).
Изложенное выше позволяет сделать следующие выводы применительно к реакциям окислительного рафинирования в сталеплавильных ваннах.
1.В гомогенной жидкой стали реакции окисления углерода не получает раз- вития, так как достичь необходимого для выделения газообразных продуктов реак- ции пересыщения системы взаимодействующими веществами практически не воз- можно.
2.Возможными зонами протекания реакции окисления углерода являются:
-граница раздела металл – подина, где имеются не заполненные расплавом поры в огнеупорных материалах, которые могут выполнять роль зародышей новой фазы;
-поверхность всплывающих в металле пузырей CO ;
-граница раздела не покрытого шлаком металла с атмосферой;
-поверхность струй и пузырьков вдуваемого в ванну кислорода или воздуха; 3. Если реакции образования конденсированных оксидов протекают на пло-
ской поверхности раздела металла со шлаком или футеровкой ( r = ∞), то с точки зрения термодинамики пересыщение системы взаимодействующими веществами не требуется.
4. Протекание реакций окислительного рафинирования с выделением из рас- плава конденсированных фаз возможно также на поверхности присутствующих в
расплаве неметаллических включений, если их радиус больше критического.
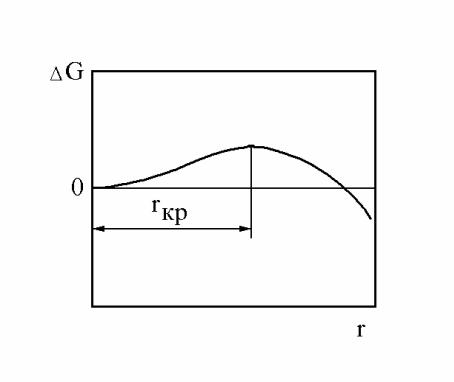
Рисунок 7.1 – Изменение энергии Гиббса системы при выделении из расплава заро- дыша новой фазы радиусом r
