
TOMP / Лекция_9
.pdf9 ОКИСЛЕНИЕ УГЛЕРОДА В СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССАХ. ТЕРМОДИНАМИКА РЕАКЦИЙ
9.1 Значение углерода в сталеплавильных процессах
Роль углерода в сталеплавильных процессах сводится, главным образом,
кследующему:
1.Углерод является обязательным компонентом большинства марок ста- ли. Изменяя соотношение между количеством феррита и перлита в структуре твердого металла, расширяя область температур устойчивого существования
γ− Fe , углерод позволяет получать металл с широким диапазоном механиче-
ских свойств.
В некоторых марках стали специального назначения углерод является вредной примесью (электротехнические, жаропрочные, коррозионностойкие и
т.д.).
2.На окисление углерода расходуется основное количество кислорода, вдуваемого в ванну для окисления примесей. Например, в кислородно- конвертерном и мартеновском скрап-рудном процессах на окисление углерода расходуется свыше 75 – 80% кислорода. Поэтому управление процессом окис- лительного рафинирования сводится, главным образом, к управлению процес- сом обезуглероживания металла.
3.Углерод является единственной примесью сталеплавильной ванны, окисление которой сопровождается образованием газообразных продуктов взаимодействия. При окислении углерода образуются CO и CO2 , объем кото-
рых во много раз превышает объема металла (окисление 1 кг углерода при 1500оС сопровождается образованием более 10 м3 CO ). Удаляясь из ванны в виде пузырей, этот газ обеспечивает интенсивное перемешивание металла и шлака, увеличивая скорости тепло- и массообменных процессов, что позволяет закончить плавку за технологически приемлемое время.
4.Пузыри CO , проходя через жидкий металл, способствуют также уда- лению из него газов и неметаллических включений по ходу плавки и во время вакуумирования.
5.В кислородных процессах большое значение имеет нагрев ванны теп- лом, выделяющимся при протекании реакций окисления углерода. Например, в кислородно-конвертерном процессе тепло реакции окисления углерода состав- ляет 20 – 25% приходной части теплового баланса плавки и обеспечивает на- грев металла до температуры выпуска при значительном количестве лома в шихте.
6.Содержание углерода в металле и непрерывное его окисление является главным фактором, который по ходу плавки определяет содержание кислорода
вметалле и оксидов железа в шлаке. Окисленность ванны определяет потери железа со шлаком в виде оксидов, остаточное содержание остальных примесей ванны, угар раскислителей и легирующих добавок и др.
7.Окисление углерода при затвердевании металла в изложницах позволя- ет получать слитки различной структуры (кипящая, спокойная и полуспокойная сталь).
9.2 Растворимость углерода в железе
На диаграмме состояния системы Fe-C зависимость растворимости угле- рода в железе от температуры описывается линией ликвидус в области заэвтек-
тических сплавов ( C' D' ). При температурах 1153 – 2100оС растворимость угле- рода составляет 4,26 – 7,0%. Зависимость растворимости углерода в железе от температуры можно описать уравнением
lg [C] |
max |
= 1,15 − |
736 |
, |
(9.1) |
|
|||||
|
|
T |
|
||
|
|
|
|
||
где [C]max – растворимость углерода в жидком железе, %.
Согласно уравнению (9.1) при 1600оС растворимость углерода в железе составляет 5,75%.
Исходя из уравнения (9.1) для реакции |
|
|
Cгр = |
[C] , |
(9.2) |
ΔG o = 14100 |
− 22,3T Дж/моль. |
(9.3) |
Из уравнения (9.3) видно, что растворение углерода в железе является слабой эндотермической реакцией.
Определение растворимости углерода в железе приведенным выше мето- дом нельзя признать надежным, т.к. очень трудно зафиксировать в твердой пробе все количество углерода, содержащегося в жидком металле. Более на- дежным способом определения термодинамических параметров реакции (9.2) является комбинирование хорошо изученных реакций газификации графита и растворенного в металле углерода
|
[C] |
+ |
{CO2 } |
= |
2{CO} , |
(9.4) |
|
ΔG o |
= |
139530 |
− |
153T Дж/моль, |
(9.5) |
||
Cгр |
+ |
{CO2 } |
= |
2{CO} , |
(9.6) |
||
ΔG o |
= |
162150 |
− |
170T Дж/моль. |
(9.7) |
||
Если предполагать, что реакция (9.6) протекает в прямом направлении, а реак- ция (9.4) – в обратном, результат последовательного протекания обеих реакций будет описываться уравнением (9.2), для которого
G o |
= |
Go − |
G o |
= 22620 −17T Дж/моль. |
(9.8) |
2 |
|
6 |
4 |
|
|
Теплоты растворения углерода в жидком железе, найденные различными способами, несколько различаются. Но, качественно они хорошо согласуются и свидетельствуют о том, что реакция (9.2) является слабой эндотермической ре- акцией.
Влияние третьих элементов на величину растворимости углерода в желе- зе может быть охарактеризовано при помощи рисунка 9.1. В присутствии кар- бидообразующих элементов ( Mn , Cr , V , Nb ) растворимость углерода в желе- зе увеличивается. При наличии в расплаве примесей, которые образуют хими- ческие соединения с жидким железом ( Si , P , Al , S , Ni ) – уменьшается. По-
этому в чугунах и ферросплавах содержание углерода существенно различает- ся, даже если в процессе их производства происходит насыщение металла угле- родом. Так, содержание углерода составляет: в высокоуглеродистом ферромар- ганце и феррохроме – более 6,5%; в обычном передельном чугуне – 4,2 – 4,5%; в высокофосфористом чугуне ~ 3,6%; в 10% ферросилиции ~ 2%. Зависимость растворимости углерода в железе от температуры и содержания других приме- сей свидетельствует о том, что раствор углерода в железе не является идеаль- ным.
Если в качестве стандартного состояния при описании термодинамиче- ских свойств раствора принять однопроцентный раствор, подчиняющийся за- кону Генри, характер зависимости величины коэффициента активности углеро- да от концентрации его в расплаве будет соответствовать показанному на ри- сунке 9.2. Из рисунка видно, что большие значения коэффициента активности углерода в жидком железе наблюдаются в области высоких его концентраций, близких к насыщению. При низких и средних концентрациях углерода ( [C] < 1%) величина коэффициента его активности близка к единице. Поэтому при анализе реакций окислительного рафинирования применительно к условиям доводки плавки в сталеплавильных агрегатах активность растворенного в ме- талле углерода с достаточной для практических целей точностью можно заме- нить его концентрацией. Такая замена наиболее оправдана, когда углерод в окислительном периоде рафинирования является единственной примесью и его концентрация не превышает 1%.
В качестве возможных форм существования углерода в металле в научно-
технической литературе указывают ион C 4+ , группировки атомов типа FenC
( Fe3C ), графит.
На свойства готовой стали большое влияние оказывает растворимость уг- лерода в твердом железе, которая существенно меняется в зависимости от мо- дификации железа и температуры. Растворимость углерода в γ− Fe при 1130оС
составляет около 2%, в α − Fe при 723оС – 0,03 – 0,04%, в α − Fe при комнатной
температуре – менее 0,01%. Таким образом, практически все количество рас- творенного в жидком металле углерода в процессе затвердевания и охлаждения до комнатных температур выделяется из пересыщенного раствора в виде гра- фита или цементита.
9.3Общая термодинамическая характеристика реакции окисления углерода
Обладая переменной валентностью, углерод при взаимодействии с рас- творенным в металле кислородом может образовать два оксида по реакциям
[C] |
+ |
[O] |
= |
{CO} , |
(9.9) |
[C] |
+ |
2[O] |
= |
{CO2 } . |
(9.10) |
Чтобы выяснить, какая из реакций получает преимущественное развитие в про- цессе обезуглероживания металла, было выполнено большое количество экспе- риментальных исследований состава выделяющегося из металла газа.
В настоящее время наиболее достоверными считаются результаты иссле- дований А.М. Самарина, который изучал состав газа, выделяющегося из метал- ла в условиях близких к равновесным при отсутствии шлака на поверхности
расплава. При этом получены следующие результаты: |
|
|
|||
Концентрация углерода, % |
0,2 |
0,15 |
0,10 |
0,05 |
0,03 |
Содержание СО2 в продук- |
0,5 |
1,0 |
2,5 |
6,0 |
10,0 |
тах реакции, % |
|
|
|
|
|
Приведенные данные свидетельствуют о том, что значительное количество CO2 в продуктах реакции окисления углерода наблюдается только при концен-
трациях углерода менее 0,05%. При более высоком содержании углерода в ме- талле наличием CO2 в продуктах реакций с достаточной для практических це-
лей точностью можно пренебречь и считать, что обезуглероживание металла протекает только по реакции (9.9).
Результаты исследования большинства авторов свидетельствуют о том, что реакция (9.9) является слабой экзотермической реакцией ( − H = 36 – 46 Дж/моль). Так, например, согласно данным В.И. Явойского стандартное значе- ние изменения энергии Гиббса и константа равновесия реакции (9.9) могут быть рассчитаны по уравнениям
G o = |
− 35620 |
|
− 30,8T Дж/моль, |
(9.11) |
|||||
lg KC |
= |
1860 |
|
+ 1,61 . |
(9.12) |
||||
|
T |
|
|
||||||
Константа равновесия реакции (9.9) определяется из выражения |
|||||||||
|
|
|
|
P |
|
|
|
||
KC |
= |
|
|
CO |
. |
(9.13) |
|||
[C][O]fC fO |
|||||||||
|
|
|
|
||||||
Характер зависимости величины коэффициентов активности |
fC и fO от кон- |
||||||||
центрации углерода в металле показан на рисунке 9.3. При [C] < 1% значения
коэффициентов активности fC и fO , а также их произведение близки к еди-
нице. Это позволяет с достаточной точностью записать константу равновесия реакции (9.9) в виде
|
|
P |
|
|
|
|||
KC |
= |
|
CO |
|
, |
|
(9.14) |
|
[C][O] |
|
|||||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
[C][O] |
= |
|
CO |
. |
(9.15) |
|||
|
|
|||||||
|
|
|
|
KC |
|
|
|
|
Так как значение теплового эффекта реакции мало, рассматривая ее про- текание в ограниченной области температур заключительного периода плавки, влиянием температуры на величину константы равновесия можно пренебречь.
Расчеты по уравнению (9.12) показывают, что при 1600оС K |
C |
= 402. Тогда |
|||
|
|
|
|
|
|
[C][O] = 0,0025P |
|
. |
|
|
(9.16) |
CO |
|
|
|
|
|
Приняв для открытых сталеплавильных агрегатов |
P |
|
= 0,1 МПа, получим |
||
|
CO |
|
|
|
|
[C][O] = 0,0025 . |
|
|
|
|
(9.17) |
Последнее уравнение может быть использовано для определения равновесных соотношений между концентрациями углерода и кислорода в жидком железе при содержании углерода от 0,05 до 1,2 – 1,5%.
9.4Минимальное остаточное содержание углерода при плавке в открытых сталеплавильных агрегатах
Характерной особенностью открытых сталеплавильных агрегатов являет- ся то, что давление в рабочем пространстве незначительно отличается от внеш- него давления. Поэтому парциальное давление CO в удаляющихся из ванны пузырях газа с достаточной точностью можно принять равным 0,1 МПа, что по- зволяет использовать в расчетах уравнение (9.17).
Согласно уравнению (9.17) минимальное содержание углерода в металле может быть получено при максимальном содержании кислорода. Теоретически возможное максимальное содержание кислорода в железе под шлаком из чис- того FeO при температурах конца плавки в сталеплавильных агрегатах состав-
ляет 0,2 – 0.25%. Приняв среднее значение [O] max |
= 0,23%, получим |
|
|
теор |
|
[C]min |
= 0,025/ 0,23 = 0.01 %, |
|
т.е. в открытом сталеплавильном агрегате не возможно получить содержание углерода менее 0,01%, даже если шлак состоит только из оксидов железа.
В реальной сталеплавильной ванне в конце плавки содержание оксидов железа в шлаке обычно не превышает 50%. При этом максимальное содержание кислорода в металле составляет 0,10 – 0,12%, а минимальное остаточное со- держание углерода в металле не бывает менее
[C]min |
= 0,025/ 0,12 = 0.02 %. |
Для некоторых марок стали углерод является нежелательной примесью и со- держание его желательно иметь < 0,02%. В этом случае, чтобы избежать значи- тельных потерь железа со шлаком в виде оксидов, обезуглероживание стали в открытых сталеплавильных агрегатах ведут до содержания углерода0,04 –
0,08%. Дальнейшее обезуглероживание проводят совмещая окислительное ра- финирование с вакуумированием или продувкой расплава инертным газом. Эти мероприятия позволяют понизить парциальные давления CO и CO2 в продук-
тах реакций, в результате чего равновесие реакций (9.9) и (9.10) смещается в направлении образования дополнительного количества оксида углерода.
В некоторых случаях, например, при производстве трансформаторной стали, для понижения концентрации углерода отжигу в вакууме подвергают также готовые листы, т.е. твердую сталь.
9.5Равновесные концентрации углерода и кислорода при глубоком обезуглероживании стали
При содержании углерода менее 0,05% в продуктах реакции окисления углерода появляется значительное количество CO2 . При этом парциальное
давление CO в продуктах реакции уменьшается, что способствует протеканию реакции (9.9) в направлении образования дополнительного количества оксида углерода.
В случае одновременного образования CO и CO2 уравнение, описываю-
щее связь между равновесными концентрациями углерода и кислорода в метал- ле, имеет вид
1+ K 2 K |
C |
K |
CO |
[C] [O] 2 + K |
2 K |
C |
[C][O] − K 2 P |
|
= 0 , (9.18) |
||||
|
O |
|
|
|
O |
|
|
O общ |
|
||||
где [C] |
и [O] |
|
– равновесные концентрации углерода и кислорода в |
||||||||||
|
|
|
металле, %; |
|
|
|
|
|
|
|
|||
|
Pобщ |
– суммарное давление в контактирующей с металлом |
|||||||||||
|
|
|
газовой фазе P |
= P |
|
+ P |
+ P |
; |
|
||||
|
|
|
|
|
|
общ |
CO |
CO2 |
O2 |
|
|
||
KO – константа равновесия реакции растворения кислорода в жидком железе 0,5{O2 } = [O] ;
KC – константа равновесия реакции (9.9);
KCO – константа равновесия реакции {CO} + [O] = {CO2 } ;
Решая уравнение (9.18) относительно концентрации кислорода, получим
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
K |
O |
(K |
O |
K |
C |
[C] )2 + 4P |
1+ K |
2 K |
C |
K |
CO |
[C] |
− K |
2 K |
C |
[C] |
||||||
[O] = |
|
|
|
общ |
|
|
O |
|
|
|
|
|
O |
|
(9.19) |
||||||||
|
|
|
|
|
|
2 1+ K |
2 K |
C |
K |
CO |
[C] |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||||
Результаты расчета содержания кислорода в металле по уравнениям (9.17) и (9.19) показаны на рисунке 9.4. Из рисунка видно, что при [C] < 0,03%
влияние CO2 на величину равновесных концентраций углерода и кислорода
существенно.
Учитывая сходный характер зависимостей, при концентрациях углерода менее 0,05% для оценки равновесных концентраций углерода и кислорода в железе с достаточной точностью можно пользоваться более простым соотно- шением
[C][O] = 0,0022 . |
(9.20) |
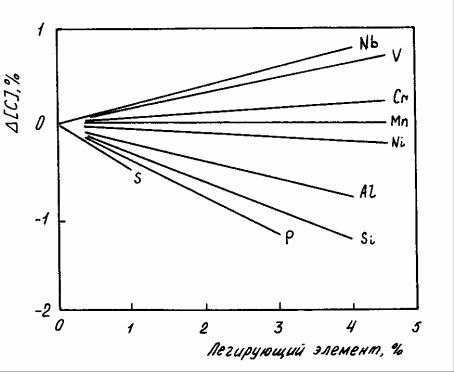
Рисунок 9.1 – Влияние компонентов расплава на растворимость углерода в сплавах железа при 1600оС
