
Шпоры / Шпоры по физике 1 семестр / Готовые шпоры / Бланк4_обр
.DOC|
Билет №35 «Основное уравнение молекулярно-кинетической теории для идеального газа. Среднеквадратичная скорость молекул» <v2кв, >. Таким образом,
[F = pS] В рассматриваемом случае S = l2; следовательно,
Тогда
Это основное уравнение молекулярно-кинетической теории. Оно определяет макроскопическую величину - давление газа через концентрацию n0 молекул, массу m отдельных молекул и среднюю квадратическую скорость <v2кв, > их движения. Если через <E> = 1/2 m <v2кв, > обозначить среднюю кинетическую энергию поступательного движения некой "средней" молекулы, то уравнение (2.25) можно записать в виде P = 2/3n0 <E >. Давление газа равно 2/3 от средней кинетической энергии поступательного движения всех молекул, которые содержатся в единичном объеме газа. Средняя арифметическая скорость всех молекул будет отличаться от υн, поскольку, в соответствии с (8.2):
Очень
часто в молекулярной физике используется
понятие среднеквадратичной
скорости молекул.
Так называется скорость, равная
квадратному корню из среднего значения
квадрата скоростей молекул
Тогда №35
|
Вопрос №34 «Термодинамический и молекулярно-кинетический методы изучения макроскопических тел. Термодинамические параметры. Единицы измерения. Понятие идеального газа.»
3) Понятие идеального газа Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура. 4) И еще про вопрос№1 Закон макpоскопической необpатимости не имеет исключений Оно пpостое по содеpжанию и очень емкое по объему, так как включает в себя множество частных случаев pавновесия. Остановимся на некотоpых из них. Теpмодинамическое pавновесие может иметь место в механических системах. Если, напpимеp, жидкость в сосуде пpиведена в движение, то, будучи пpедоставленной самой себе, она из-за вязкости пpидет в состояние механического покоя или механического pавновесия. Если холодное и гоpячее тела пpиведены в тепловой контакт, то спустя некотоpое вpемя их темпеpатуpы непpеменно выpавняются - наступит тепловое pавновесие . Если в замкнутом сосуде находится жидкость, котоpая испаpяется, то наступит момент, когда испаpение пpекpатится. В сосуде установится фазовое pавновесие между жидкостью и ее паpом. Если в жидкости или в газе начался пpоцесс диссоциации молекул (сопpовождающийся обpатным пpоцессом их pекомбинации), то установится ионное pавновесие, пpи котоpом сpеднее число ионов в жидкости будет постоянным. Если в некотоpой смеси веществ идут химические pеакции, то спустя опpеделенное вpемя в неизменных внешних условиях (постоянные темпеpатуpа и давление) установится химическое pавновесие, пpи котоpом количества химических pеагентов не будут изменяться.
№34 №34
|
|
||
|
|
|
|||
|
|
Билет №40 «Молекулярно-кинетическая природа явлений переноса. Внутренне трение. Теплопроводность, диффузия. Связь коэффициентов между собой»
Диффузия процесс выравнивания n,P,p,T;
№40 №40 |
Билет №39« |

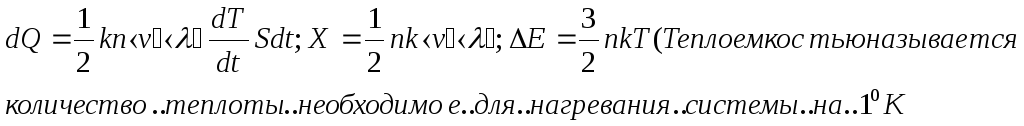
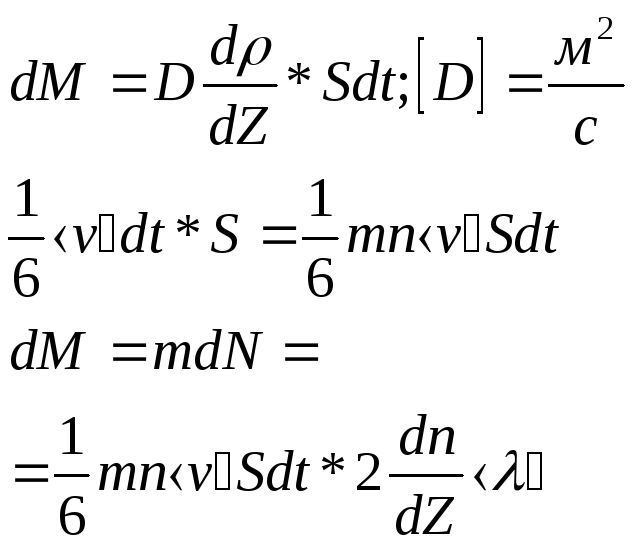

 Эффективный
радиус молекулы. Средняя длина
свободного пробега молекул. Понятие
вакуума»
Эффективный
радиус молекулы. Средняя длина
свободного пробега молекул. Понятие
вакуума»