
Gosudarstvennaya_farmakopeya_RB
.pdfплемента (Таблица 2.6.17.-2). Антикомплементарную активность испытуемого
препарата вычисляют относительно контроля комплемента, принимаемого за 100%, по формуле:
|
|
|
a − b |
×100 , |
|
|
|
a |
|
|
|
|
|
|
где : |
|
|
|
|
а |
- |
средняя активность комплемента, в СН50/мл, в контролях |
||
|
|
комплемента, |
|
|
b- активность комплемента, в СН50/мл, в испытуемом образце.
Результаты испытания считают достоверными, если
-антикомплементарные активности, определенные для АКА- отрицательного и АКА-положительного контролей находятся в пределах, указан- ных в листке-вкладыше, сопровождающем стандартный образец,
-активность комплемента в контроле комплемента (а) находится в преде- лах от 80 до 120 СН50/мл.
2.6.18. ИСПЫТАНИЕ ЖИВЫХ ВИРУСНЫХ ВАКЦИН НА НЕЙРОВИРУЛЕНТНОСТЬ
В каждом испытании используют не менее десяти серонегативных по отно- шению к испытуемому вирусу обезьян. Каждой из обезьян в таламический отдел каждого полушария вводят не менее 0,5 мл испытуемого материала, если иное не
предписано в частной статье. Общее количество привитого каждой обезьяне ви-
руса не должно быть менее количества, содержащегося в рекомендованной еди- ничной человеческой дозе вакцины. Для проверки наличия диких нейровирулент-
ных вирусов контрольную группу, состоящую не менее чем из четырех обезьян,
содержат в тех же клетках, что и группу привитых обезьян, или в непосредствен- ной близости от них. Привитых обезьян наблюдают в течение 17–21 дней, отме- чая возникновение паралича и других неврологических симптомов; обезьян из контрольной группы наблюдают в течение того же периода и дополнительно 10 дней. Животные, погибшие в течение первых 48 часов после инъекции, считаются погибшими по причинам неспецифического характера и могут быть заменены дру-
гими. Результаты испытания признают недостоверными, если: более 20% приви- тых обезьян погибают по неспецифическим причинам; образцы сыворотки, ото- бранные у обезьян контрольной группы, в момент прививки испытуемых животных
и через 10 дней после умерщвления последних, имеют признаки инфекции, вы- званной диким вирусом испытуемого типа или вирусом кори. По окончании перио- да наблюдения выполняют вскрытие и гистопатологическое изучение соответст-
вующих отделов мозга на предмет наличия воздействия на центральную нервную
систему. Материал выдерживает испытание, если не обнаруживается неожидан-
ных клинических и гистопатологических признаков воздействия на центральную
нервную систему, которые могут быть вызваны введенным вирусом.
2.6.19. ИСПЫТАНИЕ ПЕРОРАЛЬНОЙ ВАКЦИНЫ ПОЛИОМИЕЛИТА НА НЕЙРОВИРУЛЕНТНОСТЬ
Обезьяны, используемые в испытании на нейровирулентность, должны со-
ответствовать требованиям, приведенным в частной статье «Вакцина полиомие- лита, пероральная (0215)» и иметь массу тела не менее 1,5 кг. Патогенность для
обезьян семейств Macaca или Cercopithecus испытывается в сравнении с патоген-
ностью стандартного вирусного препарата для испытания на нейровирулентность
путем введения в поясничный отдел центральной нервной системы после седа- ции с использование подходящего агента, например, гидрохлорида кетамина. Для образца сыворотки, отобранного до инъекции, должно быть показано отсутствие нейтрализующих антител в разведении 1:4 при испытании против не более, чем
1000 CCID50 каждого из трех типов полиовируса.
Количество обезьян. Вакцину и подходящий гомотипический вирус срав-
нения испытывают одновременно в одной и той же группе обезьян. Вакцину и препарат сравнения вводят равному количеству животных. Животных с разли-
чающимися типами введенного препарата размещают случайным образом по клеткам, а их принадлежность кодируется таким образом, чтобы тип полученной
ими прививки был скрыт от наблюдателей. Количество привитых обезьян должно быть таково, чтобы при оценке как вакцины, так и препарата сравнения было включено не менее одиннадцати обезьян, положительных по отношению к вирусу типов 1 и 2, и не менее восемнадцати обезьян, положительных по отношению к вирусу типа 3 (положительными считают обезьян, имеющих специфические ней-
ронные повреждения, вызванные полиовирусом в центральной нервной системе). С одним и тем же гомотипическим стандартом могут испытываться несколько пар-
тий вакцины. По возможности, используют обезьян из одной и той же карантинной
группы. В других случаях используют обезьян из двух групп, причем вакцина и препарат сравнения прививаются равному количеству обезьян из каждой группы. Если испытание проводится в течение двух рабочих дней, в каждый из дней вак-
циной и гомотипическим препаратом сравнения прививают равное количество обезьян.
Содержание вируса. Содержание вируса в вакцине и гомотипическом пре-
парате сравнения регулируют таким образом, чтобы они были насколько возмож-
но близки и находились в пределах от 105.5 до 106.5 CCID50 в 0,1 миллилитре.
Наблюдение. Всех обезьян наблюдают в течение 17–22 дней, отмечая
признаки полиомиелита или других вирусных инфекций. Обезьян, выживших в те-
чение первых 24 часов, но погибших до 11-го дня после прививки, подвергают вскрытию для определения того, являлся ли причиной гибели полиомиелит. Жи- вотные, погибшие по причинам, не связанным с полиомиелитом, не учитываются
при оценке результатов. Умирающих и в тяжелой степени парализованных живот- ных умерщвляют и вскрывают. Также вскрывают всех животных, выживших в те-
чение периода наблюдения. Результаты испытания считают недостоверными, ес- ли более, чем у 20% животных в течение периода наблюдения была обнаружена
интеркуррентная инфекция.
Количество срезов, подлежащих испытанию. Гистологическому иссле-
дованию подлежат, как минимум, поясничный и шейный отделы, верхний и ниж- ний продолговатый мозг, средний мозг, зрительный бугор и двигательная область коры головного мозга каждой обезьяны. Отбирают препараты толщиной 15 мкм и окрашивают их галлоцианином. Минимальные количества подлежащих испыта-
нию срезов составляют:
(а) 12 срезов, репрезентативных для поясничного утолщения,
(b)10 срезов, репрезентативных для шейного утолщения,
(c)2 среза продолговатого мозга,
(d)1 срез моста и мозжечка,
(e)1 срез среднего мозга,
(f)1 срез с левой и правой части зрительного бугра,
(g)1 срез с левой и правой части двигательной области коры головного мозга.
Подсчет вирусной активности. Для оценки вирусной активности в полу-
секциях поясничного корда и ствола мозга используют систему подсчета тяжести повреждений, по которой следующим образом дифференцируют клеточную ин- фильтрацию и разрушение нейронов:
1.Наличие лишь клеточной инфильтрации (обезьяна не считается положи-
тельной),
2.Клеточная инфильтрация с минимальным повреждением нейронов,
3.Клеточная инфильтрация со значительным повреждением нейронов,
4.Массовое повреждение нейронов в сочетании или без клеточной инфильт- рации.
Полученные значения записывают на стандартном бланке (пример подхо- дящей формы имеется в разделе «Требования к вакцине полиомиелита (перо- ральной)» в Требованиях к биологическим субстанциям №7 Всемирной организа-
ции здравоохранения). Обезьяна, на срезах тканей которой имеются поврежден-
ные нейроны, но не имеется игольчатых трактов, считается положительной. Обезьяна, на срезах тканей которой имеются игольчатые тракты, но не имеется
поврежденных нейронов, не считается положительной. Срезы, на которых имеют-
ся повреждения травматического происхождения, но не имеется специфических вирусных повреждений, при подсчете не учитываются.
Уровни тяжести повреждений основаны на данных, полученных при изуче- нии полусекций поясничных (L), шейных (C) и мозговых (B) гистологических сре- зов. Для каждой положительной обезьяны рассчитывают уровень повреждений (LS) по формуле
ìé |
Суммарное число Lù |
é |
Суммарное число Сù |
é |
Суммарное число Сùü |
¸3: |
|||
LS = íê |
|
ú |
+ ê |
|
ú |
+ ê |
|
úý |
|
|
|
|
|||||||
îë |
Число полусекций û |
ë |
Число полусекций û |
ë |
Число полусекций ûþ |
|
|||
Для каждой группы положительных обезьян рассчитывают среднее значе-
ние уровня повреждений.
Оценка. Сравнение вирусной активности в вакцине и в препарате сравне- ния основано на активности в поясничном расширении корда и степени распро-
странения активности из этого региона в шейное расширение и головной мозг.
Положительное или отрицательное решение основано на общем уровне для всех животных, подвергнутых испытанию. Необычно высокая активность как в пояснич-
ном отделе, так и в результате распространения из этого региона, обнаруженная у отдельных животных, также должна приниматься во внимание при вынесении окончательного решения. Моновалентный материал выдерживает испытание, ес-
ли имеется требуемое количество положительных животных и если ни в одном из клинических и гистопатологических исследований не выявлено существенных различий в патогенности между вирусом вакцины и препаратом сравнения. Кри- терии положительного решения приведены ниже.
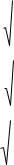
Критерии. Для каждой из вакцин сравнения (типов 1, 2 и 3) проводят под-
ходящее количество (например, четыре) квалификационных испытаний на виру- лентность с целью получения данных об активности этих вакцин как основы кри-
териев для оценки испытуемых вакцин. Для повторных испытаний каждого из стандартных вирусов вычисляют общий средний уровень повреждений (М), а так-
же суммарную оценку дисперсии (s2) и отклонения (s) результатов испытания.
Критерии достоверности результатов испытания препарата сравнения ус- танавливаются на основе данных, накопленных в квалификационных испытаниях. Общепринятых критериев не имеется; для лабораторий с ограниченным опытом
работы может быть полезен следующий эмпирический метод установления до- пустимых пределов среднего уровня повреждений для препарата сравнения (Xref):
|
|
Таблица 2.6.19.-1 |
|
|
|
|
Нижний предел |
Верхний предел |
Типы 1 и 2 |
M - s |
M + s |
Тип 3 |
M – s/2 |
M + s |
Если средний уровень повреждений испытуемой вакцины равен Xtest, а C1,
C2 и C3 – константы, определенные ниже, то:
Вакцина не выдерживает испытание при:
Xtest - Xref > C1
Вакцина может быть однократно подвергнута повторному испытанию при:
C1 < Xtest - Xref < C2
Если вакцина испытывается повторно, средние значения уровней повреж- дений для испытуемой вакциной и препаратом сравнения рассчитываются заново.
Вакцина не выдерживает испытание при:
|
|
|
X (test1+test 2) − X (ref 1+ref 2) |
> C3 |
|||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
Константы C1, C2 и C3 вычисляют по формулам: |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
= 2,3 |
|
|
2s2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
1 |
|
|
|
N1 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2 |
= 2,6 |
|
|
2s2 |
|
|
|
|
|
|
|
|
N1 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
C3 |
= 1,6 |
|
2s2 |
|
, |
|
||
|
|
|
|
N2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
||
где |
: |
|
|
|
|
|
|
|
|
|
|
Nl |
- |
количество положительных обезьян при испытании вакцины, |
|||||||||
N2 |
- |
количество положительных обезьян в двух испытаниях, |
|||||||||
2,3 |
- |
нормальное отклонение для 1% уровня, |
|||||||||
2.6- нормальное отклонение для 0,5% уровня,
1.6нормальное отклонение для 5% уровня.
Испытание на нейровирулентность, в котором получен средний уровень по-
вреждений препарата сравнения (Xref), несовместимый с предшествующим опы- том, не используется для оценки испытуемой вакцины. Если результаты испыта-
ния достоверны, вычисляют средний уровень повреждений для испытуемой вак- цины (Xtest) и сравнивают его с соответствующим значением для гомотипической
стандартной вакцины.
2.6.20. АНТИ-А И АНТИ-В ГЕМАГГЛЮТИНИНЫ (НЕПРЯМОЙ МЕТОД)
Готовят два серийных разведения испытуемого препарата в растворе на-
трия хлорида R концентрацией 9 г/л. К каждому разведению одного ряда добав- ляют равный объем суспензии эритроцитов группы А1 концентрацией 5 объемных процентов, предварительно трижды промытых раствором натрия хлорида. К каж-
дому разведению другого ряда добавляют равный объем суспензии эритроцитов группы В концентрацией 5 объемных процентов, предварительно трижды промы-
тых раствором натрия хлорида. Суспензии инкубируют при температуре 370С в течение 30 минут, затем клетки трижды промывают раствором натрия хлорида. Клетки оставляют в контакте с поливалентным антиреагентом человеческого им-
муноглобулина в течение 30 минут. Каждую из суспензий, не подвергая центрифу- гировангию, исследуют под микроскопом на агглютинацию.
2.6.21. МЕТОДЫ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ
1. ВВЕДЕНИЕ
Методы амплификации нуклеиновых кислот основаны на двух различных подходах:
1.Амплификация последовательности-мишени нуклеиновой кислоты с ис- пользованием, например, полимеразной цепной реакции (ПЦР), лигазной цепной реакции (ЛЦР) или изотермической амплификации рибонуклеиновой кислоты
(РНК).
2.Амплификация сигнала гибридизации с использованием, например, для
дезоксирибонуклеиновой кислоты (ДНК) метода разветвленной ДНК (bDNA). В этом случае амплификация сигнала достигается без подвергания нуклеиновой ки-
слоты повторяющимся циклам амплификации.
Вданном общем разделе в качестве стандартного метода описывается ме-
тод ПЦР. Могут применяться и альтернативные методы, если они выдерживают требования к качеству, перечисленные ниже.
2.ОБЛАСТЬ ПРИМЕНЕНИЯ
Вданном разделе устанавливаются требования к подготовке образца, к ам- плификации in vitro последовательностей ДНК и к детектированию специфическо- го продукта ПЦР. С помощью ПЦР могут быть детектированы определенные по-
следовательности ДНК. Последовательности РНК могут также быть детектирова- ны путем обратной транскрипции РНК на комплементарную ДНК (cDNA) с после- дующей амплификацией.
3.ПРИНЦИП МЕТОДА
ПЦР представляет собой процедуру, позволяющую производить в условиях in vitro амплификацию сегментов ДНК или РНК (после обратной транскрипции на cDNA).
После денатурации двунитевой ДНК в однонитевую два синтетических оли- гонуклеотидных праймера противоположной полярности спариваются с их соот-
ветствующими комплементарными последовательностями в подлежащей ампли- фикации ДНК. Короткие двунитевые участки, формирующиеся в результате спе- цифического спаривания оснований праймеров и комплементарной ДНК- последовательности, образуют границы амплифицируемого сегмента ДНК и слу-
жат начальными точками для синтеза ДНК in vitro с участием термостабильной ДНК-полимеразы.
Процесс амплификация ДНК состоит из циклов, включающих:
-тепловую денатурацию нуклеиновой кислоты (последовательности-мишени) на
две отдельные нити;
-специфический отжиг последовательности-мишени с праймерами в подходящих
реакционных условиях;
-наращивание праймеров, присоединенных к обеим отдельным нитям, под воз-
действием ДНК-полимеразы при подходящей температуре (синтез ДНК).
Повторяющиеся циклы тепловой денатцурации, отжига с праймерами и
синтеза ДНК приводят к экспоненциальной амплификации сегмента ДНК, ограни-
ченного праймерами.
Специфический продукт ПЦР, называемый ампликоном, может быть опре-
делен разнообразными методами соответствующей специфичности и чувстви-
тельности.
4.ИСПЫТУЕМЫЙ МАТЕРИАЛ
Всвязи с высокой чувствительностью ПЦР, образцы должны быть опти- мальным образом защищены от попадания извне последовательностей-мишеней. Отбор проб, хранение и транспортировку испытуемого материала производят в условиях, минимизирующих деградацию последовательности-мишени. В случае
проведения испытания на РНК-последовательности, необходимо принять особые
меры предосторожности ввиду высокой чувствительности РНК к деструктивному воздействию рибонуклеаз. Следует учитывать, что некоторые добавляемые реа-
генты, например, антикоагулянты или консерванты, могут оказывать влияние на
ход определения.
5.МЕТОДИКА ОПРЕДЕЛЕНИЯ
5.1. Предотвращение загрязнения
Всвязи с риском загрязнения следует строго разграничивать рабочие зоны
взависимости от используемых материалов и применяемой технологии. Учиты-
ваемые факторы включают передвижение персонала, использование спецодеж- ды, перемещение материалов, подачу воздуха и процедуры деконтаминации.
Систему следует разделить на такие отсеки, как:
-зона основной смеси (зона, в которой работы осуществляются только с материа- лами, не содержащими шаблонных последовательностей, например, праймерами, буферными растворами и т.д.),
-пре-ПЦР (зона, в которой ведется работа с реагентами, образцами и контроля-
ми),
-ПЦР-амплификация (амплифицируемый материал содержится в закрытой сис-
теме),
-пост-ПЦР детектирование (единственная зона, в которой операции с амплифи-
цируемым материалом производятся в открытой системе).
5.2Подготовка образцов
При подготовке образцов подлежащая амплификации последовательность-
мишень должна быть эффективным и воспроизводимым образом экстрагирована или высвобождена из испытуемого материала так, чтобы амплификация в из- бранных реакционных условиях была осуществима. Могут быть использованы
различные физико-химические процедуры экстракции и/или обогащения.
Добавки, присутствующие в испытуемом материале, могут оказывать влия-
ние на ход ПЦР. Для контроля присутствия ингибиторов в испытуемом материале следует провести процедуры, описанные в пункте 7.3.2.
В случае РНК-матриц следует уделять внимание предотвращению прояв- ления рибонуклеазной активности.
5.3 Амплификация
Амплификация последовательности-мишени методом ПЦР проводится в опти- мизированных циклически изменяющихся условиях (температурный профиль для денатурации двунитевой ДНК, отжига и наращивания праймеров; периоды инку-
бации при выбранных температурах; скорость наращивания). Эти условия зависят
от различных параметров, например:
-длины и состава праймера и последовательности-мишени;
-типа ДНК-полимеразы, буферной смеси и реакционного объема, используемых
при амплификации;
-типа используемого устройства для термоциклирования и скорости передачи тепла между аппаратом, реакционным сосудом и реакционной жидкостью.
5.4 Детектирование
Ампликон, образовавшийся в результате ПЦР, может быть идентифицирован по размеру, последовательности, путем химической модификации или комбина-
цией этих методов. Характеризация по размеру может быть проведена методами
гель-электрофореза (с использованием слоев агарозного или полиакриламидного гелей или капиллярного электрофореза) или колоночной хроматографии (напри-
мер, ВЭЖХ). Характеризация по составу последовательности может быть прове-
дена путем специфической гибридизации зондов, содержащих последователь- ность, комплементарную мишени, или расщеплением амплифицированного мате- риала, отражающим наличие мишень-специфических сайтов ферментативной ре-
стрикции. Характеризация по химической модификации может быть проведена, например, введением в ампликоны флуорофора с дальнейшей детекцией флуо-
ресценции, возникающей в результате возбуждения. 6. ОЦЕНКА И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Результат испытания является достоверным лишь при условии получе-
ния однозначно положительных результатов для положительного контроля (контролей) и однозначно отрицательных результатов для отрицательного контроля (контролей). В связи с исключительно высокой чувствительностью метода ПЦР и с риском попадания загрязняющих примесей, положительные ре- зультаты должны подтверждаться двукратным полным повторением проце-
дуры испытания, по возможности, с новой аликвотой образца. Считают, что
образец дает положительную реакцию, если не менее одного из повторных ис- пытаний дает положительный результат.
7.ОБЕСПЕЧЕНИЕ КАЧЕСТВА
7.1Валидация системы для количественного определения методом
ПЦР.
Программа валидации должна включать валидацию оборудования и ис- пользуемого метода ПЦР. Следует учитывать положения, изложенные в руково- дстве ICH (тема Q2B) «Валидация аналитического метода: методология».
Для валидации ПЦР-испытания обязательным является применение
официальных рабочих стандартных образцов или стандартных препаратов
внутреннего применения, калиброванных относительно Международных Стан- дартов, для последовательностей-мишеней, для определения которых систе-
ма будет использоваться.
При валидации должно быть определено положительное граничное значе-
ние. Положительное граничное значение определяется как минимальное количе- ство последовательностей-мишеней в объеме образца, которые могут быть опре-
делены в 95% испытаний. Положительное граничное значение зависит от таких взаимосвязанных факторов, как объем экстрагированного образца и эффектив-
ность методологии экстракции, транскрипция РНК-мишени в cDNA, процесс ам-
плификации и детекции.
При определении предела детекции системы следует учитывать положи-
тельные граничные значения для каждой последовательности-мишени и резуль-
таты проведения испытания выше и ниже этих значений.
7.2. Контроль качества реагентов.
Все реагенты, имеющие критическое значение для используемой методоло- гии, должны проходить контроль перед использованием в рутинных испытаниях. Их пригодность или непригодность основывается на заранее определенных кри- териях качества.
Праймеры являются важнейшими компонентами ПЦР-анализа, и поэтому
следует уделять особое внимание их строению, чистоте и валидации для ПЦР- анализов. Каждая новая партия праймеров перед введением в испытание должна
быть испытана на специфичность, эффективность амплификации и отсутствие ин-
гибирующих примесей. Праймеры могут быть подвергнуты модификации (напри- мер, связыванием с флуорофором или антигеном) для проведения детекции ам- пликона специфическими методами при условии, что такие модификации не при-
ведут к ингибированию правильного и эффективного протекания процесса ам- плификации последовательности-мишени.
7.3. Контроль хода испытания.
7.3.1. Внешние контроли.
Для минимизации риска загрязнения и обеспечения адекватной чувствитель- ности в состав каждого ПЦР-испытания вводят следующие внешние контроли:
-положительный контроль: в нем содержится определенное количество копий последовательности-мишени; количество копий определяется индивидуально
для каждой системы и кратно положительному граничному значению данной системы;
-отрицательный контроль: образец аналогичного основного состава, для кото-
рого доказано отсутствие последовательностей-мишеней. 7.3.2. Внутренний контроль.
Внутренние контроли представляют собой определенные последовательности нуклеиновых кислот, содержащие сайты связывания с праймерами. Внутренние
контроли должны амплифицироваться так же эффективно, как и испытуемая по- следовательность-мишень, но ампликоны должны иметь четкие отличия. Тип нук- леиновой кислоты (ДНК/РНК), используемой в качестве внутреннего контроля, должен быть тем же, что и в испытуемом материале. Внутренний контроль пред-
почтительно добавлять к испытуемому материалу до выделения нуклеиновой ки- слоты; при этом он может использоваться для общего контроля процесса (экс-
тракция, обратная транскрипция, амплификация, детекция).
7.4. Внешняя оценка качества
Участие во внешних программах оценки качества представляет собой важную процедуру обеспечения качества ПЦР-анализов для каждой лаборатории и каждо-
го оператора.
Следующий раздел приводится для информации.
ВАЛИДАЦИЯ МЕТОДА АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ (МАНК) В ОПРЕДЕЛЕНИИ РНК ВИРУСА ГЕПАТИТА С (HCV) В ПУЛАХ ПЛАЗМЫ: РУКОВО-
ДСТВО
1. ОБЛАСТЬ ПРИМЕНЕНИЯ
Большинство аналитических методик, основанных на амплификации нук-
леиновых кислот, представляют собой качественные испытания на наличие нук-
леиновых кислот. Существует также некоторое количество методик количествен- ного определения (либо внутренних, либо коммерчески доступных). Для опреде- ления загрязнения пулов плазмы РНК HCV адекватными являются качественные тесты, которые могут быть рекомендованы как предельные испытания при кон- троле содержания примесей, в соответствии с указаниями в Техническом руково- дстве по разработке монографий «Pharmeuropa», декабрь 1999, глава III «Вали-
дация аналитических методик». В этом руководстве описаны лишь методы вали-
дации качественных аналитических методик оценки загрязнения пулов плазмы РНК HCV на основе амплификации нуклеиновых кислот. Поэтому двумя наиболее
важными характеристиками для валидации аналитического метода являются его
специфичность и предел детекции. Кроме того, должна быть оценена устойчи-
вость аналитического метода.
Однако этот документ также может быть использован в качестве ос-
новы для валидации амплификации нуклеиновых кислот в общем.
Для целей данного документа, за аналитическую процедуру принимают всю
процедуру от экстракции нуклеиновой кислоты до детекции амплифицированного продукта.
При использовании в аналитическом методе или его части коммерческого набора, валидацию пользователя может заменить документированное подтвер- ждение валидации вышеуказанных положений, произведенной изготовителем на- бора. Тем не менее, пользователем должна быть продемонстрирована произво- дительность набора в отношении его предполагаемого использования (т.е. пре- дел детекции, устойчивость, перекрестная контаминация).
2. СПЕЦИФИЧНОСТЬ
Специфичность представляет собой способность к однозначной оценке
присутствия нуклеиновой кислоты в смеси с компонентами, присутствие которых можно ожидать.
Специфичность аналитических методов, основанных на амплификации нук- леиновых кислот, зависит от выбора праймеров, выбора зонда (для анализа ко-
нечного продукта) и обоснованности условий проведения испытания (как для ста- дии амплификации, так и для стадии детекции).
При разработке праймеров и зондов должна быть исследована их специ- фичность в отношении детектирования только РНК HCV путем сравнения избран-
ной последовательности с последовательностями, опубликованными в банках данных. В случае HCV праймеры (и зонды) обычно выбирают из областей 5’-
некодируемого участка генома HCV, которые хорошо сохраняются для всех гено- типов.
Амплифицированный продукт должен однозначно идентифицироваться од- ним из многих методов, например, проведением амплификации с вложенными
праймерами, анализ с использованием ферментов рестрикции, секвенирование или гибридизация со специфическим зондом.
Для валидации специфичности аналитического метода испытание должно
быть проведено в отношении не менее 100 РНК HCV-отрицательных пулов плаз-
мы, для которых должно быть показано отсутствие реакции. Подходящие образцы
пулов, не дающих реакции, могут быть получены в Европейском директорате по качеству медицинских препаратов.
Способность аналитического метода к детекции всех генотипов HCV также
зависит от выбора праймеров, зондов и параметров метода. Эта способность должна быть продемонстрирована с использованием характеризованных эталон- ных панелей. Однако, ввиду сложности получения некоторых генотипов (напри- мер, генотипа 6), должны быть на подходящем уровне детектированы генотипы преобладающих типов (например, в Европе – генотипы 1 и 3).
3. ПРЕДЕЛ ДЕТЕКЦИИ
За предел детекции данной аналитической процедуры принимают наи-
меньшее количество нуклеиновой кислоты в образце, которое может быть детек- тировано, но не обязательно определено как точное значение. Аналитический ме-
тод с использованием амплификации нуклеиновых кислот, используемый для де-
текции РНК HCV в пулах плазмы, обычно дает качественные результаты. Количе- ство возможных результатов ограничено двумя: либо положительным, либо отри- цательным. Хотя рекомендуется определение предела детекции, в практических
целях для аналитического метода на основе амплификации нуклеиновых кислот должно быть определено положительное граничное значение. Положительное
граничное значение (в соответствии с определением в общем разделе 2.6.21) представляет собой минимальное количество последовательностей-мишеней в
объеме образца, которые могут быть определены в 95% испытаний. На это поло- жительное граничное значение оказывают влияние распределение вирусных ге-
номов в индивидуальных испытуемых образцах и такие факторы, как эффектив- ность фермента. Это может привести к получению различных 95% граничных зна-
чений для отдельных испытаний.
Для определения положительного граничного значения ряд разведений ра- бочего реагента или стандартного образца вируса гепатита С BRP, калиброван-
ного в сравнении с Международным Стандартом HCV ВОЗ 96/790, должен быть
подвергнут испытанию в разные дни для проверки изменчивости результатов
