
- •34. Несжимаемая жидкость. Уравнение непрерывности для несжимаемой жидкости.
- •35.Уравнение Бернулли. Какой из законов сохранения выражает уравнение Бернулли?
- •36. Макроскопическая система. Что называется молем вещества? Молярная масса, число Авогадро, его величина и размерность.
- •37. Тепловое равновесие.
- •38. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
- •39. Связь средней кинетической энергии молекул газа с его температурой.
- •40. Постоянная Больцмана, ее величина, размерность, физический смысл.
- •41. Уравнение Клапейрона - Менделеева. Физический смысл универсальной газовой постоянной.
- •42. Давление и температура с точки зрения молекулярно кинетической теории.
- •43.Среднеквадратичная скорость молекул газа.
- •44.Уравнение изобарного процесса. Его график в координатах pv, pt, vt.
- •45.Уравнение изохорного процесса. Его график в координатах pv, pt, vt.
- •46.Уравнение изотермического процесса. Его график в координатах pv, pt, vt.
- •48.Внутренняя энергия.
- •49. Формула работы для элементарного квазистационарного процесса. Геометрическое изображение работы в координатах pv.
- •50. Адиабатический процесс. Уравнение Пуассона.
- •51.Первое начало термодинамики. Теплоемкость тела, её единицы измерения. Молярная и удельная теплоемкости.
- •52.Первый закон термодинамики для изохорного процесса. Внутренняя энергия идеального газа.
- •53. Первый закон термодинамики для изобарного процесса.
- •54. Формула Майера для теплоемкостей.
- •55.Первый закон термодинамики для изотермического и для адиабатического процессов.
- •56.Второе начало термодинамики.
- •57. Энтропия. Обратимые и необратимые процессы. Изменение энтропии замкнутой системы при необратимом процессе.
- •Обратимый цикл Карно
- •Необратимый цикл Карно
- •58. Циклические процессы.
- •59.Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
- •60. Изменение распределения Максвелла при изменении температуры газа. Вид распределения Максвелла в зависимости от молекулярной массы газа.
- •61. Среднеквадратичная скорость. Наиболее вероятная скорость молекул.
- •62. Распределение Больцмана
- •63. Барометрическая формула
- •64. Закон сохранения электрического заряда. Элементарный электрический заряд.
- •65. Закон Кулона (в системе си).
- •66. Напряженность электрического поля, единицы измерения. Напряженность поля точечного заряда.
- •67. Силовые линии (линии напряженности) электрического поля. Однородное поле
60. Изменение распределения Максвелла при изменении температуры газа. Вид распределения Максвелла в зависимости от молекулярной массы газа.
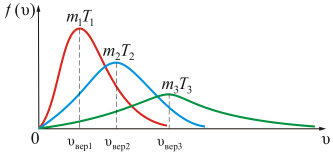
Вид распределения молекул газа по скоростям для каждого газа зависит от рода газа (m) и от параметра состояния (Т). Давление P и объём газа V на распределение молекул не влияют.
На рисунке показана зависимость f(υ) при различных температурах и массах молекул газа.
В
данном случае ![]() (приT =
const ) или
(приT =
const ) или ![]() (приm =
const).Площадь
под кривой величина постоянная,
равная единице (
(приm =
const).Площадь
под кривой величина постоянная,
равная единице (![]() ),
поэтому важно знать как будет изменяться
положение максимума кривой:
),
поэтому важно знать как будет изменяться
положение максимума кривой:
|
|
|
кроме того |
|
|
Максвелловский закон распределения по скоростям и все вытекающие следствия справедливы только для газа в равновесной системе. Закон статистический, и выполняется тем лучше, чем больше число молекул.
61. Среднеквадратичная скорость. Наиболее вероятная скорость молекул.
Величину
скорости, на которую приходится максимум
зависимости ![]() ,называют
наиболее вероятной скоростью.
,называют
наиболее вероятной скоростью.
Найдем
эту скорость из условия равенства
производной ![]() .
.
![]() – наиболее
вероятная скорость одной молекулы.
– наиболее
вероятная скорость одной молекулы.
Для
одного моля газа:
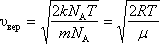
Среднюю
квадратичную скорость найдем,
используя соотношение ![]() :
:
![]() для
одной молекулы
для
одной молекулы
![]() для
одного моля
для
одного моля
62. Распределение Больцмана
Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия.
Пусть идеальный газ находится в поле консервативных сил в условиях теплового равновесия. При этом концентрация газа будет различной в точках с различной потенциальной энергией, что необходимо для соблюдения условий механического равновесия. Так, число молекул в единичном объеме n убывает с удалением от поверхности Земли, и давление, в силу соотношения P = nkT, падает.
Если известно число молекул в единичном объеме, то известно и давление, и наоборот. Давление и плотность пропорциональны друг другу, поскольку температура в нашем случае постоянна. Давление с уменьшением высоты должно возрастать, потому что нижнему слою приходится выдерживать вес всех расположенных сверху атомов.
Исходя
из основного уравнения молекулярно-кинетической
теории: P
= nkT,
заменим P и P0 в
барометрической формуле (2.4.1) на n и n0 и
получим распределение
Больцмана для
молярной массы газа:
![]()
где n0 и n - число молекул в единичном объёме на высоте h = 0 и h.
Так
как ![]() а
а![]() ,
то можно представить в виде
,
то можно представить в виде![]()
С уменьшением
температуры число молекул на высотах,
отличных от нуля, убывает. При T =
0 тепловое движение прекращается, все
молекулы расположились бы на земной
поверхности. При высоких температурах,
наоборот, молекулы оказываются
распределёнными по высоте почти
равномерно, а плотность молекул медленно
убывает с высотой. Так как mgh –
это потенциальная энергия U,
то на разных высотах U
= mgh –
различна. Следовательно, формула
характеризует распределение частиц по
значениям потенциальной энергии:
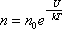
– это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0.
