
- •34. Несжимаемая жидкость. Уравнение непрерывности для несжимаемой жидкости.
- •35.Уравнение Бернулли. Какой из законов сохранения выражает уравнение Бернулли?
- •36. Макроскопическая система. Что называется молем вещества? Молярная масса, число Авогадро, его величина и размерность.
- •37. Тепловое равновесие.
- •38. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
- •39. Связь средней кинетической энергии молекул газа с его температурой.
- •40. Постоянная Больцмана, ее величина, размерность, физический смысл.
- •41. Уравнение Клапейрона - Менделеева. Физический смысл универсальной газовой постоянной.
- •42. Давление и температура с точки зрения молекулярно кинетической теории.
- •43.Среднеквадратичная скорость молекул газа.
- •44.Уравнение изобарного процесса. Его график в координатах pv, pt, vt.
- •45.Уравнение изохорного процесса. Его график в координатах pv, pt, vt.
- •46.Уравнение изотермического процесса. Его график в координатах pv, pt, vt.
- •48.Внутренняя энергия.
- •49. Формула работы для элементарного квазистационарного процесса. Геометрическое изображение работы в координатах pv.
- •50. Адиабатический процесс. Уравнение Пуассона.
- •51.Первое начало термодинамики. Теплоемкость тела, её единицы измерения. Молярная и удельная теплоемкости.
- •52.Первый закон термодинамики для изохорного процесса. Внутренняя энергия идеального газа.
- •53. Первый закон термодинамики для изобарного процесса.
- •54. Формула Майера для теплоемкостей.
- •55.Первый закон термодинамики для изотермического и для адиабатического процессов.
- •56.Второе начало термодинамики.
- •57. Энтропия. Обратимые и необратимые процессы. Изменение энтропии замкнутой системы при необратимом процессе.
- •Обратимый цикл Карно
- •Необратимый цикл Карно
- •58. Циклические процессы.
- •59.Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
- •60. Изменение распределения Максвелла при изменении температуры газа. Вид распределения Максвелла в зависимости от молекулярной массы газа.
- •61. Среднеквадратичная скорость. Наиболее вероятная скорость молекул.
- •62. Распределение Больцмана
- •63. Барометрическая формула
- •64. Закон сохранения электрического заряда. Элементарный электрический заряд.
- •65. Закон Кулона (в системе си).
- •66. Напряженность электрического поля, единицы измерения. Напряженность поля точечного заряда.
- •67. Силовые линии (линии напряженности) электрического поля. Однородное поле
42. Давление и температура с точки зрения молекулярно кинетической теории.
ТЕМПЕРАТУРА
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия.
Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Абсолютный нуль температуры - предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении.
Давление - это явление когда частицы (молекулы) "давят" на сосуд (под действием внутренней энергии и теплового беспорядочного движения ударяются в стенки сосуда). Чем больше кинетическая энергия частицы тем больше сила удара об стенку приходящаяся на единицу площади, тем больше давление.
43.Среднеквадратичная скорость молекул газа.
Среднеквадратичная
скорость молекул равна квадратному
корню из среднего квадрата скорости
молекул:![]() (5)
(5)
Вычислим среднеквадратичную скорость из средней кинетической энергии молекул, которую мы легко можем сосчитать:
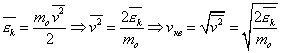
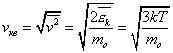
Оказывается у молекул есть средняя скорость (по модулю), которая зависит от температуры, и основная часть молекул имеет модуль скорости близкий к ней. Эту скорость мы не можем вычислить, но можем легко посчитать среднеквадратичную скорость движения молекул газа, которая отличается от средней скорости коэффициентом порядка 1.
44.Уравнение изобарного процесса. Его график в координатах pv, pt, vt.
Изобарный
процесс — термодинамический
процесс,
происходящий в системе при
постоянном давлении и
постоянной массе идеального
газа.Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе ![]() .
.
Работа,
совершаемая газом при расширении или
сжатии газа, равна ![]() .
.
V
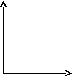
![]() .
.
P P


V T T
45.Уравнение изохорного процесса. Его график в координатах pv, pt, vt.
Изохорический или изохорный
процесс— термодинамический
процесс,
который происходит при постоянном объёме.
Для осуществления изохорного процесса
в газе или жидкости достаточно нагревать
(охлаждать) вещество в сосуде, который
не изменяет своего объёма.
![]()
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля не выполняется.
На графиках изображается линиями, которые называются изохоры. Для идеального газа они являются прямыми во всех диаграммах, которые связывают параметры: T (температура), V (объем) и P (давление).
P P V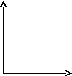
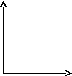
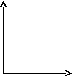


V T T
