
- •34. Несжимаемая жидкость. Уравнение непрерывности для несжимаемой жидкости.
- •35.Уравнение Бернулли. Какой из законов сохранения выражает уравнение Бернулли?
- •36. Макроскопическая система. Что называется молем вещества? Молярная масса, число Авогадро, его величина и размерность.
- •37. Тепловое равновесие.
- •38. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
- •39. Связь средней кинетической энергии молекул газа с его температурой.
- •40. Постоянная Больцмана, ее величина, размерность, физический смысл.
- •41. Уравнение Клапейрона - Менделеева. Физический смысл универсальной газовой постоянной.
- •42. Давление и температура с точки зрения молекулярно кинетической теории.
- •43.Среднеквадратичная скорость молекул газа.
- •44.Уравнение изобарного процесса. Его график в координатах pv, pt, vt.
- •45.Уравнение изохорного процесса. Его график в координатах pv, pt, vt.
- •46.Уравнение изотермического процесса. Его график в координатах pv, pt, vt.
- •48.Внутренняя энергия.
- •49. Формула работы для элементарного квазистационарного процесса. Геометрическое изображение работы в координатах pv.
- •50. Адиабатический процесс. Уравнение Пуассона.
- •51.Первое начало термодинамики. Теплоемкость тела, её единицы измерения. Молярная и удельная теплоемкости.
- •52.Первый закон термодинамики для изохорного процесса. Внутренняя энергия идеального газа.
- •53. Первый закон термодинамики для изобарного процесса.
- •54. Формула Майера для теплоемкостей.
- •55.Первый закон термодинамики для изотермического и для адиабатического процессов.
- •56.Второе начало термодинамики.
- •57. Энтропия. Обратимые и необратимые процессы. Изменение энтропии замкнутой системы при необратимом процессе.
- •Обратимый цикл Карно
- •Необратимый цикл Карно
- •58. Циклические процессы.
- •59.Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
- •60. Изменение распределения Максвелла при изменении температуры газа. Вид распределения Максвелла в зависимости от молекулярной массы газа.
- •61. Среднеквадратичная скорость. Наиболее вероятная скорость молекул.
- •62. Распределение Больцмана
- •63. Барометрическая формула
- •64. Закон сохранения электрического заряда. Элементарный электрический заряд.
- •65. Закон Кулона (в системе си).
- •66. Напряженность электрического поля, единицы измерения. Напряженность поля точечного заряда.
- •67. Силовые линии (линии напряженности) электрического поля. Однородное поле
46.Уравнение изотермического процесса. Его график в координатах pv, pt, vt.
Изотермический
процесс— термодинамический
процесс,
происходящий в физической системе при
постоянной температуре.
В идеальном
газе при
изотермическом процессе произведение
давления на объём постоянно (закон
Бойля-Мариотта).
Изотермы идеального газа в координатах ![]() —
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс.
—
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс.
![]()
P P V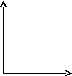
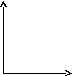
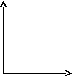



V T T
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для
более точного описания поведения
реальных газов при низких температурах
была создана модель газа Ван-дер-Ваальса,
учитывающая силы межмолекулярного
взаимодействия. В этой модели внутренняя
энергия ![]() становится
функцией не только температуры,
но и объёма.
становится
функцией не только температуры,
но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
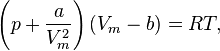
где
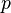 —давление,
—давление,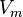 —молярный
объём,
—молярный
объём,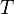 —абсолютная температура,
—абсолютная температура,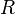 —универсальная
газовая постоянная.
—универсальная
газовая постоянная.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
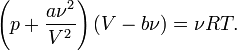
Критическая
точка —
сочетание значений температуры ![]() и
давления
и
давления ![]() (или,
что эквивалентно,молярного
объёма
(или,
что эквивалентно,молярного
объёма ![]() ),
при которых исчезает различие в свойствах
жидкой и газообразной фаз вещества.
),
при которых исчезает различие в свойствах
жидкой и газообразной фаз вещества.
Критическая температура фазового перехода — значение температуры в критической точке. При температуревыше критической температуры газ невозможно сконденсировать ни при каком давлении.
48.Внутренняя энергия.
Наряду с механической энергией, любое тело (или система) обладает внутренней энергией. Внутренняя энергия – энергия покоя. Она складывается из теплового хаотического движения молекул, составляющих тело, потенциальной энергии их взаимного расположения, кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее.
В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома, а тем более ядра). Следовательно, фактически под внутренней энергией в термодинамике подразумевают энергию теплового хаотического движения молекул.
Внутренняя энергия U одного моля идеального газа равна:
|
|
|
|
|
|
|
|
|
|
Таким образом, внутренняя энергия зависит только от температуры.
49. Формула работы для элементарного квазистационарного процесса. Геометрическое изображение работы в координатах pv.
Формулы работы:
A=p∆V
A’=p(V2-V1)
Aвн.=p(V1-V2)
p∆V=µR∆T A=µR∆T
Работа в термодинамике численно! Равна площади фигуры, находящейся под графиком процесса, в координатах PV.
P








A






V
Для кругового процесса: Если процесс идет по часовой стрелке, то работа положительна. Против часовой стрелки-отрицательна.
