
- •34. Несжимаемая жидкость. Уравнение непрерывности для несжимаемой жидкости.
- •35.Уравнение Бернулли. Какой из законов сохранения выражает уравнение Бернулли?
- •36. Макроскопическая система. Что называется молем вещества? Молярная масса, число Авогадро, его величина и размерность.
- •37. Тепловое равновесие.
- •38. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
- •39. Связь средней кинетической энергии молекул газа с его температурой.
- •40. Постоянная Больцмана, ее величина, размерность, физический смысл.
- •41. Уравнение Клапейрона - Менделеева. Физический смысл универсальной газовой постоянной.
- •42. Давление и температура с точки зрения молекулярно кинетической теории.
- •43.Среднеквадратичная скорость молекул газа.
- •44.Уравнение изобарного процесса. Его график в координатах pv, pt, vt.
- •45.Уравнение изохорного процесса. Его график в координатах pv, pt, vt.
- •46.Уравнение изотермического процесса. Его график в координатах pv, pt, vt.
- •48.Внутренняя энергия.
- •49. Формула работы для элементарного квазистационарного процесса. Геометрическое изображение работы в координатах pv.
- •50. Адиабатический процесс. Уравнение Пуассона.
- •51.Первое начало термодинамики. Теплоемкость тела, её единицы измерения. Молярная и удельная теплоемкости.
- •52.Первый закон термодинамики для изохорного процесса. Внутренняя энергия идеального газа.
- •53. Первый закон термодинамики для изобарного процесса.
- •54. Формула Майера для теплоемкостей.
- •55.Первый закон термодинамики для изотермического и для адиабатического процессов.
- •56.Второе начало термодинамики.
- •57. Энтропия. Обратимые и необратимые процессы. Изменение энтропии замкнутой системы при необратимом процессе.
- •Обратимый цикл Карно
- •Необратимый цикл Карно
- •58. Циклические процессы.
- •59.Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
- •60. Изменение распределения Максвелла при изменении температуры газа. Вид распределения Максвелла в зависимости от молекулярной массы газа.
- •61. Среднеквадратичная скорость. Наиболее вероятная скорость молекул.
- •62. Распределение Больцмана
- •63. Барометрическая формула
- •64. Закон сохранения электрического заряда. Элементарный электрический заряд.
- •65. Закон Кулона (в системе си).
- •66. Напряженность электрического поля, единицы измерения. Напряженность поля точечного заряда.
- •67. Силовые линии (линии напряженности) электрического поля. Однородное поле
50. Адиабатический процесс. Уравнение Пуассона.
Адиабатический
процесс - это такое изменение состояний
газа, при котором он не отдает и не
поглощает извне теплоты. Следовательно,
адиабатический процесс характеризуется
отсутствием теплообмена газа с окружающей
средой. Адиабатическими можно считать
быстро протекающие процессы. Так как
передачи теплоты при адиабатическом
процессе не происходит, то ![]() и
уравнение I начала термодинамики
принимает вид:
и
уравнение I начала термодинамики
принимает вид:
![]() или
или
![]()
т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии. Адиабатное расширение газа (dV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (dT<0).
Сжатие газа (dV0, т.е. адиабатное сжатие газа сопровождается его нагреванием.
![]() Это
выражение называют уравнением Пуассона.
Соотношение между давлением и температурой,
а также между объемом и температурой
идеального газа в адиабатическом
процессе имеют вид:
Это
выражение называют уравнением Пуассона.
Соотношение между давлением и температурой,
а также между объемом и температурой
идеального газа в адиабатическом
процессе имеют вид:
![]()
51.Первое начало термодинамики. Теплоемкость тела, её единицы измерения. Молярная и удельная теплоемкости.
При взаимодействии тел происходит переход энергии из одного вида в другой, а также обмен механической и внутренней энергией. При нагревании газа под поршнем энергия теплового движения молекул переходит в механическую энергию движения поршня. При соприкосновении тел передается их внутренняя энергия, энергия теплового движения молекул. При этих превращениях соблюдается закон сохранения и превращения энергии, получивший название первого начала термодинамики:
ΔQ=ΔU+A
количество теплоты ΔQ, переданное системе, идет на изменение ее внутренней энергии ΔU и на совершение системой работы A. Количество теплоты ΔQ считается положительным, если тепло передается из окружающей среды данной системе, механическая работа A считается положительной, если система производит работу над окружающими телами.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельная
теплоемкость вещества – величина,
равная количеству теплоты, необходимому
для нагревания 1 кг вещества на 1 К: ![]() ,
,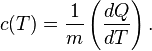
Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К.Размерность: [Дж/(К•моль)]
Связь удельной и молярной теплоемкости: C=cM, где С –молярная теплоемкость, с-удельная, М-молярная масса.
52.Первый закон термодинамики для изохорного процесса. Внутренняя энергия идеального газа.
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
Q = ΔU = U(T2) – U(T1)
|
|
Здесь U(T1) и U(T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Исходя из определения идеального газа, в нем отсутствует потенциальная составляющая внутренней энергии (отсутствуют силы взаимодействия молекул, кроме ударного). Таким образом, внутренняя энергия идеального газа представляет собой только кинетическую энергию движения его молекул. Ранее было показано, что кинетическая энергия поступательного движения молекул газа прямо пропорциональна его абсолютной температуре
![]()
Поскольку распределение энергии движения молекулы по всем степеням свободы равномерное, а число молекул в одном киломоле газа равняется Nμ, внутреннюю энергию одного киломоля идеального газа можно получить:
|
|
|
где Uμ - внутренняя энергия киломоля газа в Дж/кмоль, i - число степеней свободы движения молекулы газа. Для 1-атомного газа i = 3, для 2-атомного газа i = 5, для 3-атомного и многоатомного газов i = 6
