
2013.Термодинамика / Paskal / 2011_09_27 / 2011_09_27 / IMG_0027-70-71
.doc- 70 -
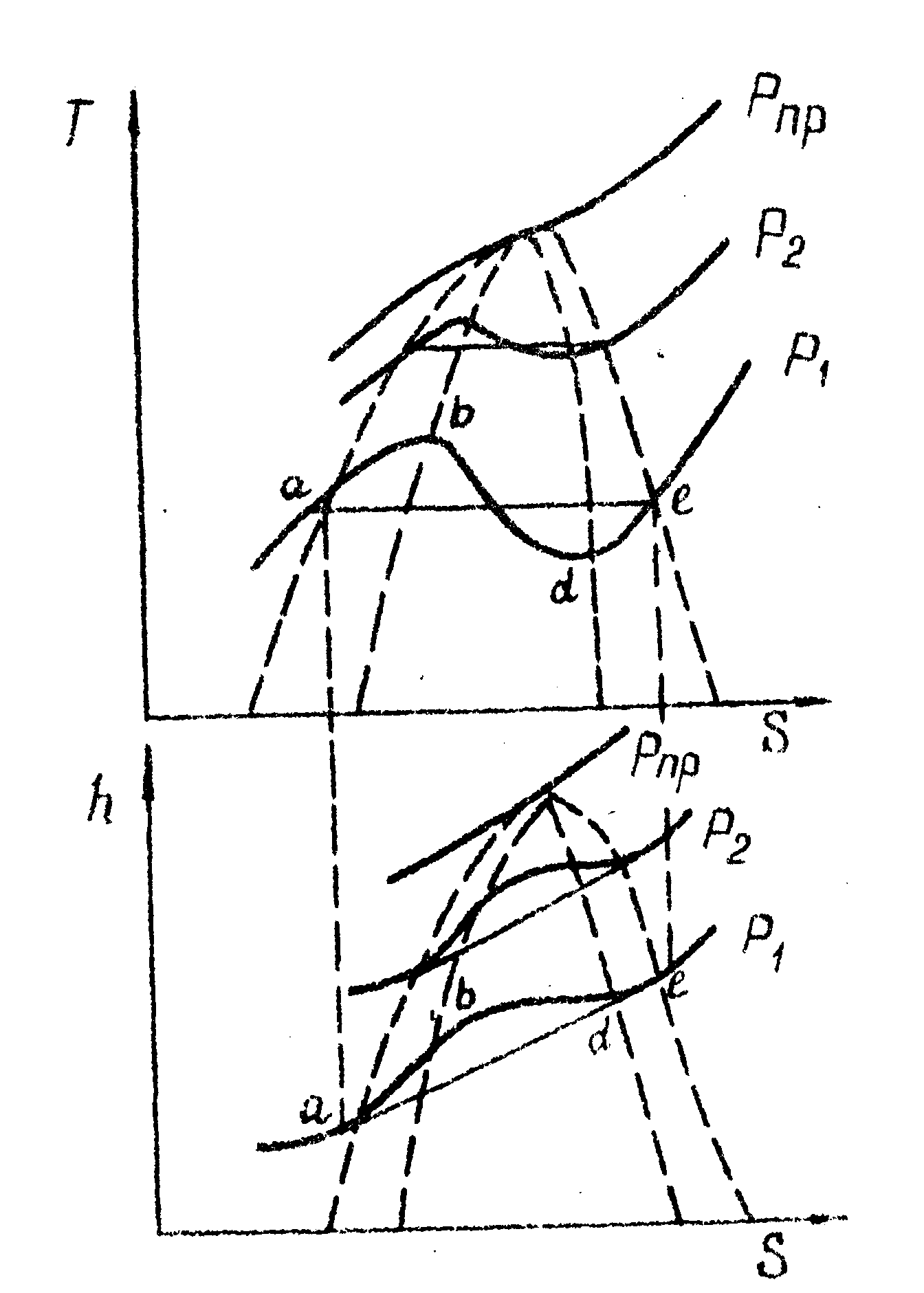
жащая куполообразные бинодаль и спинодаль (рис.1-30). Таким образом;весь анализ, проведенный в §5 на основе изотермы Ван-дер-Ваальса, мог бы быть проведён и на основе изобары.
Рис. 1-29. Семейства изобар
![]() й
;
й
;![]()
 для
системы жидкость-газ
для
системы жидкость-газ
Внутренняя
энергия
системы Ваи-лео-Яаальса.![]() ,подставим
(1.6.5). Тогда
,подставим
(1.6.5). Тогда
![]()
Проинтегрировав это выражение, получим
![]() (1.6.11)
(.легко
показать, что константа интегрирования
равна нулю), где
(1.6.11)
(.легко
показать, что константа интегрирования
равна нулю), где
![]() В выражении (1.6.11)
В выражении (1.6.11)![]() представляет
кинетическую, а -
представляет
кинетическую, а -![]() -
потенциальную энергию.
-
потенциальную энергию.![]()
Достижимость
неустойчивых
одно-фазттых
состояний
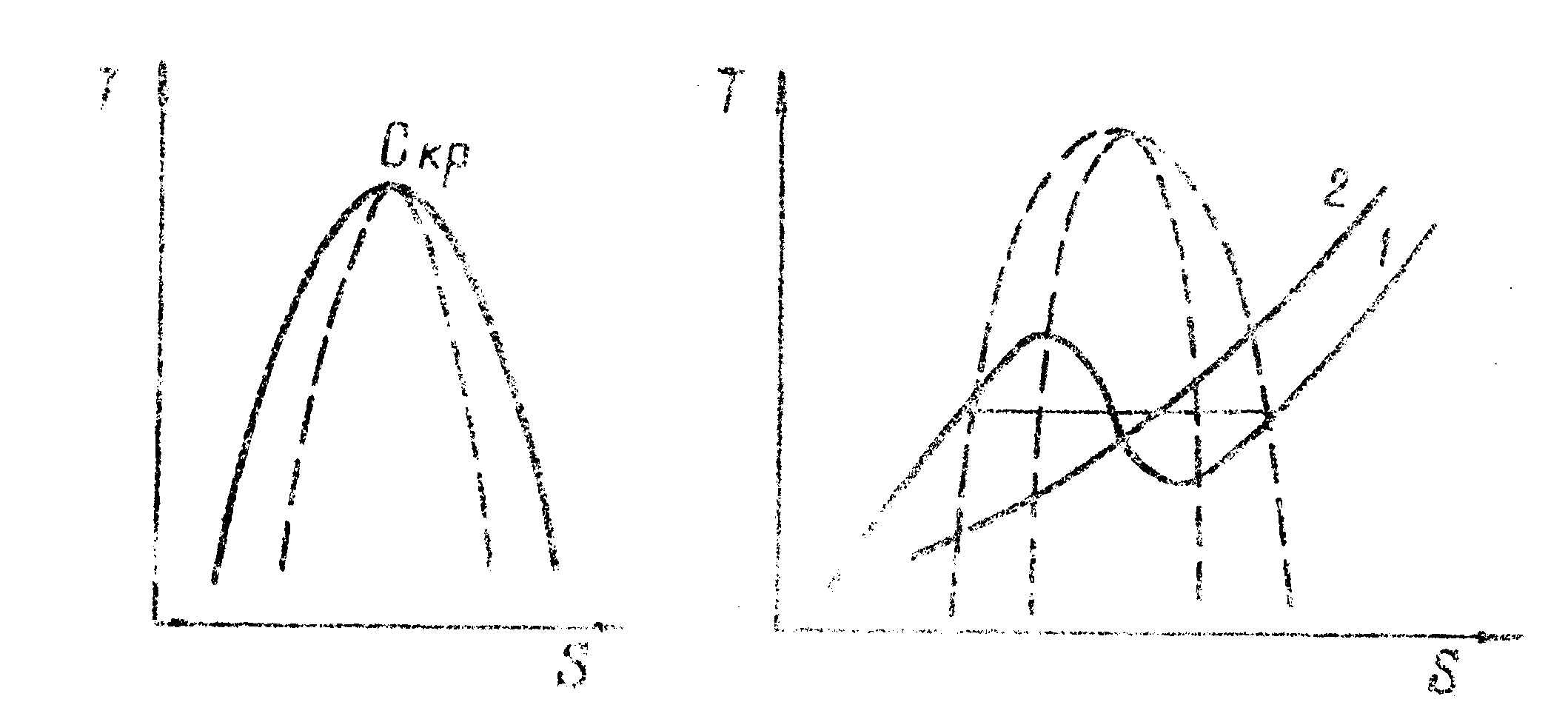
|
Рис. 1-30. Диаграмма состояния Т –S для cистемы жид кость-газ |
Рис, 1–31. Изобарный и изохорный переходы в системе жидкость-газ (1–изобара. 2 – изохора) |
принципе
реализовано, достигнуто? Очевидно, что
лабильное состояние принципиально
недостижимо
ни
изотермическим ни изобарным способом.
Исключение составляют крайние точки![]() и
и
![]() изотермы
и изобары,
соответствующее пределам устойчивости
(метастабильности). Однако
лабильные состояния в принципе могут
быть постигнуты(помимо
точек
изотермы
и изобары,
соответствующее пределам устойчивости
(метастабильности). Однако
лабильные состояния в принципе могут
быть постигнуты(помимо
точек![]() и
и![]() )
изохорным или изэнтропическим путём.
Изохорный
процесс удобно проследить на
изобарическом
графике (рис. 1-31).
)
изохорным или изэнтропическим путём.
Изохорный
процесс удобно проследить на
изобарическом
графике (рис. 1-31).
Поскольку
всегда,
система Ван-дер-Ваальса
изохорно
всегда устойчива.. Снижая или
повышая
изохорным образом температуру,
можно ввести в систему состояние,
соответствующее лабильному
участку изобары или изотермы, изменение
температуры должно
быть произведено
настолько быстро, чтобы при этом не
успело пройти разрушение лабильного
состояния. В случае системы жидкость-газ
невозможно осуществить столь быстрое
охлаждение (но закалка на. лабильное
или, точнее, на близкое к
лабильному
состоянию
возможна в кристаллических системах
с подобным поведением). Заметим, что
постояно положительной наклон изохоры
об-![]()
