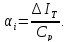- •1. Состояние вопроса. Цели и задачи исследования
- •1.1 Основные типы регулировочных устройств.
- •1.1.1 Капиллярная трубка - как регулирующее устройство.
- •1.1.2 Особенности работы капиллярной трубки.
- •1.2 Особенности работы холодильных машин, использующих в качестве регулирующего устройства капиллярную трубку.
- •1.2.1. Условия работы подобных холодильных машин.
- •1.2.2. Преимущества.
- •1.2.3. Недостатки.
- •1.3 Характеристики капиллярных трубок.
- •1.3.1. Параметры, влияющие на величину расхода хладагента через капиллярную трубку.
- •1.3.2. Зависимость расхода хладагента от диаметра капиллярной трубки.
- •1.3.3. Зависимость расхода хладагента от длины капиллярной трубки.
- •1.3.4. Зависимость расхода хладагента от величины разности давлений на входе и выходе из капиллярной трубки.
- •1.3.5. Зависимость расхода хладагента от состояния хладагента, поступающего в капиллярную трубку.
- •1.4 Существующие методики подбора и расчета капиллярных трубок.
- •1.4.1 Метод пошагового интегрирования.
- •1.4.2 Метод приближенного расчета.
- •1.5 Особенности применения капиллярной трубки для режима теплового насоса.
- •1.6 Цели и задачи исследования.
- •2. Математическая модель процесса дросселирования хладагента r22 в капиллярной трубке
- •2.1 Эффект Джоуля - Томпсона.
- •2 .1. 1 Дросселирование.
- •2.1.2 Общее уравнение дифференциального джоуль-томсоновского эффекта.
- •2.1.3 Физическая сущность джоультомсоновского эффекта.
- •2.1.4 Изоэнтропийное расширение газа.
- •2.2 Дросселирование хладагента r22 в капиллярной трубке.
- •2.2.1. Уравнения, используемые для описания однонаправленного потока в капиллярной трубке круглого сечения [25].
- •2.2.2. Отрезок 0-1. Вход трубки.
- •2.2.3. Отрезок 1-2. Часть трубки, содержащая только жидкость.
- •2.2.4. Отрезок 2-3. Участок, содержащий смесь насыщенной жидкости и пара.
- •2.3 Математическая модель течения хладагента в капиллярной трубке.
- •3. Объект исследований. Экспериментальная установка и методика проведения испытаний.
- •3.1 Объект исследований и экспериментальная установка.
- •3. 2. Методика вычисления холодо и теплопроизводительности.
- •3.3 Практические предпосылки для разработки методики испытаний.
- •3.4. Методика проведения испытаний.
- •3.5 Оценка точности измерений.
- •3.6 Выводы по главе.
- •4. Результаты экспериментальных исследований.
- •4.1 Испытания макетного образца с ручным вентилем в качестве регулирующего устройства.
- •4.2 Основная и дополнительная капиллярные трубки одинакового внутреннего диаметра.
- •4.3. Основная и дополнительная капиллярные трубки разных диаметров.
- •4.4. Возможность использования только одной капиллярной трубки.
- •4.5. Выводы по главе.
2. Математическая модель процесса дросселирования хладагента r22 в капиллярной трубке
2.1 Эффект Джоуля - Томпсона.
2 .1. 1 Дросселирование.
Под
дросселированием понимается падение
давления в струе рабочего тела,
протекающего через суживающий участок
канала. Для осуществления такого процесса
на пути движения газа (пара) устанавливается
какое-либо гидравлическое сопротивление:
дроссельный вентиль, заслонка и т. п.
Падение давления в местном сопротивлении
можно объяснить диссипацией энергии
потока (трением), расходуемым на
преодоление этого сопротивления. Проходя
через местное сужение проходного сечения
канала, давление газа за местом сужения
 всегда меньше давления
всегда меньше давления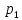 перед сужением. Но работа расширения
газа (пара) при разности давлений
перед сужением. Но работа расширения
газа (пара) при разности давлений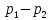 во
вне не передается, т.е. процесс
дроссели¬рования это существенно
необратимый процесс, протекающий в
изолированной системе, в которой к
потоку рабочего тела теплота извне не
подводится.
во
вне не передается, т.е. процесс
дроссели¬рования это существенно
необратимый процесс, протекающий в
изолированной системе, в которой к
потоку рабочего тела теплота извне не
подводится.
В большинстве технических систем для получения низких температур используется дроссельный вентиль, или вентиль Джоуля-Томпсона.
Применяя
первый закон термодинамики для
установившегося потока в дросселе при
отсутствии теплообмена (изолированный
дроссель) и нулевой передаче работы,
для пренебрежимо малых изменений
кинетической и потенциальной энергии
находим, что
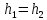 Хотя течение в дросселе необратимо и
процесс не является изоэнтальпийным,
входное и выходное состояние лежат на
одной изоэнтальпе. Для ряда точек
выходных условий можно построить
зависимость от входных условий и получить
линии постоянной энтальпии. Существует
область, в которой дросселирование
(уменьшение давления) приводит к
увеличению температуры, тогда как в
другой дросселирование приводит к
уменьшению температуры. Кривая,
разделяющая эти две области, называется
кривой инверсии.
Хотя течение в дросселе необратимо и
процесс не является изоэнтальпийным,
входное и выходное состояние лежат на
одной изоэнтальпе. Для ряда точек
выходных условий можно построить
зависимость от входных условий и получить
линии постоянной энтальпии. Существует
область, в которой дросселирование
(уменьшение давления) приводит к
увеличению температуры, тогда как в
другой дросселирование приводит к
уменьшению температуры. Кривая,
разделяющая эти две области, называется
кривой инверсии.
Явление
изменения температуры для изоэнтальпийного
изменения давления характеризуется
коэффициентом Джоуля-Томсона
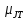 , определяемым каr
, определяемым каr
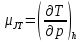 (2.1)
(2.1)
где производную следует рассматривать как изменение температуры при изменении давления и постоянной энтальпии. Коэффициент Джоуля-Томсона есть угол наклона линий постоянной энтальпии. Коэффициент Джоуля-Томсона на кривой инверсии равен нулю, так как эта кривая соединяет точки с нулевым наклоном изоэнтальп. Коэффициент Джоуля-Томсона отрицателен для дросселирования с увеличением температуры; в процессе с уменьшением температуры коэффициент положителен.
В результате преобразований можно показать, что
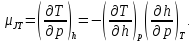 (2.2)
(2.2)
Из основ термодинамики следует, что
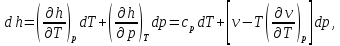 (2.3)
(2.3)
где v - удельный объем вещества. Сравнивая коэффициенты при dT и dp в уравнении (2.3), замечаем, что
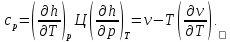 (2.4)
(2.4)
Из уравнений (2.2) и (2.4) коэффициент Джоуля-Томсона может быть выражен через другие термодинамические свойства
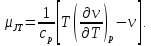 (2.5)
(2.5)
Для
идеального газа,
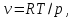
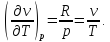
Из уравнения (2.5) для идеального газа следует:

Идеальный газ не будет испытывать изменения температуры при расширении в дросселе. Как было показано, идеальный газ всегда имеет нулевой коэффициент Джоуля-Томсона, поэтому положительный или отрицательный коэффициент должен возникать как следствие отклонения поведения газа от идеального.
Энтальпия определяется как
h = u + pv (2.6)
где u - внутренняя энергия вещества.
Делая эту подстановку в уравнение (2.2), получаем
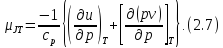
Первый
член уравнения (2.7) характеризует
отклонение от закона Джоуля, согласно
которому внутренняя энергия идеального
газа есть функция только температуры.
Если
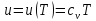 ,
например, тогда этот член равен нулю.
Для реальных газов этот член всегда
отрицателен; таким образом, он вносит
вклад в уменьшение температуры
(положительный
,
например, тогда этот член равен нулю.
Для реальных газов этот член всегда
отрицателен; таким образом, он вносит
вклад в уменьшение температуры
(положительный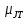 ).
По мере того как молекулы удаляются
друг от друга с уменьшением давления
при расширении, их микроскопическая
потенциальная энергия возрастает.
Подвод внешней работы и теплоты
отсутствует, и поэтому это увеличение
микроскопической потенциальной энергии
должно компенсироваться уменьшением
микроскопической кинетической энергии.
Температура является мерой микроскопической
кинетической энергии, и любое уменьшение
кинетической энергии ведет к уменьшению
температуры.
).
По мере того как молекулы удаляются
друг от друга с уменьшением давления
при расширении, их микроскопическая
потенциальная энергия возрастает.
Подвод внешней работы и теплоты
отсутствует, и поэтому это увеличение
микроскопической потенциальной энергии
должно компенсироваться уменьшением
микроскопической кинетической энергии.
Температура является мерой микроскопической
кинетической энергии, и любое уменьшение
кинетической энергии ведет к уменьшению
температуры.
С другой стороны, второй член в уравнении (2.7) может быть положительным, отрицательным или нулевым. Второй член характеризует отклонение от закона Бойля, который утверждает, что произведение давления и объема для идеального газа есть функция только температуры. Если, например, pv =f(T) = RT, то этот член всегда равен нулю. При низких давлениях и температурах вблизи состояния насыщенного пара газы более сжимаемы, чем это предписывается законом Бойля, так как силы притяжения способствуют конденсации газа. Это означает, что второй член уравнения (2.7) отрицателен и вносит вклад в уменьшение температуры. Этот случай справедлив для газов при комнатной температуре, за исключением водорода, гелия и неона. При высоких давлениях молекулы плотно прижаты друг к другу и работают силы отталкивания, таким образом, газ менее сжимаем в этом диапазоне, чем это предопределяет закон Бойля. Такое поведение приводит к положительному значению второго члена в уравнении (2.7), что влечет повышение температуры в процессе расширения. Положительное, отрицательное или нулевое значение коэффициента Джоуля-Томсона зависит от относительного значения этих двух членов.
Одним из уравнений, описывающих поведение реальных газов, является уравнение состояния Ван-дер-Ваальса
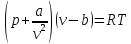 (2.8)
(2.8)
где а - определяет силы межмолекулярного взаимодействия и b - конечный размер молекул.
Для
идеального газа
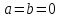 ,
так как в нем отсутствует межмолекулярное
взаимодействие, и молекулы представляют
собой материальные точки, не имеющие
объема. Газ Ван-дер-Ваальса состоит из
молекул, рассматриваемых как слабо
притягиваюпщеся жесткие сферы. Если
вычислить коэффициент Джоуля-Томсона
из уравнений (2.5) и (2.8), получим для газа
Ван-дер-Ваальса
,
так как в нем отсутствует межмолекулярное
взаимодействие, и молекулы представляют
собой материальные точки, не имеющие
объема. Газ Ван-дер-Ваальса состоит из
молекул, рассматриваемых как слабо
притягиваюпщеся жесткие сферы. Если
вычислить коэффициент Джоуля-Томсона
из уравнений (2.5) и (2.8), получим для газа
Ван-дер-Ваальса
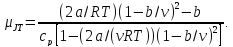 (2.9)
(2.9)
Для больших удельных объемов уравнение (2.9) может быть приведено к приближенному виду
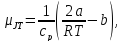
который
показывает, что при некоторых температурах
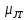 положителен (дляT<2a/(bR)),
а при других - отрицателен (для T>2a/(bR)).
положителен (дляT<2a/(bR)),
а при других - отрицателен (для T>2a/(bR)).
Кривую инверсии составляют точки, на которых коэффициент Джоуля-Томсона равен нулю. Для газа Ван-дер-Ваальса эту кривую описывает уравнение
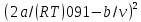 =b,
как это следует го (2.9). Решая уравнение
относительно температуры инверсии
=b,
как это следует го (2.9). Решая уравнение
относительно температуры инверсии
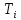 для газа Ван-дер-Ваальса имеем температуру
для газа Ван-дер-Ваальса имеем температуру
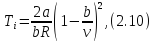
которая может быть связана с давлением через уравнение состояния.
Максимальная
температура инверсии для газа
Ван-дер-Ваальса есть температура на
кривой инверсии при р
= 0
(или b/v
= 0)
или
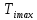 =2a/(bR).
=2a/(bR).
Все газы можно разделить на две группы:
газы, для которых максимальная температура инверсии больше, чем комнатная температура (большинство газов);
газы, для которых максимальная температура ниже комнатной, (неон, водород и гелий).
Это различие в уровне максимальной температуры определяет применение эффекта Джоуля - Томсона для получения низких температур.
Различают
дифференциальный и интегральный
джоультомсоновский эффекты. Дифференциальный
эффект
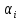 есть отношение бесконечно малого
изменения температуры к бесконечно
малому изменению давления:
есть отношение бесконечно малого
изменения температуры к бесконечно
малому изменению давления:
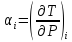
Практическим дифференциальным эффектом считают изменение темпера-туры при падении давления на 1 атм. Эффект, наблюдающийся при больших изменениях давления, называется интегральным.
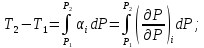

где
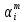 - среднее значение изменения температуры
при уменьшении давления на 1 атм в
интервале
- среднее значение изменения температуры
при уменьшении давления на 1 атм в
интервале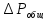 .
Для расчета процессов охлаждения
исключительно важное значение имеет
выражение джоультомсоновского эффекта
в калориях, или так называемый
изотермический эффект дросселирования
.
Для расчета процессов охлаждения
исключительно важное значение имеет
выражение джоультомсоновского эффекта
в калориях, или так называемый
изотермический эффект дросселирования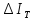 ,
представляющий собой разность
теплосодержаний сжатого (состояние до
дросселирования) и распшренного газа
при одной и той же температуре начала
дросселирования.
,
представляющий собой разность
теплосодержаний сжатого (состояние до
дросселирования) и распшренного газа
при одной и той же температуре начала
дросселирования.
Ясно,
что