Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
Методы синтеза и химическое поведение 4,5-дизамещенных 2,3-дигидрофуран-2,3-дионов
Масливец А.Н., Лисовенко Н.Ю.
Пермский государственный университет 614600, Пермь, ул. Букирева, 15
Разработка методов синтеза замещенных 2,3-дигидрофуран-2,3-дионов (ФД) и исследование их химических превращений начались в 1967 г. после публикации работы Циглера Э. [1], в которой описывался синтез 4-бензоил-5-фенил-ФД 1 взаимодействием дибензоилметана с оксалилхлоридом. С этого момента началось интенсивное развитие химии замещенных ФД [2], продолжающееся и по настоящее время. Как показали исследования, химические превращения фурандионов существенным образом зависят от наличия и характера заместителей в гетероцикле. В настоящем обзоре рассматриваются методы синтеза и химические превращения ФД, содержащих как в положении 4, так и в положении 5 цикла два отличных от атома водорода заместителя.
1. Методы синтеза 4,5-дизамещенных 2,3-дигидрофуран-2,3-дионов
1.1 Циклизация производных 2,4-диоксобутановых кислот
Существующие методы синтеза замещенных ФД неравноценны. Некоторые из них являются препаративными, другие же представляют скорее теоретический интерес и на практике не используются.
Эфиры 3-метилароилпировиноградных кислот 1, полученные конденсацией арилэтилкетонов с диэтилоксалатом [3] или метилированием эфиров ароилпировиноградных кислот [4], при нагревании циклизуются в 5-арил-4-метил-ФД 2 [3, 4] (схема 1).
|
|
|
|
|
|
|
|
Схема 1 |
O |
OEt |
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
EtO |
OEt |
|
|
O |
O |
O |
|
|
O |
|
|
||||
|
|
MeONa |
|
OAlk |
|
|
||
|
|
|
|
|
O |
|||
R |
|
|
|
|
O |
|
|
|
|
O |
|
|
∆ |
|
|
||
|
|
|
|
|
|
|||
O |
|
OAlk |
|
|
|
−AlkOH |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
MeI |
R |
|
|
|
R |
|
|
K2CO3 |
|
|
|
|
||
|
|
1 |
|
|
|
2 |
||
R |
|
|
R = H, Me, MeO, Cl |
|
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
361 |
||||||


1.3 Взаимодействие β-дикетонов и производных β-оксокарбоновых кислот с оксалилхлоридом
К числу таких методов относится и первый синтез 4,5-дизамещенных ФД, описанный Циглером Э. При взаимодействии дибензоилметана и небольшого избытка оксалилхлорида образуется ФД 7 [1] (схема 5).
Схема 5
|
|
|
|
O |
Ph |
O O |
|
O |
O |
O |
Ph |
|
|
+ |
|
||
Ph |
Ph |
|
|
O |
|
Cl |
Cl |
|
|||
|
|
O |
|||
|
|
|
|
7 |
|
|
|
|
|
|
Взаимодействие дипивалоилметана с ОХ приводит к смеси дигидрофуран- 2-онов, которые при нагревании превращаются в 5-(трет-бутил)-4-пивалоил-ФД 8
[11] (схема 6).
|
|
|
|
|
Схема 6 |
|
|
|
O |
|
|
|
|
|
|
Cl |
OH |
|
|
|
|
|
|
|
|
||
O |
|
O |
|
|
|
|
|
O |
|
|
|
||
|
|
|
|
|
||
O |
|
O |
|
|
|
|
O |
Cl |
Cl |
Cl |
|
O |
|
|
|
|
O |
∆ |
|
|
O |
Cl |
O |
O |
O |
||
|
||||||
|
|
O |
O |
|
O |
|
OH |
|
|
|
|
||
|
|
|
|
O |
||
|
|
O |
|
|
8 |
|
|
|
|
|
|
||
O |
|
Cl |
O |
|
|
|
|
|
|
|
|
||
|
|
O |
O |
|
|
|
|
|
O |
|
|
||
|
|
|
2 |
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
363 |
|||||


Схема 9
|
|
|
|
Hal |
Ar |
O |
Hal2 |
Ar |
O |
O |
|
−HHal |
|
O |
|
|
|
||
14 |
O |
|
|
15 O |
1.5 Перегруппировки, приводящие к 2,3-дигидрофуран-2,3-дионам
При каталитическом карбонилировании 2-бром-1-фенил-1,3-бутадиена образуется 4-бензилиден-5-метилтетрагидрофуран-2,3-дион 16, изомеризующийся в 4-бензил- 5-метил-ФД 17 [15] (схема 10).
Схема 10
|
|
|
Ph |
Ph |
Br |
CO |
|
O SiO2 |
O |
Ph |
Ni(CN)2 |
O |
|
O |
|
|
16 |
O |
17 O |
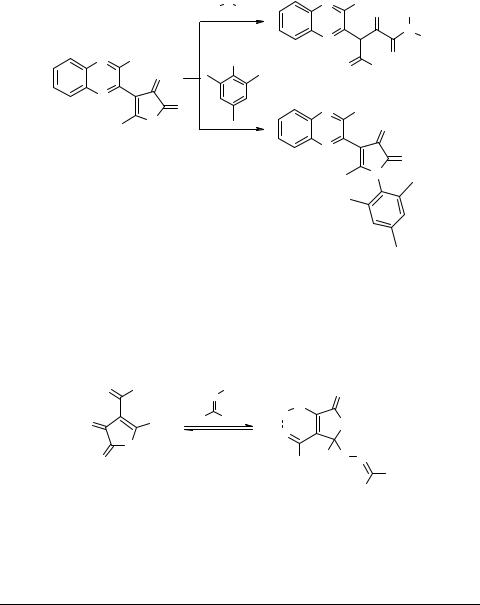
Взаимодействием 4-бензоил-5-фенил-ФД 1 с изоцианатами, сульфиниламинами и кетениминами получены 4-[α-(арилимино)бензил]-5-фенил-ФД [13, 16–18]. Реакция скарбодиимидомпротекает либоаналогичнопредыдущимкак[4+2]циклоприсоединение, либо как [2+2]циклоприсоединение по бензоильной группе [17]. Подробно эти реакции рассмотрены в разделе 3.3.
1.6 Взаимодействие енаминокетонов с оксалилхлоридом
Реакцией фенацилиденхиноксалинов 18 с ОХ получены 5-арил-4-(3-арил-2-хино- ксалинил)-ФД 19; в мягких условиях выделен промежуточный хлорангидрид 20
[10] (схема 11).
|
|
|
|
|
|
Схема 11 |
|
|
|
61°C |
|
N |
Ar |
|
|
|
|
|
O |
|
|
|
|
100 мин |
|
N |
|
N |
Ar |
O |
O |
|
O |
|
19 |
|
|||||
|
|
Ar |
O |
|||
|
|
+ |
|
|||
|
|
|
|
|
||
N |
|
Cl |
Cl |
|
N |
Ph |
|
|
|
20°C |
|
||
H O |
|
Ar |
|
|
O |
|
|
5 мин |
|
N |
|||
18 |
|
|
Ar = Ph |
|
Ph |
|
|
|
|
|
|
O |
Cl |
|
|
|
|
|
|
|
|
|
|
|
20 |
O |
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
365 |
|||||


113.6 (c) |
O |
177.0 (c) |
|
O |
|||
Ph |
|
153.6 (c)
N O
Ph 173.9 (t)
Рис. 2. Химические сдвиги в спектре ЯМР 13С 4-[α-(п-толилимино)бензил]-5-фенил-ФД
3. Химические свойства 4,5-дизамещенных 2,3-дигидрофуран-2,3-дионов
4,5-Дизамещенные ФД, являясь полифункциональными реагентами, представляют значительный интерес для органической химии. Для них характерны реакции дециклизации под действием мононуклеофилов, протекающие в мягких условиях (20°С). При температуре выше 80°С 4,5-дизамещенные ФД элиминируют СО, превращаясь в реакционноспособные ацилкетены [2].
Характер превращения ФД в значительной степени определяется природой реагента. В присутствии сильных нуклеофилов генерирование ацилкетенов становится невозможным, а использование слабых нуклеофилов или реагентов, лишенных нуклеофильных свойств, позволяет вводить их в реакцию с ацилкетенами, генерируемыми при термолизе 4,5-дизамещенных ФД.
3.1 Реакции с мононуклеофилами
Нуклеофильные реакции начинаются с атаки атомов С(2) или С(5) фурандионового цикла, которая в первом случае сопровождается раскрытием кольца и образованием продуктов, существующих в виде линейных либо кольчатых изомеров, а во втором − происходит присоединение по еноновой системе ФД.
3.1.1 Реакции с водой и спиртами
5-(трет-Бутил)-4-пивалоил-ФД 8 реагирует с водой, превращаясь в 5,5-диметил- 3-пивалоил-2,4-диоксогексановую кислоту 23 [11], котораяциклизуетсяобратно под действием P2O5. Глубокий гидролиз приводит к дипивалоилметану 24 (схема 13).
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 13 |
O |
Bu- t |
|
|
|
O O |
OH |
O |
|
|
||||
|
|
|
|
|
|
|
|
||||||
t-Bu |
O |
|
H2O |
|
H2O |
|
|
|
|
|
|||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
t-Bu |
O |
t-Bu |
|
|
|||
O |
|
|
|
P2O5 |
O |
∆ |
|
O |
|||||
|
|
|
|||||||||||
|
|
O |
|
|
|
t-Bu |
t-Bu |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
23 |
|
24 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
367 |
||||||||||||


|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 17 |
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
R = Ar" |
Ar' |
|
|
|
|
|
|
|
|
N Ar" |
||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Ar |
O |
|||||||||||
|
|
|
|
|
|
|
|
|
29 |
|
|
|
|||||
Ar' |
|
O + RNH2 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
O |
|
|
O |
|
|
|
|
|
|
R |
|
OH |
|||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
28 |
|
|
R = Alk, Het |
O |
|
|
N |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
Ar' |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
Ar |
||
|
|
|
|
|
|
|
|
30 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
4-Бензоил-5-фенил-ФД 7 реагирует с анилином или п-толуидином с образованием продукта 31 состава 1 : 2, а с п-нитроанилином – продукта присоединения по C(5) 32 [24, 25] (схема 18).
|
|
|
|
|
|
|
|
Схема 18 |
|
|
|
|
|
|
NO2 |
|
Ph |
|
|
|
|
|
|
|
O |
|
O |
Ph |
|
O |
Ph |
|
OH |
||
|
|
H |
||||||
|
|
H |
2 ArNH2 |
|
|
|
|
|
HO |
|
O |
Ph |
NH |
N |
|
||
|
N |
Ar |
2 |
Ph O O |
||||
|
|
|
|
|
||||
|
N |
Ph |
|
O |
|
|||
O |
|
Ar |
|
O |
|
O2N |
|
|
|
31 |
|
|
|
7 |
32 |
|
|
|
|
|
|
|
|
|||
Анилин и диметиламин легко раскрывают цикл бензоциклогепта[1,2-b]фуран- 2,3-диона 3, давая амиды 1-оксобензоциклогептан-2-глиоксиловой кислоты 33 [5] (схема 19).
Схема 19
H
R N R'
|
|
|
|
O |
|
O |
O |
O |
O |
N |
R' |
|
|||||
|
O |
|
R |
|
|
|
|
|
|
||
3 |
|
33 |
|
|
|
R = H, Me; R' = Me, Ph |
|
|
|
||
|
|
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
369 |
||||