
- •Анализ органических лекарственных веществ по функциональным группам
- •Введение
- •Основная литература
- •Дополнительная литература
- •Теоретические сведения
- •3. Прочие фг, которые нельзя обобщить по одному признаку:
- •Анализ органических лекарственных веществ по фг Спиртовый гидроксил
- •Енольный гидроксил
- •Фенольный гидроксил
- •Карбонильная группа (альдегидная и кетонная)
- •Α-Кетольная группа
- •Пирокатехиновое кольцо
- •Гидразидная группа
- •1. Реакции окисления
- •Карбоксильная группа
- •Α-Аминокарбоксильная группа
- •1. Метод формольного титрования (метод Серенсена).
- •Сложноэфирная (лактонная) и амидная (лактамная) группы
- •1. Метод щелочного гидролиза, вариант обратного титрования
- •2. Метод Кьельдаля после щелочного гидролиза (для амидов)
- •Α– Гидроксикарбоксильная группа
- •Первичная ароматическая аминогруппа
- •Вторичная ароматическая аминогруппа
- •2. Обратная иодометрия
- •3. Метод Кьельдаля
- •R – sh Меркаптогруппа (сульфгидридная группа) Качественный анализ Реакция комплексообразования
- •Количественный анализ Метод Фольгарда
- •Пиразол (1,2-диазол)
- •Вопросы для самоподготовки
- •Вопросы для подготовки к коллоквиуму
- •Оглавление
Енольный гидроксил
Качественный анализ
Комплексообразование
Енольный гидроксил проявляет большую кислотность, чем спиртовый, за счет преобладания положительного мезомерного эффекта над отрицательным индуктивным, поэтому может вступать в реакцию комплексообразования с гидроксидами металлов.
Этерификация
Енольные соединения вступают в эту реакцию аналогично спиртам (с. 8, п. 1). Сложный эфир идентифицируют по температуре плавления.
Окисление
Аналогично спиртам (с. 9, п. 2).
Количественный анализ
Прямая алкалиметрия в неводных средах (пиридин, ацетон). Применяется согласно ГФ X для количественного определения дикумарина и нео-дикумарина.



Фенольный гидроксил
Качественный анализ
Фенолы проявляют значительно большую кислотность, чем спирты. Это связано с наличием положительного мезомерного эффекта, который делает связь 0-Н еще более полярной и, как следствие этого, облегчает отщепление водорода фенольного гидроксила в виде протона.

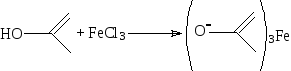
Реакция комплексообразования с хлоридом железа (III)
С хлоридом железа (III) фенолы образуют окрашенные комплексные соединения, различающиеся по окраске в зависимости от количества и места положения гидроксильных групп.
Одноатомные фенолы образуют феноляты железа синего или фиолетового цвета (фенол), трехатомные – красного, двухатомные дают различную окраску в зависимости от положения ОН-групп:
орто-положение – зеленый цвет (адреналин);
мета-положение – синий или фиолетовый цвет (резорцин);
пара-положение – зеленый цвет, переходящий в желтый.
Наличие карбонильной группы и некоторых других групп в орто-положении к фенольному гидроксилу обусловливает фиолетовую окраску комплекса, в пара-положении – желтую или красную. Мета-замещенные фенолы не образуют окрашенных комплексов (тимол).
Цвет комплекса салицилат-иона (карбоксильная группа в орто-положении к фенольному гидроксилу) зависит от рН среды:
рН 2,3-3,0 – фиолетовый;
рН 3,0-8,0 – красный;
рН 8,0-10,0 – желтый.

Комплексы фенолов с хлоридом железа (III) представляют собой хелатные соединения, в которых железо связано с фенольными гидроксилами тремя ковалентными и тремя донорно-акцепторными связями:

Методика. К 1 мл водного раствора (1:100) резорцина, хинозола, пиридоксина гидрохлорида, натрия салицилата, натрия пара-аминосалицилата, спиртового раствора парацетамола, оксафенамида прибавляют 2 капли раствора хлорида железа (III) – появляется характерное окрашивание.
Результаты заносят в таблицу:
|
Препарат |
Растворитель |
Окраска |
|
|
|
|
|
|
|
|
Реакция этерификации (ацилирования)
Реакция основана на свойствах фенолов образовывать сложные эфиры (ацильные производные) с ангидридами кислот, выпадающими в осадок и имеющими определенную температуру плавления.

Методика. К 0,25 г препарата добавляют 1 мл уксусного ангидрида и 2 мл безводного пиридина. Кипятят с обратным холодильником 15 минут, охлаждают, промывают водой, сушат при 100-105 °С и определяют температуру плавления.
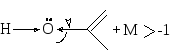
Реакции электрофильного замещения (SЕ)
Препараты, содержащие фенольный гидроксил, легко вступают в реакции электрофильного замещения (SЕ), при этом заместитель направляется в орто- и пара-положения бензольного ядра. Такая ориентация обусловлена преобладающим положительным мезомерным эффектом (+М) над отрицательным индуктивным (-1), создаваемыми фенольным гидроксилом.

3.1. Галогенирование
Фенолы взаимодействуют с бромной водой с образованием белого осадка 2,4,6-трибромфенола:
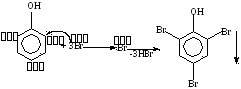
Дибромфенолы образуются, если свободны только два атома углерода в бензольном кольце:

Избытком бромной воды 2,4,6-трибромфенол бромируется, превращаясь в 2,4,4,6-тетрабромциклогексан-2,5-диенон, выпадающий в виде осадка желтого цвета.

Методика. К водному или спиртовому раствору препарата (1:100 – 1:200) прибавляют несколько капель бромной воды и разведенной серной кислоты: образуются осадки бромпроизводных (препараты – натрия салицилат, натрия пара-аминосалицилат, фенол, резорцин, тимол, синэстрол, хинозол, салициламид).
3.2. Нитрование
Фенолы нитруются разбавленной азотной кислотой при комнатной температуре с образованием орто- и пара-нитрофенолов желтого цвета. Добавление раствора гидроксида натрия усиливает окраску вследствие образования хорошо диссоциирующей соли.

М е т о д и к а. К 0,01 г препарата (см. методику 3.1), растворенного в 2 мл спирта, добавляют 1-2 мл разведенной азотной кислоты и нагревают на водяной бане. Постепенно появляется желтое окрашивание.
3.3. Нитрозирование (реакция Либермана)
На фенол действуют нитритом натрия в присутствии минеральной кислоты. Образующийся при этом n-нитрозофенол (I) изомеризуется в n-хиноноксим (II). Последний взаимодействует с фенолом, находящимся в реакционной смеси, с образованием индофенола (III).
![]()

Методика. 0,01 г препарата (см. методику 3.1) помещают на предметное стекло, смачивают 2-3 каплями 1 % раствора нитрита натрия в концентрированной серной кислоте. Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи.
Полученный цвет сравните с окраской индофенолов, приведенной в таблице.
Окраска индофенолов
|
Препарат |
До добавления щелочи |
После добавления щелочи |
|
Фенол |
темно-зеленая |
вишнево-красная |
|
Синэстрол |
красно-фиолетовая |
вишневая |
|
Тимол |
сине-зеленая |
фиолетовая |
|
Резорцин |
фиолетово-черная |
фиолетовая |
3.4. Реакция образования азокрасителя
Фенолы с солями диазония в щелочной среде образуют азокрасители оранжево-красного или вишнево-красного цвета (чаще всего выпадающие в осадок).

Диазореактив получают диазотированием сульфаниловой кислоты нитритом натрия в присутствии хлористоводородной кислоты.

Методика. К 0,05 г лекарственного вещества (см. методику 3.1), растворенного в 5 мл воды или спирта (синэстрол), добавляют 2 мл раствора аммиака и 1 мл диазореактива (приготовление: 0,1 г сульфаниловой кислоты или стрептоцида растворяют при нагревании в 8 мл разведенной хлористоводородной кислоты и после охлаждения добавляют 2 мл 0,1 М раствора нитрита натрия). Появляется красное или оранжево-красное окрашивание.
3.5. Реакция с 2,6-дихлорхинонхлоримидом
Фенолы образуют с 2;6-дихлорхинонхлоримидом индофеноловые красители.

Методика. 0,01 г препарата (пиридоксина гидрохлорид, резорцин, хинозол, кислота салициловая) растворяют в 10 мл воды. К 0,1 мл полученного раствора прибавляют 1 мл воды, 2 мл аммиачного буферного раствора, 1 мл раствора 2,6-дихлорхинонхлоримида, 2 мл бутилового спирта и встряхивают в течение 1 мин. Бутанол окрашивается:
– в голубой цвет (пиридоксин);
– в синий цвет (кислота салициловая, хинозол);
– в светло-вишневый цвет (резорцин).
Реакции окисления
Фенолы легко окисляются до хинонов:
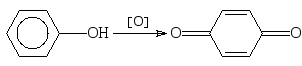
4.1. Образование индофенолового красителя
Под действием окислителей (хлорная известь, хлорамин, бромная вода) фенол окисляется до хинона (I), который взаимодействует с аммиаком с образованием хинонимина (II). Последний взаимодействует с фенолом, находящимся в реакционной смеси, с образованием индофенолового красителя.

Фенол образует индофеноловый краситель сине-зеленого цвета, тимол – слабо-розового цвета, резорцин – буровато-желтого.
Методика. 0,05 г препарата (фенола, тимола, резорцина) растворяют в 0,5 мл раствора аммиака и добавляют 3-4 капли раствора хлорамина, нагревают на кипящей водяной бане.
4.2. Реакция с реактивом Марки
Реактив Марки – это раствор формальдегида в концентрированной серной кислоте. Фенолы взаимодействуют с ним с образованием метиленового производного бис-салициловой кислоты (I), которое окисляется, образуя арилметановый (ауриновый) краситель хиноидной структуры красного или вишнево-красного цвета. Серная кислота играет при этом роль дегидратирующего, конденсирующего средства и окислителя.

Методика. Около 0,02 г препарата (резорцин, салициловая кислота, фенилсалицилат, ацетилсалициловая кислота) помещают в фарфоровую чашку, прибавляют каплю формалина, 2-3 капли серной кислоты, наблюдают появление малинового окрашивания.
Если пара-положение занято (синестрол), то продуктами окисления являются не пара-, а орто-хиноны (III).

4.3. Реакция с хлороформом в щелочной среде
При нагревании фенолов с хлороформом в щелочной среде образуются аурины – трифенилметановые красители. Реакция является фармакопейной на тимол.



М е т о д и к а. 0,2 г тимола нагревают на водяной бане с 1 мл гидроксида натрия. К подогретому раствору прибавляют 2-3 капли хлороформа и взбалтывают, появляется красно-фиолетовое окрашивание.
Количественный анализ
Методы галогенирования
Основаны на реакции электрофильного замещения атомов водорода бензольного кольца на атомы галогена.
1.1. Броматометрический метод
1.1.1. Прямое титрование броматом калия в присутствии КВг по индикатору метиловому оранжевому или метиловому красному (принят ГФ X для количественного определения тимола).
![]()

Избыточная капля брома необратимо окисляет индикатор, и происходит обесцвечивание раствора. Появление желтой окраски свидетельствует об избытке брома.
1.1.2. Обратное титрование. К препарату прибавляют в кислой среде избыток титрованного раствора бромата калия и калия бромид. Образующийся бром вступает в реакцию электрофильного замещения с фенолом. Избыток брома определяют йодометрически: прибавляют калия йодид и выделившийся йод титруют тиосульфатом натрия до обесцвечивания (индикатор – крахмал).
![]()

![]()

Часто титрование проводят в присутствии хлороформа для растворения осадка бромфенолпроизводного. Титруют в этом случае при сильном встряхивании до обесцвечивания хлороформного слоя.
1.2. Йодометрический метод, варианты прямого и обратного титрования
Определение проводят в гидрокарбонатной или ацетатной среде (для связывания выделяющегося йодоводорода). Индикатор – крахмал.
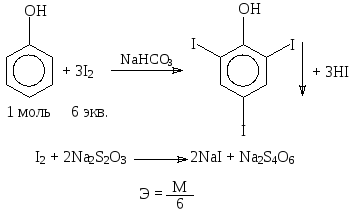
1.3 Обратная йодхлорметрия
При взаимодействии фенолов с йодмонохлоридом образуются йодпроизводные фенолов. Избыток йодмонохлорида определяют йодометрически. Прибавляют KI и выделившийся йод титруют тиосульфатом натрия (индикатор – крахмал). Йодмонохлорид в отличие от брома не вытесняет карбоксильную группу, находящуюся в орто- или пара-положении по отношению к фенольному гидроксилу.



Метод ацилирования (ацетилирования)
Метод основан на свойстве фенолов образовывать сложные эфиры (ацильные производные) с ангидридами кислот.
Варианты: косвенная алкалиметрия, гравиметрия по ацильному производному, обратное кислотно-основное титрование (метод щелочного гидролиза ацильного производного) (см. определение спиртового гидроксила, количественный анализ).

Фотоколориметрический метод
Проводится с применением реакций окрашивания (комплексообразования с хлоридом железа (III), азосочетания с солями диазония). Расчет ведется с использованием стандартного раствора или калибровочного графика.
