
- •Предмет, методы и задачи аналитической химии
- •Общие вопросы качественного анализа Аналитическая химическая реакция
- •Условия проведения аналитических химических реакций
- •Использование реакций осаждения в качественном анализе
- •Коллоидообразование и его роль в качественном анализе
- •Сравнительная характеристика свойств коллоидных растворов, истинных растворов и суспензий
- •Органические аналитические реагенты и их применение в качественном анализе
- •Систематический и дробный качественный анализ
- •Аналитические классификации катионов
- •Аналитические классификации анионов
- •Аналитические группы ионов и Периодический закон д. И. Менделеева
- •Классификация методов анализа в зависимости от величины пробы
- •Техника эксперимента в качественном анализе
- •Методы разделения и обнаружения ионов,
- •Методы разложения и удаления солей аммония
- •Систематический ход анализа катионов I группы
- •«Качественные реакции на катионы II аналитической группы».
- •Систематический ход анализа катионов I–II групп
- •«Катионы III аналитической группы»
- •Оптимальные условия осаждения катионов III группы
- •Систематический ход анализа катионов III группы
- •Систематический ход анализа катионов I–III групп
- •Систематический ход анализа катионов I–III групп в присутствии фосфат-ионов po43–
- •Систематический ход анализа
- •Анализ фильтрата
- •Анализ осадка
- •2.3.1. Растворение осадка.
- •Вопросы к лабораторной работе:
- •Лабораторная работа №3 «Анализ смеси катионов 3 группы».
- •(Проводят с отдельными порциями исследуемого раствора)
- •Систематический ход анализа
- •2.1. Осаждение катионов 3 группы.
- •. Анализ фильтра
- •2.3. Анализ осадка
- •2.3.1. Обнаружение ионов марганца.
- •Вопросы к лабораторной работе
- •Общая характеристика I группы
- •Опыт 1. Характерные реакции на ион co32-
- •«Качественные реакции на анионы II группы». Общая характеристика анионы II группы
- •«Качественные реакции на анионы III группы».
- •Лабораторная работа №5 «Анализ смеси анионов»
- •Подготовка к выполнению работы и проведение анализа.
- •1. Предварительные испытания
- •1.1 Испытание реакции исследуемого раствора.
- •1.2. Проба на анионы 1 группы.
- •1.3. Проба на анионы 2 группы.
- •2. Открытие анионов 1 группы
- •2.1. Обнаружение сульфат ионов.
- •3. Открытие анионов II группы
- •3.1. Обнаружение хлорид-ионов.
- •3.2. Обнаружение иодид-ионов.
- •4. Открытие анионов III группы
- •4.1 Обнаружение нитрат-ионов.
- •Вопросы к лабораторной работе
- •Лабораторная работа №6 «анализ неизвестного вещества».
- •Подготовка вещества к анализу
- •Предварительные испытания
- •Растворение твёрдых веществ
- •Анализ катионов
- •Анализ анионов
- •Лабораторная работа №7 «Анализ смеси солей».
- •1. Предварительные испытания
- •2. Осаждение катионов III группы
- •3. Растворение осадка сульфидов катионов III группы
- •4. Подготовка раствора к открытию катионов I и II группы
- •5. Обнаружение анионов
- •1.3 Органические аналитические реагенты, их применение в анализе.
- •Раствор
- •Осаждение катионов 2 группы Проверка полноты осаждения нет
- •Центрифугирование
- •Раствор
- •Навеска Раствор
- •3 Группы
- •Приложение 2 Техника выполнения основных операций
- •Некоторые рекомендации к выполнению контрольных анализов.
«Качественные реакции на анионы III группы».
Общая характеристика анионов III группы
К IIIгруппе анионов относятся ионыNO2–иNO3–. АнионыIIIгруппы не имеют группового реагента.
Нитрит-ионы являются анионами слабой кислоты и подвергаются гидролизу в водных растворах. Ионы NO2–обладают окислительными и восстановительными свойствами, а ионыNO3–– восстановительными.
Все нитриты хорошо растворимы в воде. Все нитраты (кроме нитратов висмута и ртути) также хорошо растворимы в воде.
Опыт 7. Характерные реакции на ион NO2–
Описание 1. Реакция с реактивом Грисса–Илосвая.
Реактив Грисса–Илосвая (смесь сульфаниловой кислоты HSO3C6H4NH2 с α-нафтиламином C10H7NH2) с нитрит-ионами в нейтральных и уксуснокислых растворах придает раствору ярко-красный цвет за счёт образования азокрасителя. В кислой среде в присутствии нитрит-ионов образуется азотистая кислота, реагирующая с сульфаниловой кислотой с образованием соли диазония:
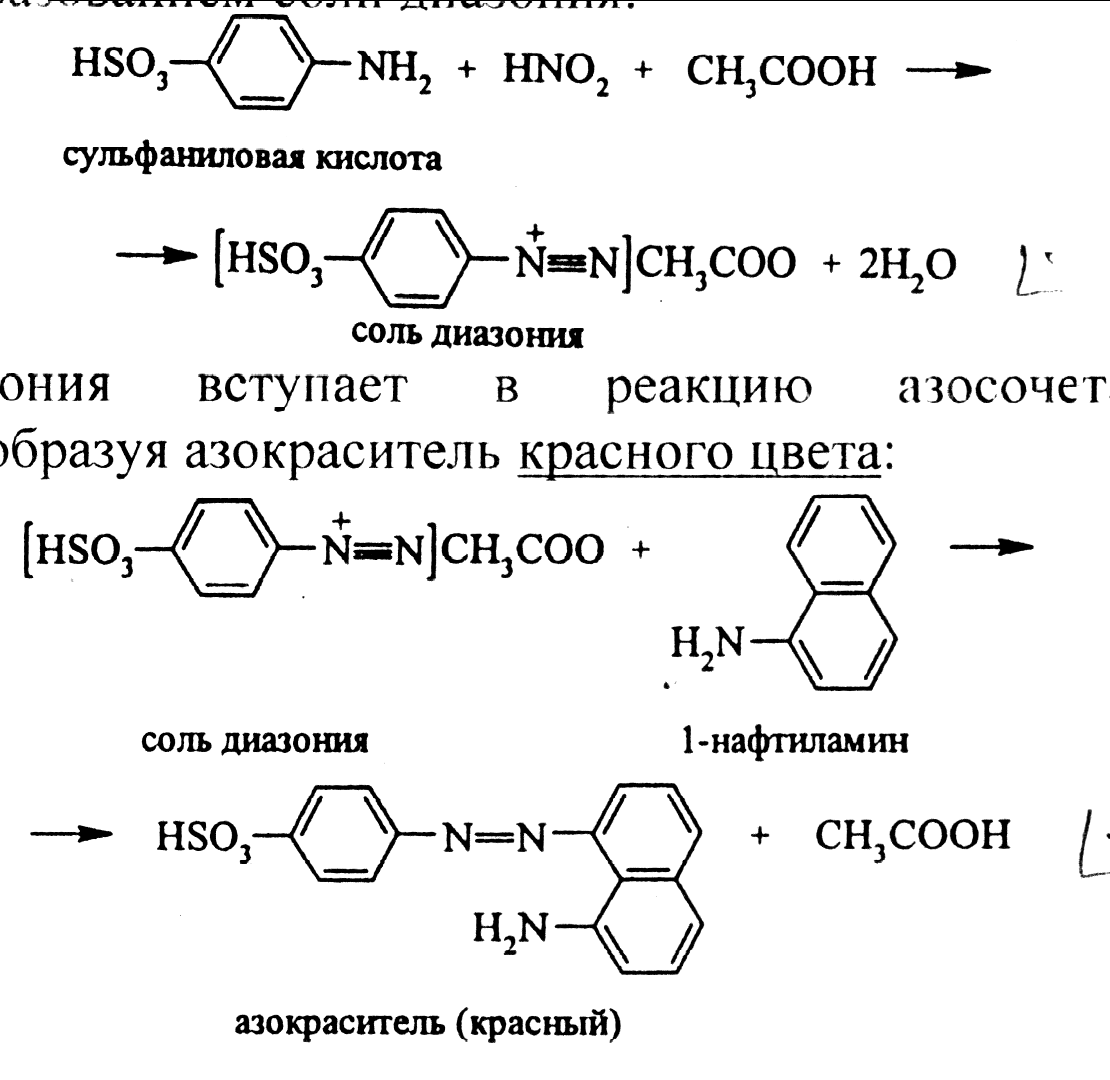
Соль диазония вступает в реакцию азосочетания с α-нафтиламином, образуя азокраситель красного цвета:
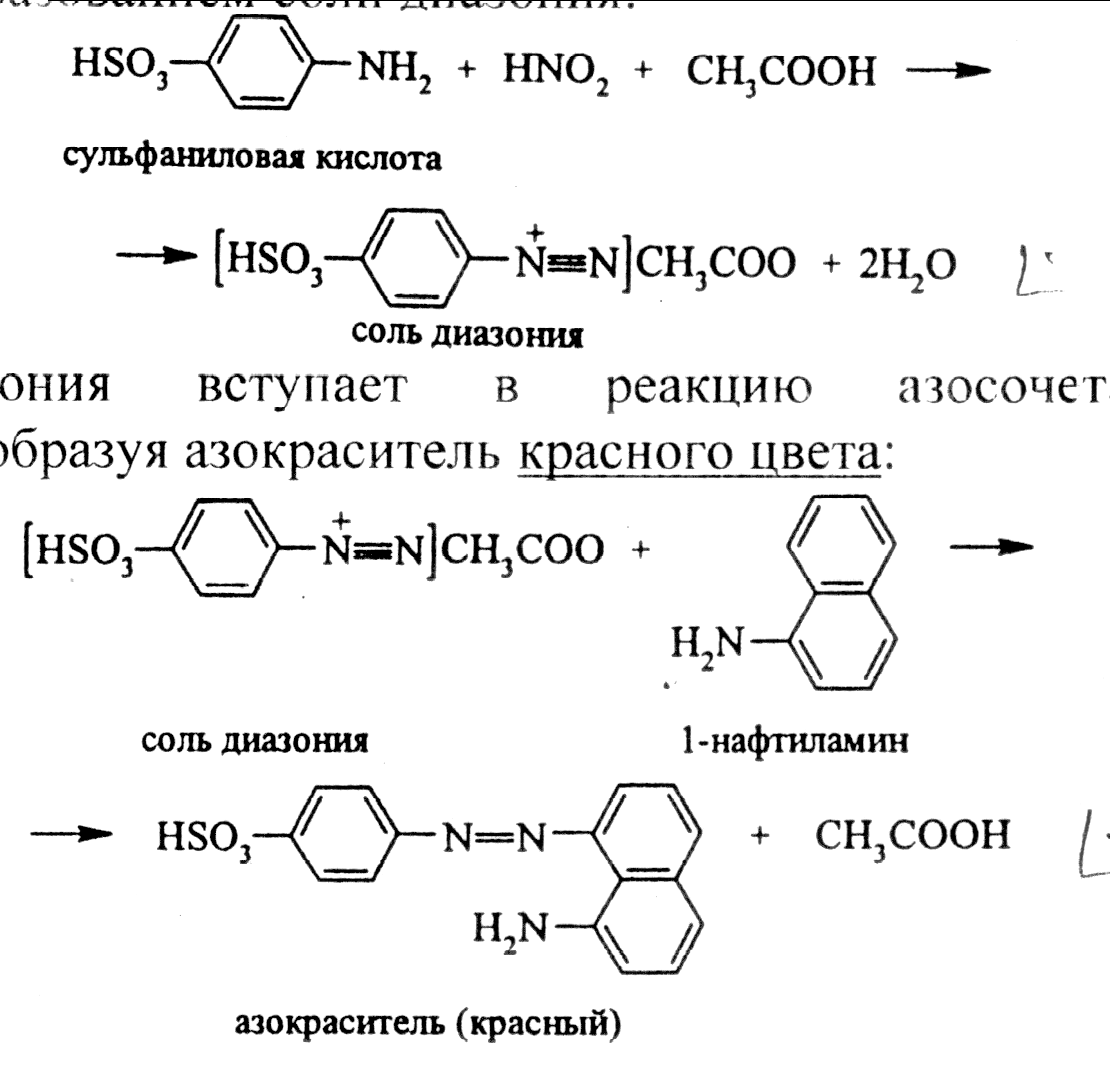
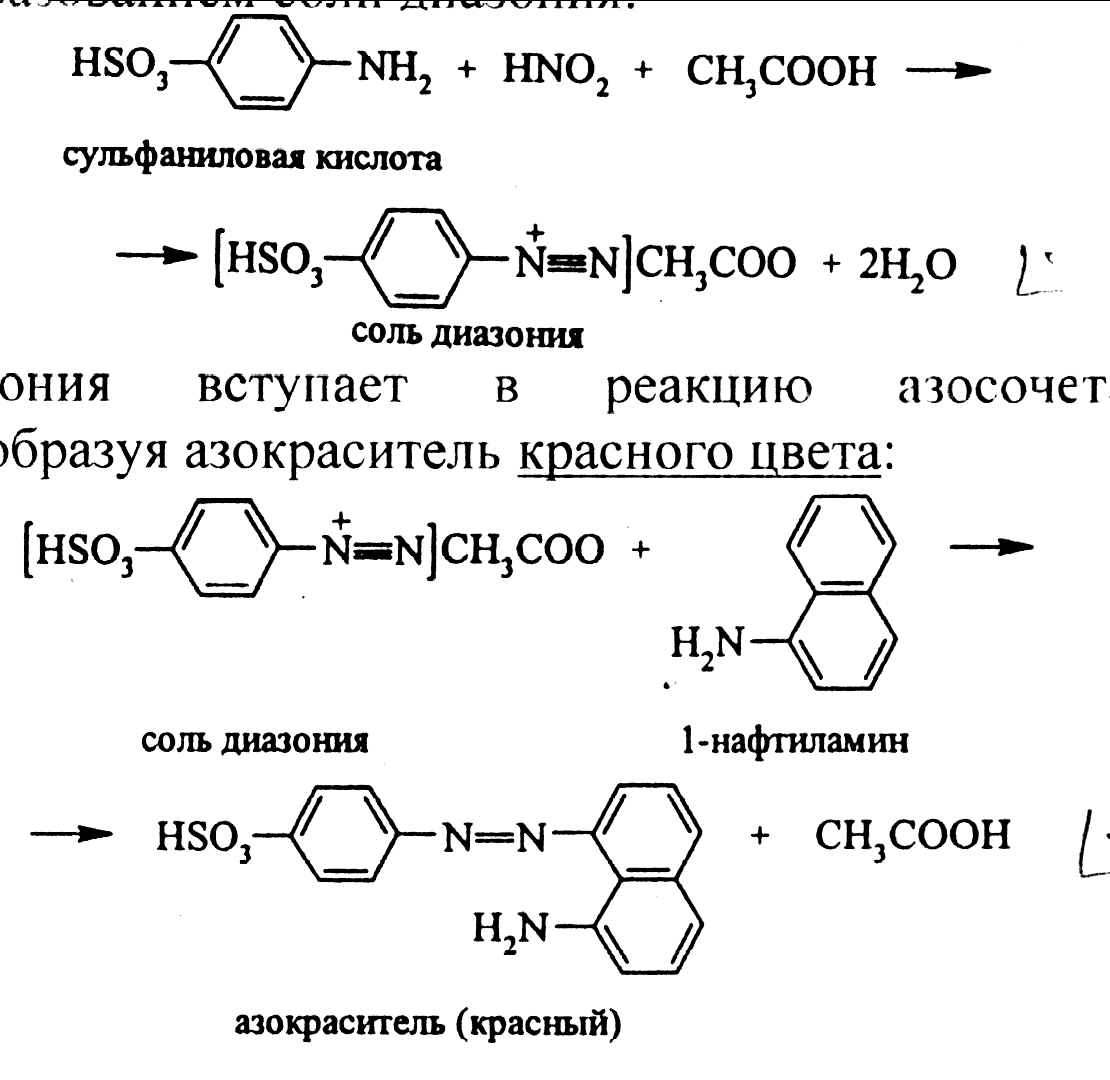
Описание 2. Реакция с солями аммония.
Нитрит-ионы при нагревании окисляют ионы аммония NH4+ и карбамид до свободного N2:
NO2– + NH4+ → N2 + 2H2O,
2NO2– + 2H+ + CO(NH2)2 → 2N2 + CO2 + 3H2O.
Эти реакции используют с целью удаления нитрит-ионов.
Описание 3. Реакция с иодидом калия.
К 2-3 каплям раствора, содержащего нитрит-ионы, добавляют 1-2 капли 2М соляной кислоты или уксусной кислоты и 2-3 капли раствора иодида калия. Иодид калия в разбавленных кислых растворах окисляется нитрит-ионами до молекулярного иода I2:
2NO2– + 2I– + 4H+ → I2 + 2NO + 2H2O.
Выделившийся иод окрашивает раствор в бурый цвет. При добавлении крахмала появляется синее окрашивание.
Описание 4. Реакция с перманганатом калия.
К 2-3 каплям раствора KMnO4 прибавляют 2-3 капли 1М серной кислоты, несколько капель раствора, содержащего нитрит-ионы, и слегка подогревают. Осуществляется превращение иона NO2– до NO3–:
5NO2– + 2MnO4– +6H+ → 5NO3– + 2Mn2+ + 3H2O.
При этом раствор KMnO4 обесцвечивается.
Опыт 8. Характерные реакции на ион NO3–
Описание 4. Реакция с дифениламином.
На стеклянную пластинку помещают 2-3 капли раствора дифениламина в концентрированной серной кислоте и 1-2 капли раствора, содержащего нитрат-ионы.
Дифениламин (C6H5)2NH в среде концентрированной H2SO4 окисляется нитрат-ионами вначале в бесцветный дифенилбензидин, а затем в дифенилдифенохинондиимин, окрашенный в интенсивно-синий цвет. Предполагают следующий механизм окисления дифениламина в кислой среде. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
2C6H5NHC6H5 → C6H5–NH–C6H4–C6H4–NH–C6H5 + 2H+ + 2e.
дифениламин дифенилбензидин (бесцветный)
Затем происходит обратимое окисление дифенилбензидина до окрашенного в синий цвет дифенилдифенохинондиимина:
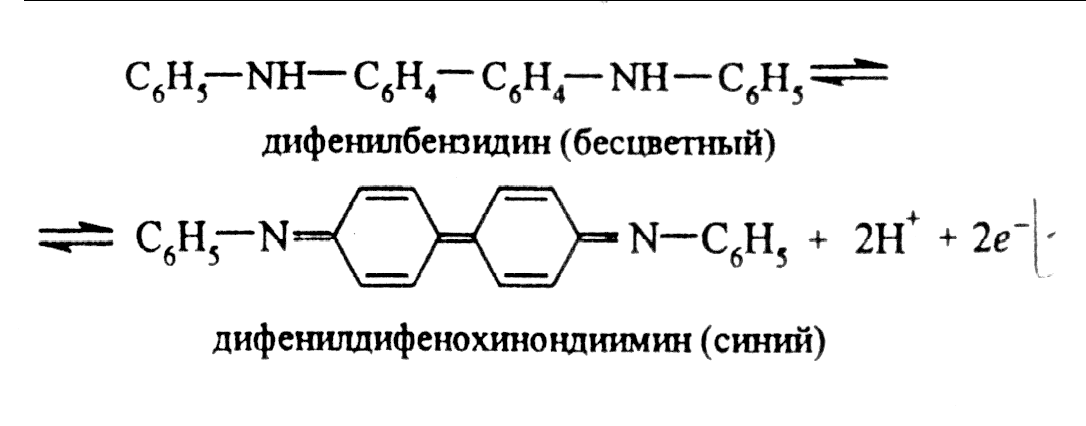
Описание 2. Реакция с металлическим цинком или алюминием.
К 3-4 каплям раствора, содержащего нитрат-ионы, прбвляют несколько капель 2М гидроксида натрия и 1-2 кусочка металлического алюминия. Пробирку закрывают не очень плотно ватой, поверх которой помещают влажную красную лакмусовую бумагу и нагревают на водяной бане. Выделяющийся аммиак окрашивает предварительно увлажнённую индикаторную бумагу в синий цвет. Нитрат-ионы в щелочной среде восстанавливаются металлическим цинком до аммиака:
NO3– + 4Zn + 7OH– → NH3↑ + 4ZnO22– + 2H2O.
