
- •Кафедра биоорганической химии БГМУ
- •Кислотность и основность- основополагающие понятия, определяющие многие фундаментальные физико-химические и биологические свойства органических
- •ФУНКЦИОНАЛЬНЫЕ ГРУППЫ природных соединений
- •теория Бренстеда-Лоури
- •Электронная теория Льюиса
- •Кислотность
- •Классификация органических кислот
- •pKa — количественная характеристика кислотных свойств
- •рКа некоторых соединений
- •Качественная оценка кислотных свойств органических соединений
- •Стабильность аниона определяется характером делокализации отрицательного заряда и зависит:
- •Электроотрицательность элементов кислотного центра
- •Поляризуемость
- •Если радикалы кислот одинаковы
- •Реакции замещения
- •тиолы окисляются легко
- •Окисление фенолов
- •Окисление спиртов
- •Окисление этанола in vivo
- •Степень делокализации отрицательного заряда в анионе
- •Сравнение кислотности этанола и фенола
- •сравнение кислотности этанола и этановой кислоты
- •сравнение кислотности этанола и этандиола
- •сравнение кислотности фенола, пара-аминофенола, пара- нитрофенола
- •этоксид-анион
- •сравнение кислотности этановой кислоты, этандиовой кислоты
- •кислотность гетероциклов
- •Сравнение кислотности этоксикатиона и этанола
- •Влияние сольватации
- •Основность по Бренстеду; классификация оснований
- •n- ОСНОВАНИЯ
- •Качественная характеристика основности- величина электронной плотности на основном центре
- •Природа атома
- •Влияние радикала
- •Влияние сольватации
- •Влияние сольватации
- •Влияние сольватации
- •Реакции кислотно-основного взаимодействия
- •новокаин
- •Основность гетероциклов
- •Основность гетероциклов
- •Амфотерность органических соединений
- •амфотерность спиртов
- •способность к образованию водородных связей
- •амфотерность многоатомных спиртов
- •амфотерность аминокислот
- •амфотерность имидазола
- •AlCl3 FeCl3 BF3
- •ОСНОВАНИЯ ЛЬЮИСА
- •ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ ПИРСОНА (ЖКМО)
- •Ионизация.Роль ее в проявлении биологической активности
- •Ионизация и биологическая активность
- •БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- •Перераспределение -электронной плотности в сопряженной системе под влиянием заместителя, вступающего в - -
- •Комплексы протопорфирина IX
- •электронодонорные и электроноакцепторные заместители
- •ПОРФИН
амфотерность многоатомных спиртов
|
|
|
|
|
|
Н |
|
ОН |
|
|
Н2С — О |
|
|
|
|
|
|
:О —СН2 |
||
Н2С — ОН |
|
НО —С Н2 |
|
|
||
+ НО — Cu + |
|
|
Cu |
|
||
|
|
-2Н2ОН С — О: |
|
О —СН2 |
||
Н2С — ОН |
|
НО —СН |
|
2 |
|
|
|
|
2 |
|
|
Н |
|
|
|
|
|
|
|
|

амфотерность аминокислот
|
-H+ |
H3+N — CH — COO- |
-H+ |
H2N — CH — COO- |
||
H3+N — CH — COOН |
+ H+ |
|||||
|
+ H+ |
|
|
|
|
|
R |
R |
|
R |
|||
катионная форма |
амфиион |
|
анионная форма |
|||
|
|
цвиттер-ион |
|
|
|
|
|
|
|
|
|
|
|
амфотерность имидазола
:N |
N |
основный |
|
центр |
|||
H |
H |
||
N |
|
.. |
|
|
N |
N |
|
N |
.. |
|
|
H |
|
H |
N |
N: |
N-H кислотный |
|
|
|
Tкип. 256° |
|
центр |
|
|

 AlCl3
AlCl3 
 FeCl3
FeCl3  BF3
BF3
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
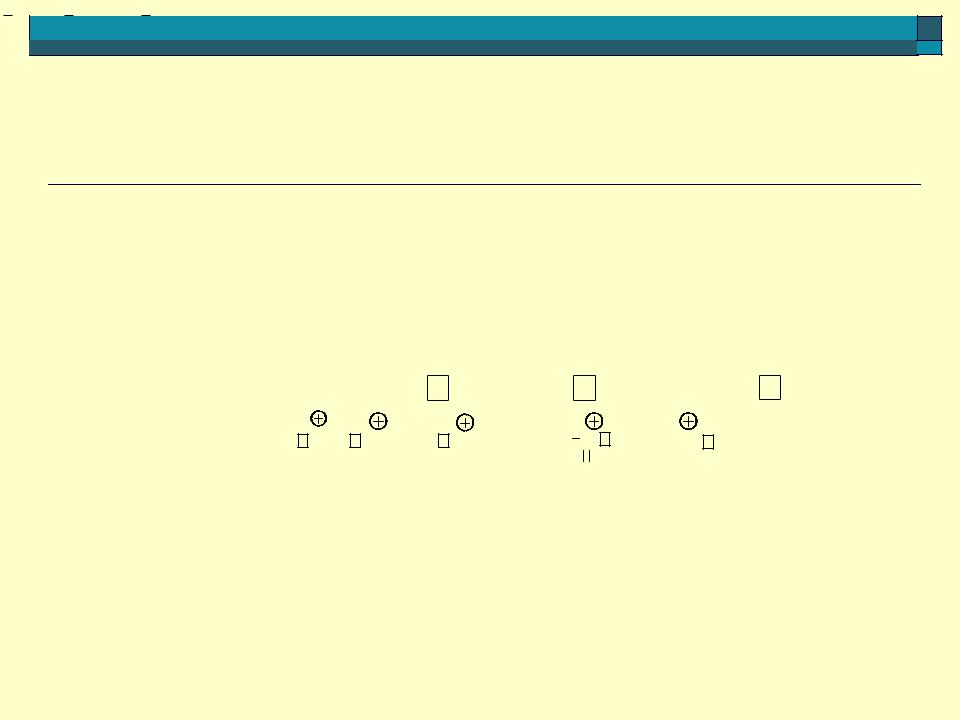
Кислоты Льюиса – это нейтральные молекулы, содержащие атомы с вакантными орбиталями и положительно заряженные ионы (катионы), способные принимать пару электронов (акцепторы пары электронов). Кислоты Льюиса:
|
Нейтральные молекулы: |
AlCl3 |
|
FeCl3 |
BF3 |
|
|
|
|
|
|
|
|
Катионы: |
H NO2 |
SO3H |
R C |
R3C |
|
|
|
|
|
||||
|
|
катион |
катион |
O |
|
|
|
|
нитрония |
сульфония |
|
карбокатионы |
|

ОСНОВАНИЯ ЛЬЮИСА
Основания Льюиса – это нейтральные молекулы, содержащие атомы с неподеленными парами электронов и отрицательно заряженные ионы (анионы), способные отдавать пару электронов (доноры пары электронов).
Нейтральные молекулы:
NH3 R |
|
NH2 R |
|
NHR1 |
R3N H2O |
||||||||||||
|
|
||||||||||||||||
R |
|
OH R |
|
O |
|
R R |
|
SH |
R |
|
S |
|
R |
||||
|
|
|
|
|
|
||||||||||||
Анионы:
H OH OR SR Hal R3C
ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ ПИРСОНА (ЖКМО)
В связи с различной поляризуемостью кислоты и основания Льюиса (нуклеофильные и электрофильные реагенты) можно подразделить на «жесткие» и «мягкие». Жесткими реагентами называются кислоты и основания Льюиса, содержащие атомы низкой поляризуемости и высокой электроотрицательности. К ним можно отнести, например, нуклеофилы Н2О, ОН , ROH, RO , F , NH3 и электрофилы Н+, Li+, AlCl3. Мягкими реагентами называются кислоты и основания Льюиса, которые содержат атомы высокой поляризуемости и низкой электроотрицательности, например, нуклеофилы: R2S, RSH, RS–, I–, R– и электрофилы: Cu²+, Ag+, Hg²+. Промежуточное положение занимают Cl–, R+, C6H5NH2 и др.
В 1963 году Р. Пирсон сформулировал принцип жестких и мягких кислот и оснований (ЖМКО), который гласит, что наиболее стабильная связь образуется в реакции жесткой кислоты с жестким основанием и мягкой кислоты с мягким основанием.
Ионизация.Роль ее в проявлении биологической активности
Белки, в том числе и ферменты, построенные из L-аминокислот, в ряде случаев содержащих в радикалах способные к ионизации группы (кислотные,основные), являются поли- электролитами. В зависимости от соотношения этих групп и рН среды они будут иметь различный по знаку или величине заряд, степень гидратации и, соответсвенно, пространственную структуру. А последняя будет определять их биологическую и ферментативную активность.

Ионизация и биологическая активность
Биологическая активность вещества (биорегулятора, лекарственного средства) будет зависеть от его способности связываться с рецепторами, проникать в клетку через мембраны. Мембраны клеток имеют внутренний липидный бислой и, как правило, отрицательный заряд.Следовательно, на проникновение веществ через мембраны будут влиять липофильность вещества, знак и величина заряда его иона, размер и степень сольватации.


