
- •Кафедра биоорганической химии БГМУ
- •Кислотность и основность- основополагающие понятия, определяющие многие фундаментальные физико-химические и биологические свойства органических
- •ФУНКЦИОНАЛЬНЫЕ ГРУППЫ природных соединений
- •теория Бренстеда-Лоури
- •Электронная теория Льюиса
- •Кислотность
- •Классификация органических кислот
- •pKa — количественная характеристика кислотных свойств
- •рКа некоторых соединений
- •Качественная оценка кислотных свойств органических соединений
- •Стабильность аниона определяется характером делокализации отрицательного заряда и зависит:
- •Электроотрицательность элементов кислотного центра
- •Поляризуемость
- •Если радикалы кислот одинаковы
- •Реакции замещения
- •тиолы окисляются легко
- •Окисление фенолов
- •Окисление спиртов
- •Окисление этанола in vivo
- •Степень делокализации отрицательного заряда в анионе
- •Сравнение кислотности этанола и фенола
- •сравнение кислотности этанола и этановой кислоты
- •сравнение кислотности этанола и этандиола
- •сравнение кислотности фенола, пара-аминофенола, пара- нитрофенола
- •этоксид-анион
- •сравнение кислотности этановой кислоты, этандиовой кислоты
- •кислотность гетероциклов
- •Сравнение кислотности этоксикатиона и этанола
- •Влияние сольватации
- •Основность по Бренстеду; классификация оснований
- •n- ОСНОВАНИЯ
- •Качественная характеристика основности- величина электронной плотности на основном центре
- •Природа атома
- •Влияние радикала
- •Влияние сольватации
- •Влияние сольватации
- •Влияние сольватации
- •Реакции кислотно-основного взаимодействия
- •новокаин
- •Основность гетероциклов
- •Основность гетероциклов
- •Амфотерность органических соединений
- •амфотерность спиртов
- •способность к образованию водородных связей
- •амфотерность многоатомных спиртов
- •амфотерность аминокислот
- •амфотерность имидазола
- •AlCl3 FeCl3 BF3
- •ОСНОВАНИЯ ЛЬЮИСА
- •ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ ПИРСОНА (ЖКМО)
- •Ионизация.Роль ее в проявлении биологической активности
- •Ионизация и биологическая активность
- •БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- •Перераспределение -электронной плотности в сопряженной системе под влиянием заместителя, вступающего в - -
- •Комплексы протопорфирина IX
- •электронодонорные и электроноакцепторные заместители
- •ПОРФИН

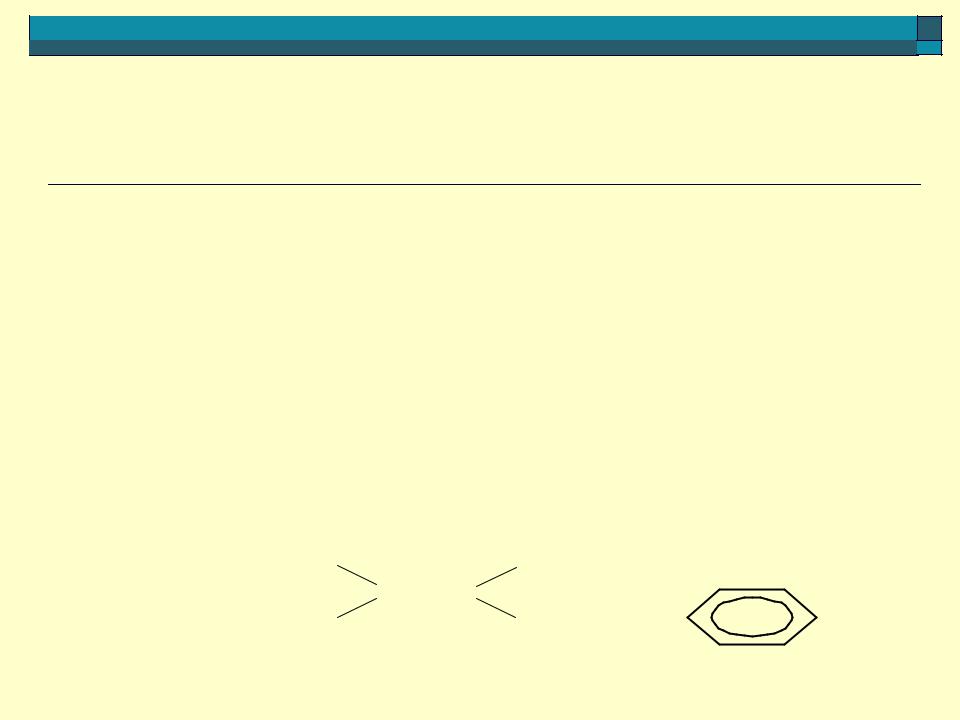
Сравнение кислотности этоксикатиона и этанола
+ |
H |
H+ + CH3 — CH2 — OH pKa = 2,2 |
CH3 — CH2 — O |
H |
|
|
|

Влияние сольватации
|
муравьи |
уксусная |
пропановая |
|
ная |
|
|
рКа |
3,7 |
4,7 |
4,9 |
H - COO¯ |
CH3 – COO ¯ |
CH3 – CH2-COO¯ |
Основность по Бренстеду; классификация оснований
n-основания |
молекулы и анионы |
|
|
аммониевые |
- ¨NH - |
оксониевые |
- ¨O - |
тиониевые |
- ¨S - |
π-основания
C  С
С

n- ОСНОВАНИЯ
|
n-основания: |
анионы |
|
R–ОН — спирты |
НО¯ гидроксид-ион |
R–O–R — простые эфиры RO¯ алкоксид-ион
R- CO-R- альдегиды(кетоны) RS¯ алкил-тиолят-ион
|
RCOOH- кислоты |
H2N¯ амид-ион |
|
R–SH — тиолы |
RCOO¯ ацилат-ион |
|
R–NH2— амины |
Н¯ — гидрид ион |

рКвн+ - количественная характеристика основности
Kвн B H
BH
рКа + рКв = 14
Константа кислотности сопряженной к-ты
рКвн+ = -lg Квн+
чем выше рКвн+, тем сильнее основание

Значения рКвн+ некоторых оснований
Гидроксид натрия |
14 |
Этиламин |
11 |
Аммиак |
9 |
Хинин |
8 |
Анилин, пиридин |
5 |
п-Нитроанилин |
1 |
Качественная характеристика основности- величина электронной плотности на основном центре
Природа атома
|
. . |
. . |
. . |
|
СН3 |
О СН3 |
СН3 S СН3 |
||
СН3 NH CH3 |
||||
2 |
|
3 |
1 |
|
|
|
|
ЭO N ниже, чем О
радиус S больше, чем О
Влияние радикала
|
2 |
1 |
||
|
|
|||
— NH2 |
|
CH3 |
— |
NH2 |
сопряжение |
+IСН3 |
|

. .
СН3 СН2 NH2
этиламин
-I NH2
электроноакцептор
