
- •Кафедра биоорганической химии БГМУ
- •Кислотность и основность- основополагающие понятия, определяющие многие фундаментальные физико-химические и биологические свойства органических
- •ФУНКЦИОНАЛЬНЫЕ ГРУППЫ природных соединений
- •теория Бренстеда-Лоури
- •Электронная теория Льюиса
- •Кислотность
- •Классификация органических кислот
- •pKa — количественная характеристика кислотных свойств
- •рКа некоторых соединений
- •Качественная оценка кислотных свойств органических соединений
- •Стабильность аниона определяется характером делокализации отрицательного заряда и зависит:
- •Электроотрицательность элементов кислотного центра
- •Поляризуемость
- •Если радикалы кислот одинаковы
- •Реакции замещения
- •тиолы окисляются легко
- •Окисление фенолов
- •Окисление спиртов
- •Окисление этанола in vivo
- •Степень делокализации отрицательного заряда в анионе
- •Сравнение кислотности этанола и фенола
- •сравнение кислотности этанола и этановой кислоты
- •сравнение кислотности этанола и этандиола
- •сравнение кислотности фенола, пара-аминофенола, пара- нитрофенола
- •этоксид-анион
- •сравнение кислотности этановой кислоты, этандиовой кислоты
- •кислотность гетероциклов
- •Сравнение кислотности этоксикатиона и этанола
- •Влияние сольватации
- •Основность по Бренстеду; классификация оснований
- •n- ОСНОВАНИЯ
- •Качественная характеристика основности- величина электронной плотности на основном центре
- •Природа атома
- •Влияние радикала
- •Влияние сольватации
- •Влияние сольватации
- •Влияние сольватации
- •Реакции кислотно-основного взаимодействия
- •новокаин
- •Основность гетероциклов
- •Основность гетероциклов
- •Амфотерность органических соединений
- •амфотерность спиртов
- •способность к образованию водородных связей
- •амфотерность многоатомных спиртов
- •амфотерность аминокислот
- •амфотерность имидазола
- •AlCl3 FeCl3 BF3
- •ОСНОВАНИЯ ЛЬЮИСА
- •ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ ПИРСОНА (ЖКМО)
- •Ионизация.Роль ее в проявлении биологической активности
- •Ионизация и биологическая активность
- •БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- •Перераспределение -электронной плотности в сопряженной системе под влиянием заместителя, вступающего в - -
- •Комплексы протопорфирина IX
- •электронодонорные и электроноакцепторные заместители
- •ПОРФИН
Окисление этанола in vivo
CH3 — CH — OH + НАД+ АДГ |
CH3 — C |
O |
+ НАДН + Н+ |
Н |
|
H |
|
|
|
|
Никотинамидадениндинуклеотид - кофермент
НАД++ Н--субстрат-Н+ НАДН + Н+ + субстрат
Степень делокализации отрицательного заряда в анионе
учитывается, если кислоты имеют одинаковые кислотные центры
наличие сопряжения, электроноакцепторных заместителей увеличивает стабильность аниона
наличие электронодонорных заместителей уменьшает стабильность аниона
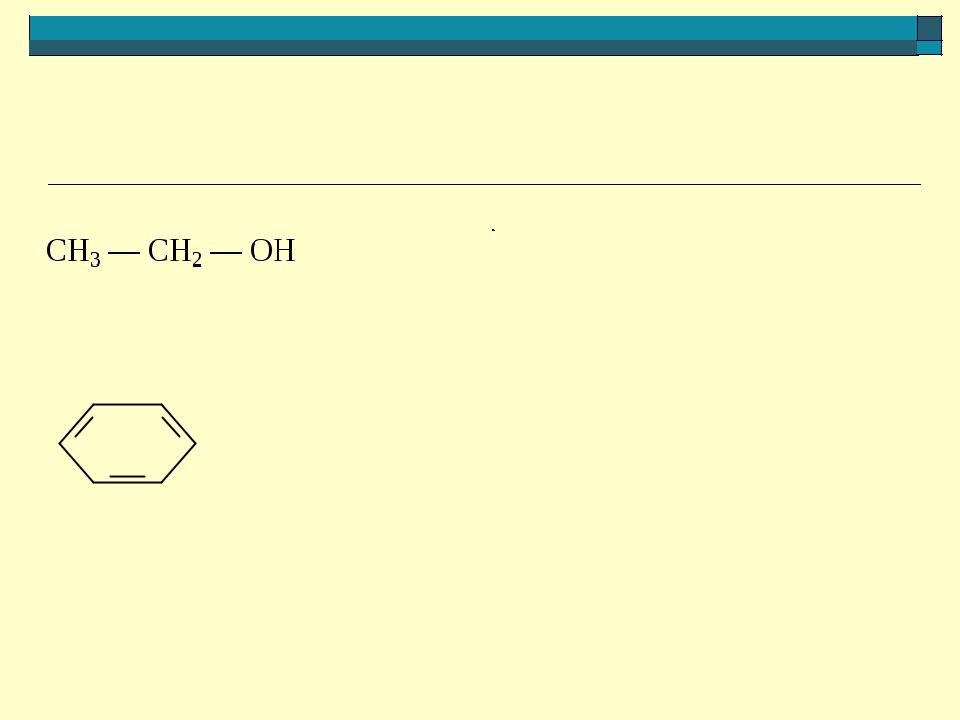
Сравнение кислотности этанола и фенола
2
1
— OH

сравнение кислотности этанола и этановой кислоты
2
O
CH3 — C 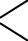 OH
OH
1

сравнение кислотности этанола и этандиола
2
CH2 СH2
1 HO HO
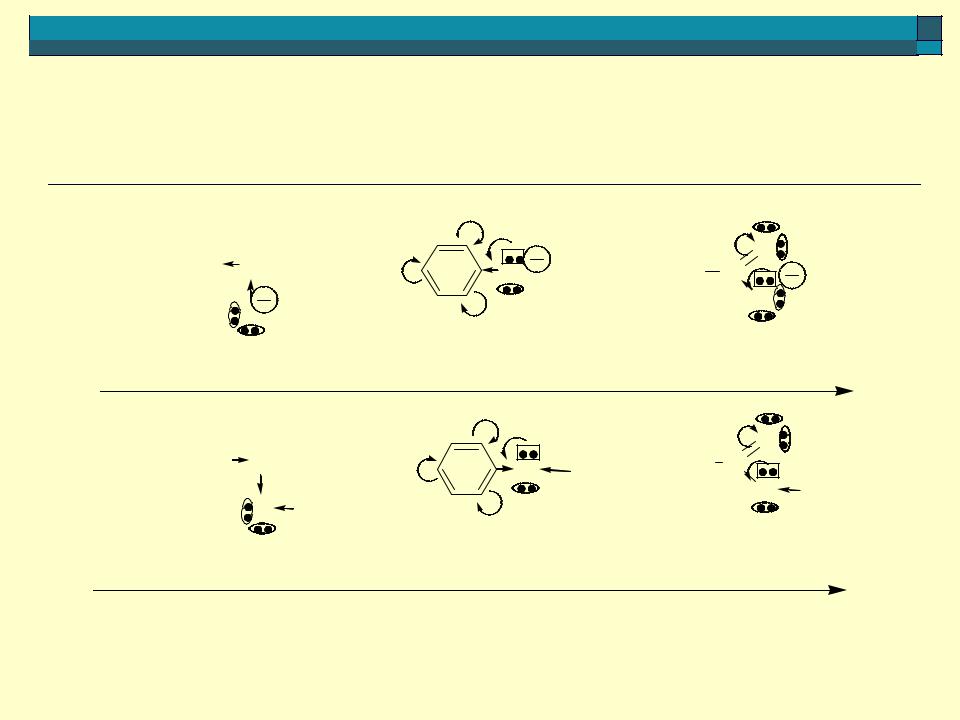
сравнение кислотности фенола, пара-аминофенола, пара- нитрофенола
2 |
|
|
— OH |
+ H+ |
|
|
|
|
|
|
— O |
- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
- H+ |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
+ H+ |
|
|
|
|
|
|
|
|||||
H2N — |
|
|
— OH |
|
|
|
|
|
|
|
H2N — |
|
|
|
— O |
|||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
- H+ |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
NH2 |
- электронодонор |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1
O2N — |
— OH |
+ H+ |
|
O2N — |
— O- |
|
|
|
|||||
|
|
|
||||
- H+ |
NО2 |
- электроакцептор |
|
этоксид-анион |
феноксид-анион |
|
карбоксилат (ацетат)- |
|||
|
|
|
анион |
|
||
H3C CÍ 2 |
O |
|
H C C O |
|
||
O |
|
|
3 |
O |
|
|
|
|
|
|
|||
+I(-C6H5) <-M(-C6H5) -I(>C=O), -M(>C=O) |
||||||
|
||||||
|
ÝÀ |
|
ÝÀ |
|
||
стабильность аниона увеличивается |
O |
|
||||
H3C CH2 |
O |
H |
H3C C |
|
||
O H |
|
|
O |
H |
||
|
|
|
||||
этанол |
фенол |
|
этановая кислота |
|||
|
кислотность увеличивается |
|
|
|||
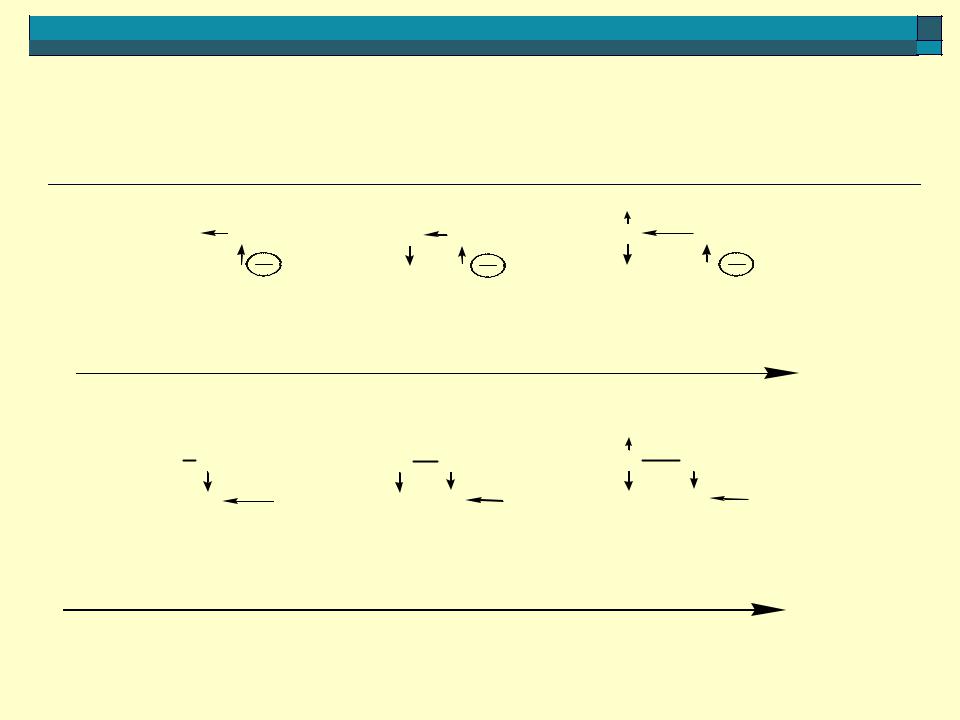
сравнение кислотности этановой кислоты, этандиовой кислоты
O
2 CH3 — C  OH
OH
O O
O
1HO C — C
C — C  OH
OH
|
|
|
|
Cl |
-I(Cl) ÝÀ |
|
H3C CH2 |
H2C CH2 |
ÍC |
CH2 |
|||
|
O |
Cl O |
|
Cl |
O |
|
|
|
-I(Cl) |
|
-I(Cl) |
|
|
|
|
ÝÀ |
|
ÝÀ |
|
|
|
стабильность аниона увеличивается |
|
|
|||
|
|
|
|
Cl -I(Cl) ÝÀ |
||
H3C CH2 |
H2C CH2 |
H |
ÍC CH2 |
|||
+I(-C2H5) |
O H |
Cl O |
|
Cl |
O H |
|
|
|
|
|
|
|
|
ÝÄ |
|
-I(Cl) |
|
-I(Cl) |
|
|
|
|
|
|
|||
|
|
ÝÀ |
|
ÝÀ |
|
|
этанол |
2-хло рэтан о л |
2,2-дихло рэтан о л |
||||
кислотность увеличивается
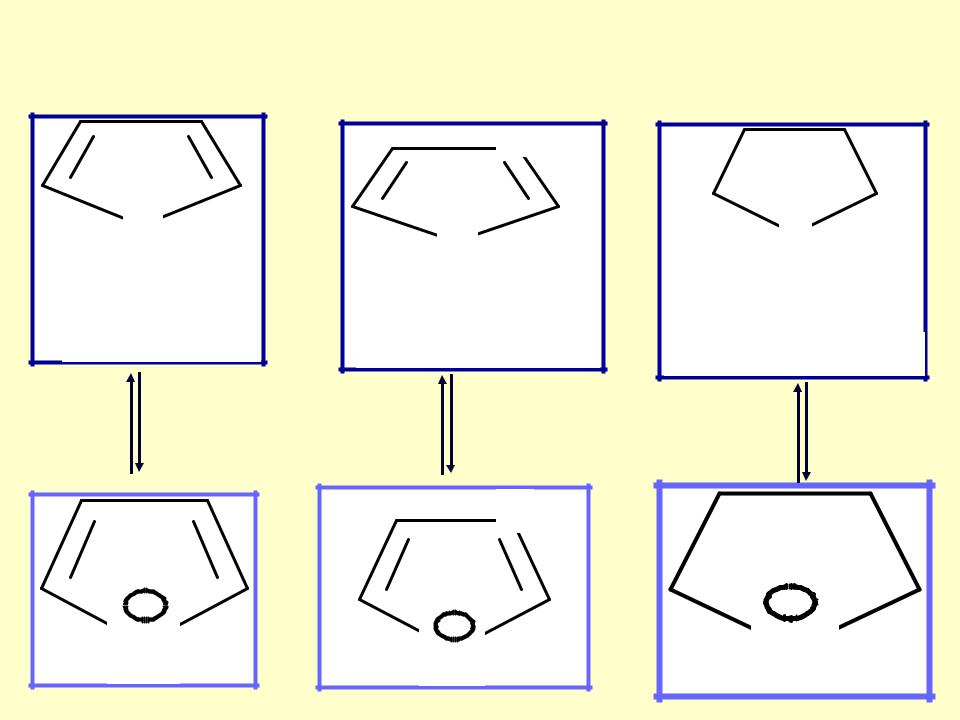
кислотность гетероциклов
|
N |
|
|
|
|
|
|
|
H |
|
|
пиррол |
|||
|
|
|
2 |
+ |
+ |
- |
+ |
|
|||
H |
|
H |
|
– |
N |
|
|
|
N |
|
|
N |
|
|
|
|
|
|
|
|
|
H |
|
|
|
имидазол |
||||
+ |
+ |
- |
+ |
1 |
|
|
|||
H |
|
H |
|
|
|
|
|
N |
|
–
N
|
N |
|
|
|
|
|
|
|
|
|
H |
|
|
|
пирролидин |
||||
|
|
|
|
3 |
+ |
|
+ |
- |
+ |
|
|
|||
H |
|
H |
|
|
|
– |
|
|
|
|
N |
|
|
|
