
- •Вопрос№1Важнейшие классы неорганических соединений. Оксиды, гидроксиды, кислоты, соли.
- •Вопрос№3 Химическая термодинамика. Основные понятия. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос№4 Тепловой эффект химической реакции. Теплота образования вещества. Закон Гесса и следствие из закона Гесса.
- •Следствия из закона Гесса
- •Вопрос№5 Энтропия вещества из системы - мера беспорядка расположения в них частиц.
- •Границы применимости понимания энтропии как меры беспорядка
- •Билет№11 Химические реакции необратимые и обратимые. Химическое равновесие. Закон действия масс для обратимых гомогенных и гетерогенных химических реакций
- •Гетерогенные и гомогенные реакции.
- •Билет№13 Константа химического равновесия и её связь с изменением изобарного потенциала (свободной энергией Гиббса). Выявление возможности протекания реакции в данном направлении.
- •Электролиты и неэлектролиты. Растворы электролитов
- •Вопрос№17 Свойства разбавленных растворов электролитов. Степень диссоциации, константа диссоциации, изотопических коэффициент.
- •Билет №20 Обменные реакции в растворах электролитов. Условие необратимости реакций.
- •Билет №21 Гидролиз солями обратимый и не обратимый.
- •Билет №22 Электрохимические системы. Окислительно-восстановительные реакции. Составление уравнений. Электронный баланс.
- •Окисление, восстановление
- •Билет №26 Стандартные электродные потенциалы. Ряд напряжений и его возможности для характеристики химических свойств веществ.
Вопрос№17 Свойства разбавленных растворов электролитов. Степень диссоциации, константа диссоциации, изотопических коэффициент.
Электролиты (от электро... и греч. lytos — разлагаемый, растворимый), жидкие или твёрдые вещества и системы, в которых присутствуют в сколько-нибудь заметной концентрации ионы, обусловливающие прохождение электрического тока. В узком смысле электролитами называются вещества, растворы которых проводят электрический ток ионами, образующимися в результате электролитической диссоциации. Электролиты в растворах подразделяют на сильные и слабые. Сильные электролиты практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорганические соли и некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.). Молекулы слабых электролитов в растворах лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах. Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.
По количеству ионов, на которые диссоциирует в растворе одна молекула, различают бинарные, или одно-одновалентные, электролиты (обозначаются 1-1электролиты, например КСl), одно-двухвалентные электролиты (обозначаются 1-2 электролиты, например CaCl2) и т. д. Электролиты типа 1-1, 2-2, 3-3 и т. п. называются симметричными, типа 1-2, 1-3 и т. п. — несимметричными.
Свойства разбавленных растворов слабых электролитов удовлетворительно описываются классической теорией электролитической диссоциации. Для не слишком разбавленных растворов слабых электролитов, а также для растворов сильных электролитов эта теория неприменима, поскольку они являются сложными системами, состоящими из ионов, недиссоциированных молекул или ионных пар, а также более крупных агрегатов. Свойства таких растворовопределяются характером взаимодействий ион-ион, ион-растворитель, а также изменением свойств и структуры растворителя под влиянием растворённых частиц. Современные статистические теории сильных электролитов удовлетворительно описывают свойства лишь очень разбавленных (0,1 моль/л)растворов.
Электролиты чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат электролиты. Важный класс электролитов —полиэлектролиты. Электролиты являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы электролитов. Изучение свойств растворов электролитов важно для создания новых химических источников тока и совершенствования технологических процессов разделения веществ — экстракции из растворов и ионного обмена.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
![]()
числа распавшихся на ионы молекул к общему числу растворенных молекул.
Степень
диссоциации ![]() равна
отношению числа диссоциированных
молекул
равна
отношению числа диссоциированных
молекул ![]() к
сумме
к
сумме ![]() ,
где
,
где ![]() —
число недиссоциированных молекул.
Часто
—
число недиссоциированных молекул.
Часто ![]() выражают
в процентах. Степень диссоциации зависит
как от природы растворённого электролита,
так и от концентрации раствора.
выражают
в процентах. Степень диссоциации зависит
как от природы растворённого электролита,
так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когда комплексраспадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
![]()
где
комплекс ![]() разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
![]() ,
,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же
концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Вопрос№18 Законы Рауля и Вант-Гоффа для слабых электролитов.
Законы Рауля
Закон Вант-Гоффа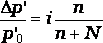
![]()
![]()
![]()
Найденные Вант-Гоффом значения i для растворов солей, кислот, оснований имеют разные значения, зависящие от природы и концентрации растворителя, и изменяются от 1 до 4.
Билет №19 Электролитическая диссоциация воды. Ионное произведение воды, водородный и другие показатели среды и методы их определения.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−илиH2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
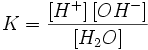
Константа диссоциации воды при 25оС
равна: ![]() Такое
значение константы соответствует
диссоциации одной из ста миллионов
молекул воды, поэтому концентрацию воды
можно считать постоянной и равной 55,55
моль/л (плотность воды 1000 г/л, масса 1 л
1000 г, количество вещества воды
1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55
моль/л). Тогда
Такое
значение константы соответствует
диссоциации одной из ста миллионов
молекул воды, поэтому концентрацию воды
можно считать постоянной и равной 55,55
моль/л (плотность воды 1000 г/л, масса 1 л
1000 г, количество вещества воды
1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55
моль/л). Тогда
![]()
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW:
![]()
Водородный показатель рН:
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
![]()
