
- •Вопрос№1Важнейшие классы неорганических соединений. Оксиды, гидроксиды, кислоты, соли.
- •Вопрос№3 Химическая термодинамика. Основные понятия. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос№4 Тепловой эффект химической реакции. Теплота образования вещества. Закон Гесса и следствие из закона Гесса.
- •Следствия из закона Гесса
- •Вопрос№5 Энтропия вещества из системы - мера беспорядка расположения в них частиц.
- •Границы применимости понимания энтропии как меры беспорядка
- •Билет№11 Химические реакции необратимые и обратимые. Химическое равновесие. Закон действия масс для обратимых гомогенных и гетерогенных химических реакций
- •Гетерогенные и гомогенные реакции.
- •Билет№13 Константа химического равновесия и её связь с изменением изобарного потенциала (свободной энергией Гиббса). Выявление возможности протекания реакции в данном направлении.
- •Электролиты и неэлектролиты. Растворы электролитов
- •Вопрос№17 Свойства разбавленных растворов электролитов. Степень диссоциации, константа диссоциации, изотопических коэффициент.
- •Билет №20 Обменные реакции в растворах электролитов. Условие необратимости реакций.
- •Билет №21 Гидролиз солями обратимый и не обратимый.
- •Билет №22 Электрохимические системы. Окислительно-восстановительные реакции. Составление уравнений. Электронный баланс.
- •Окисление, восстановление
- •Билет №26 Стандартные электродные потенциалы. Ряд напряжений и его возможности для характеристики химических свойств веществ.
Билет №22 Электрохимические системы. Окислительно-восстановительные реакции. Составление уравнений. Электронный баланс.
Существование электрохимических систем возможно из-за возникновения разности потенциалов между металлами и электролитом при их контакте. Измерить потенциал металла (электрода) непосредственно нельзя, но можно измерить его относительно другого электрода.
Эталоном при сопоставлении металлов по их энергетическому потенциалу является стандартный водородный электрод, потенциал которого условно принимается за нуль. Его устройство таково: платиновый электрод покрыт мелкодисперсной платиной (платиновой чернью), погружен в раствор серной кислоты с концентрацией ионов водорода 1 моль/л, обдувается струей газообразного водорода под давлением 100 кПа (Т = 298 K). Водород адсорбируется на поверхности платины. На практике при потенциометрических измерениях водородный электрод используют редко. Чаще применяют более удобные компактные электроды сравнения, имеющие определенное значение потенциала относительно водородного электрода. Обычно пользуются каломельным электродом, состоящим из металлической ртути и раствора хлорида ртути (каломели Hg2Cl2) в хлориде калия. Потенциал каломельного электрода зависит от концентрации ионов ртути, а последняя – от концентрации раствора KCl.
На основании теоретических расчетов установлено, что величина электродного потенциала, возникающая на границе между металлом и раствором соли этого металла (т. е. раствором, содержащим ионы этого металла), равна:
![]()
где Е0 – электрическая постоянная, зависящая от выбора электрода сравнения, R – газовая постоянная, равная 8,32 Дж/граджмоль, Т – абсолютная температура, n – степень окисления металла в данном соединении (в соответствии с теорией строения атома – число электронов, которое теряет атом металла, превращаясь в ион), F – число Фарадея, с – молярная концентрация ионов металла в данном растворе.
Окисли́тельно-восстанови́тельные реа́кции, также редокс (англ. redox, от reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окислительно-восстановительная реакция между водородом и фтором
![]()
Разделяется на две полуреакции:
1) Окисление:
![]()
2) Восстановление:
![]()
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
![]()
![]()
![]()
![]()
![]()
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
![]()
![]()
![]()
![]()
![]()
Метод электронного баланса складывается из следующих этапов:
а) записывают схему реакции (формулы реагентов и продуктов), а затем находят элементы, которые повышают и понижают свои степени окисления, и выписывают их отдельно:
MnCO3 + KClO3 → MnO2 + KCl + CO2 ClV → Cl−I MnII → MnIV
б) составляют уравнения полуреакций восстановления и окисления, соблюдая законы сохранения числа атомов и заряда в каждой полуреакции:
полуреакция восстановления ClV + 6e− = Cl−I полуреакция окисления MnII − 2e− = MnIV
в) подбирают дополнительные множители для уравнения полуреакций так, чтобы закон сохранения заряда выполнялся для реакции в целом, для чего число принятых электронов в полуреакциях восстановления делают равным числу отданных электронов в полуреакции окисления:
ClV + 6e− = Cl−I * 1 MnII − 2e− = MnIV * 3
г) проставляют (по найденным множителям) стехиометрические коэффициенты в схему реакции (коэффициент 1 опускается):
3MnCO3 + KClO3 = 3MnO2 + KCl + CO2
д) уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления при протекании реакции (если таких элементов два, то достаточно уравнять число атомов одного из них, а по второму провести проверку). Получают уравнение химической реакции:
3MnCO3 + KClO3 = 3MnO2 + KCl + 3CO2
е) проводят проверку по элементу, который не менял свою степень окисления (чаще всего это кислород):
слева 9 + 3 = 12 атомов O справа 6 + 6 = 12 атомов O
Подбор коэффициентов проведен правильно.
Билет №23 Механизм образования двойного электрического слоя и электродного потенциала на границе раздела металл-электролит.

![]()



Билет №24 Зависимость электродного потенциала от природы электродов, температуры, концепции потенциала-определяющих ионов. Уравнение Нериста.

 уравнение
Нернста
уравнение
Нернста

Билет №25 Типы электродов (металлические, газовые, первого и второго родов).
К электродам первого рода относятся такие, потенциал которых относительно какого-либо электрода сравнения определяется концентрацией катионов. К ним принадлежат металлы, погруженные в растворы своих солей.
Разновидностью электродов первого рода являются амальгамные электроды, т.е. состоящие либо из растворов металлов в ртути, либо вообще из сплавов металлов жидких или твердых растворов.
В этом случае процесс на электроде изображается уравнением Men+ + ne и, следовательно:
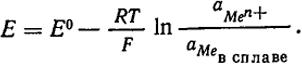
Отсюда следует, что потенциал амальгамного электрода зависит от активности катиона в растворе и активности компонента в металлической фазе.
Электроды второго рода обычно имеют следующее устройство. Металл погружен в насыщенный раствор своей малорастворимой соли, в котором находится другая хорошо растворимая соль с тем же анионом. Примером может служить электрод из металлического серебра, находящегося в соприкосновении с осадком AgCl, т.е. в растворе, насыщенном этой солью. Этот раствор также должен содержать и другой хорошо растворимый электролит с одноименным ионом (например, KCl). На электроде происходит обратимая реакция перехода ионов серебра в раствор или их разрядки, т.е. Agт ←→ Ag+ + e.
За этим следует реакция Ag+ + Cl- = AgClт. Суммарный процесс описывается уравнением Agт + Cl- = AgClт + e.
Так как aAgClт = 1, то, согласно уравнению (IX.20), E = E0 - RT/Fln(1/aCl-).
К электродам третьего рода относятся газовые электроды, в которых газ омывает пластинку из металла или графита, погруженную в раствор. Чаще всего для газовых электродов используется платина. В водородном электроде платинированная платина1 погружена в раствор какой-либо кислоты, например H2SO4.
