
- •Для студентов фармацевтического факультета
- •Введение
- •Требования техники безопасности при работе в химической лаборатории
- •Меры оказания первой помощи при несчастных случаях
- •Методические рекомендации по выполнению и оформлению лабораторных работ
- •Отчет должен содержать следующие сведения:
- •Свойства основных классов неорганических соединений.
- •Определение молекулярной массы эквивалента металла.
- •Приготовление раствора заданной концентрации.
- •Определение теплового эффекта реакции нейтрализации.
- •Кинетика химических реакций, качественные опыты по химическому равновесию.
- •Гетерогенные равновесия и процессы. Произведение растворимости (пр), условия образования и растворения осадков.
- •Гидролиз. Смещение равновесия в реакциях гидролиза.
- •Учебно-исследовательский комплекс (уирс)
- •Окислительно-восстановительные реакции (овр)
- •Получение, состав и свойства комплексных соединений
- •Водород, вода, пероксид водорода.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Свойства элементов Iв группы: Cu, Ag, Au.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Элементы Vа группы периодической системы и свойства их соединений. Азот и фосфор. Мышьяк, сурьма и висмут.
- •Учебно-исследовательский комплекс (уирс)
- •Элементы vIа группы периодической системы и свойства их соединений. Сера.
- •Элементы viIа группы периодической системы. Галогены и свойства их соединений.
- •Учебно-исследовательский комплекс (уирс)
- •Приложение 1 лабораторная техника
- •Образец оформления титульного листа
- •Литература
- •Содержание
Кинетика химических реакций, качественные опыты по химическому равновесию.
Значение темы: знание скорости реакций, влияние различных факторов на скорость химических реакций и химическое равновесие необходимо при приготовлении лекарственных препаратов, их хранении, при изучении метаболизма лекарственных веществ.
Цель: изучить зависимость скорости химических реакций от концентрации и природы реагирующих веществ, температуры, присутствия катализаторов. Изучить влияние различных факторов на химическое равновесие.
Задание.
К пяти каплям гипосульфита натрия (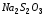 )
добавить такое же количество 2% раствора
серной кислоты (
)
добавить такое же количество 2% раствора
серной кислоты (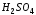 ),
через несколько секунд появляется
помутнение, которое с течением времени
усиливается, так как возрастает
концентрация выделяющейся серы:
),
через несколько секунд появляется
помутнение, которое с течением времени
усиливается, так как возрастает
концентрация выделяющейся серы:
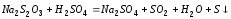
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
Взять четыре пробирки и поместить в первую – 2, во вторую – 5, в третью – 10, в четвертую – 15 капель раствора гипосульфита натрия. Добавить в первую пробирку13, во вторую – 10, в третью – 5 капель дистиллированной воды. Осторожно, но быстро добавить в первую пробирку 5 капель 2% раствора серной кислоты и точно определить, через сколько секунд после смешения реагентов появилась муть. Эту операцию повторить со второй, третьей и четвертой пробирками. Полученные данные занести в табл. 5.
На
основании полученных данных начертить
график зависимости скорости химической
реакции от концентрации реагирующих
веществ, отложив на оси абсцисс
относительные концентрации
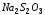 (капли),
а на оси ординат – величину, обратную
времени протекания реакции (с-1).
(капли),
а на оси ординат – величину, обратную
времени протекания реакции (с-1).
Сделать вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Таблица 5
Результаты опыта
|
Номер пробирки |
Объем
|
Объем воды, капли |
Объем |
Время появления мути, с |
Скорость реакции, 1/ |
|
|
|
|
|
|
|
Опыт 2. Зависимость скорости реакции от температуры.
Поместить в пробирку 5 капель раствора гипосульфита натрия. Опустить ее в химический стакан с водой, предварительно измерив температуру воды, а затем быстро, не вынимая пробирку с раствором гипосульфита натрия из стакана, добавить к нему 2 капли раствора серной кислоты и отметить через сколько секунд появится муть.
Эту же операцию повторить с тремя другими пробирками, повышая температуру воды в стакане каждый раз на 100 С. Полученные результаты занести в табл. 6.
Исходя из полученных данных, начертить график зависимости скорости химической реакции от температуры, отложив на оси абсцисс температуру опыта, а на оси ординат – величину, обратную времени появления мути. Сделать вывод о влиянии температуры на скорость реакции. Используя экспериментальные данные и правило Вант-Гоффа, рассчитать температурный коэффициент скорости (γ) для данной реакции.
Таблица 6
Результаты опыта
|
Номер пробирки |
Объем
|
Объем |
Температура опыта, 0С |
Время появления мути, с |
Скорость
реакции, 1/ |
|
|
|
|
|
|
|
Опыт 3. Зависимость скорости химической реакции от величины поверхности раздела фаз в гетерогенной системе.
Взять два небольших одинаковых кусочка мела. Один измельчить и пересыпать в пробирку, второй целиком поместить в другую пробирку. В обе пробирки добавить по 10 капель соляной кислоты (ρ = 1,19 г/см3). Напишите уравнение реакции.
Отметьте, в какой пробирке скорость реакции выше. Сделайте вывод о влиянии величины поверхности соприкосновения реагирующих веществ на скорость химической реакции.
Опыт 4. Химическое равновесие и его смещение. Влияние изменения концентрации реагирующих веществ на смещение химического равновесия.
а)
В пробирку налить 8 капель 0,5Н раствора
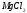 и прибавить по каплям 2Н раствор гидроксида
аммония
и прибавить по каплям 2Н раствор гидроксида
аммония до появления осадка. Записать уравнение
равновесного процесса и выразить
константу равновесия. К образовавшемуся
осадку, до его растворения, добавить по
каплям 2Н раствор хлорида аммония
до появления осадка. Записать уравнение
равновесного процесса и выразить
константу равновесия. К образовавшемуся
осадку, до его растворения, добавить по
каплям 2Н раствор хлорида аммония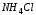 .
Исходя из принципа Ле-Шателье, объяснить
наблюдавшиеся явления.
.
Исходя из принципа Ле-Шателье, объяснить
наблюдавшиеся явления.
б)
В четыре пробирки внесите по 5 капель
разбавленных растворов
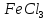 и
и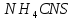 .
Легким встряхиванием пробирок размешайте
растворы и поставьте пробирки в штатив.
В растворе имеет место обратимая реакция:
.
Легким встряхиванием пробирок размешайте
растворы и поставьте пробирки в штатив.
В растворе имеет место обратимая реакция:
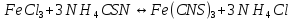
Раствор
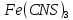 имеет
красную окраску. По изменению интенсивности
окраски можно судить об изменении
концентрации
имеет
красную окраску. По изменению интенсивности
окраски можно судить об изменении
концентрации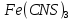 ,
то есть о смещении равновесия в ту или
другую стлрону.
,
то есть о смещении равновесия в ту или
другую стлрону.
В
одну из пробирок добавьте 2-3 капли
концентрированного раствора
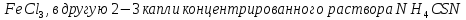 ,
в третью – несколько кристаллов
,
в третью – несколько кристаллов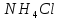 .
Четвертую пробирку с раствором сохраните
для сравнения. Растворы во всех пробирках
размешайте энергичным встряхиванием
и отметьте изменение интенсивности
окраски в каждом случае, сравнив с
раствором в контрольной пробирке.
Результаты внесите в таблицу 7.
.
Четвертую пробирку с раствором сохраните
для сравнения. Растворы во всех пробирках
размешайте энергичным встряхиванием
и отметьте изменение интенсивности
окраски в каждом случае, сравнив с
раствором в контрольной пробирке.
Результаты внесите в таблицу 7.
Таблица 7
Результаты опыта
|
№ пробирки |
Что добавлено |
Изменение интенсивности окраски |
Направление смещения равновесия |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
Напишите выражение константы равновесия данного обратимого процесса. Сделайте вывод: в каком направлении смещается равновесие при увеличении концентрации исходных веществ, продуктов реакции? Согласуются ли полученные результаты с принципом Ле-Шателье?
Опыт 5. Влияние температуры на химическое равновесие.
В
пробирку налить 1 каплю концентрированного
раствора
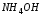 ,
30 капель воды и 1 каплю индикатора –
фенолфталеина. Обратить внимание на
изменение окраски раствора при его
нагревании на спиртовке и последующем
охлаждении под струей водопроводной
воды.
,
30 капель воды и 1 каплю индикатора –
фенолфталеина. Обратить внимание на
изменение окраски раствора при его
нагревании на спиртовке и последующем
охлаждении под струей водопроводной
воды.
Дать
объяснение наблюдаемым явлениям, исходя
из принципа Ле-Шателье, уесть, что
гидроксид аммония
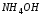 -
слабое основание, которое в водном
растворе диссоциирует:
-
слабое основание, которое в водном
растворе диссоциирует: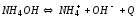
Количество
гидроксид-ионов (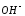 )
в растворе зависит от температуры. С
повышением температуры равновесие
смещается в сторону обратной реакции,
образования
)
в растворе зависит от температуры. С
повышением температуры равновесие
смещается в сторону обратной реакции,
образования и уменьшения концентрации гидроксид-ионов
(
и уменьшения концентрации гидроксид-ионов
(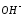 ).
).
ЛАБОРАТОРНАЯ РАБОТА № 6

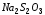 ,
капли
,
капли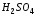 ,
капли
,
капли
 ,
капли
,
капли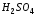 ,
капли
,
капли