
- •Для студентов фармацевтического факультета
- •Введение
- •Требования техники безопасности при работе в химической лаборатории
- •Меры оказания первой помощи при несчастных случаях
- •Методические рекомендации по выполнению и оформлению лабораторных работ
- •Отчет должен содержать следующие сведения:
- •Свойства основных классов неорганических соединений.
- •Определение молекулярной массы эквивалента металла.
- •Приготовление раствора заданной концентрации.
- •Определение теплового эффекта реакции нейтрализации.
- •Кинетика химических реакций, качественные опыты по химическому равновесию.
- •Гетерогенные равновесия и процессы. Произведение растворимости (пр), условия образования и растворения осадков.
- •Гидролиз. Смещение равновесия в реакциях гидролиза.
- •Учебно-исследовательский комплекс (уирс)
- •Окислительно-восстановительные реакции (овр)
- •Получение, состав и свойства комплексных соединений
- •Водород, вода, пероксид водорода.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Свойства элементов Iв группы: Cu, Ag, Au.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Элементы Vа группы периодической системы и свойства их соединений. Азот и фосфор. Мышьяк, сурьма и висмут.
- •Учебно-исследовательский комплекс (уирс)
- •Элементы vIа группы периодической системы и свойства их соединений. Сера.
- •Элементы viIа группы периодической системы. Галогены и свойства их соединений.
- •Учебно-исследовательский комплекс (уирс)
- •Приложение 1 лабораторная техника
- •Образец оформления титульного листа
- •Литература
- •Содержание
Определение теплового эффекта реакции нейтрализации.
Значение темы: энергетика химических реакций – это основа многих процессов. Эти знания необходимы для понимания биоэнергетики живых систем, для определения возможности или невозможности осуществления химических процессов и выбора оптимальных условий их протекания.
Цель: выполнить калориметрические измерения и термохимические расчеты.
Задание. Определить теплоту нейтрализации сильной кислоты сильным основанием и рассчитать энергию Гиббса реакции.
Согласно теории электролитической диссоциации реакция нейтрализации будет протекать по уравнению:
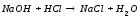
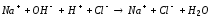
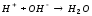
Для проведения реакции используют калориметрическую установку (рис.4) 6
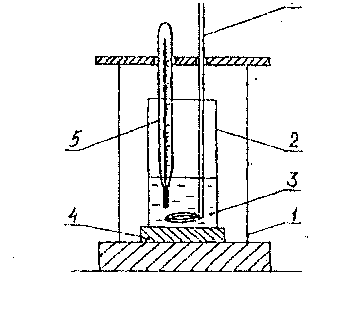
Рис. 4. Калориметрическая установка: 1 - внешний изолирующий сосуд; 2 – калориметрический стакан; 3 – реакционная смесь; 4 – подставка; 5 – термометр; 6 - мешалка
Методика определения:
Отмерить цилиндром 25 мл 1М раствора кислоты и внести в калориметрический стакан. Калориметрический стакан должен быть взвешен с точностью 00,00 г - mстак.
Измерить температуру раствора с точностью до 0,010 С.
Отмерить цилиндром 25 мл 1М раствора щелочи.
Влить щелочь в калориметрический стакан и отмерить максимальную температуру, которую покажет термометр после слива растворов. Данные опыта занести в табл. 3.
Таблица 3
Результаты опыта
|
mстак., кг |
Суммарный объем жидкости в стакане V, мл |
Температура t,0С | |
|
начальная |
конечная | ||
|
|
|
|
|
По полученным данным определить:
Разницу температур:
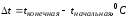
Массу жидкости в калориметрическом стакане:

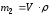 ,
кг (
,
кг (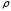 =
1 г/мл).
=
1 г/мл).Теплоемкость системы:
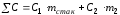 ,
Дж/кг
,
Дж/кг
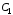 =
0,75·103
Дж/кг·К – удельная теплоемкость стекла;
=
0,75·103
Дж/кг·К – удельная теплоемкость стекла;
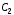 =
4,18·103
Дж/кг·К – удельная теплоемкость жидкости.
=
4,18·103
Дж/кг·К – удельная теплоемкость жидкости.
Количество теплоты выделившейся при реакции:
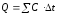 , Дж
, ДжЧисло молей воды, учитывая, что из 1 моль щелочи получается 1 моль воды, а Скислоты= Сщелочи = 1 моль/л:
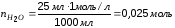
Практическое изменение энтальпии реакции нейтрализации:
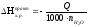 ,
кДж/моль
,
кДж/моль
Рассчитать
теоретическое изменение энтальпии (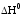 )реакции нейтрализации,
пользуясь формулой следствия из закона
Гесса и данными табл.4.
)реакции нейтрализации,
пользуясь формулой следствия из закона
Гесса и данными табл.4.
Рассчитать
теоретическое изменение энтропии (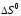 )реакции нейтрализации,
пользуясь формулой следствия из закона
Гесса и данными табл.4.
)реакции нейтрализации,
пользуясь формулой следствия из закона
Гесса и данными табл.4.
Таблица 4
Значение термодинамических функций
|
Формула соединения (иона) |
|
|
|
Н+(р) Н2О(ж) ОН-(р) |
0 -285,8 -230,2 |
0 70,1 -10,8 |
Рассчитать изменение энергии Гиббса реакции нейтрализации:
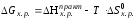 ,
,
где Т – начальная температура, К.
Рассчитать относительную ошибку опыта:
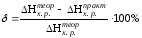
Сделать
вывод о соответствии найденной величины
и знака
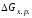 самопроизвольному течению проделанной
реакции нейтрализации.
самопроизвольному течению проделанной
реакции нейтрализации.
ЛАБОРАТОРНАЯ РАБОТА № 5

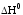 ,
кДж/моль
,
кДж/моль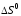 ,
Дж/моль·К
,
Дж/моль·К