
- •Федеральное агентство морского и речного транспорта
- •Предисловие
- •Лекция 1 Элементы геометрической оптики.
- •Основные законы геометрической оптики.
- •Тонкие линзы. Изображение предметов с помощью собирающей линзы.
- •Лекция 2 Волновая оптика
- •Интерференция света.
- •Получение когерентных источников. Оптическая разность хода.
- •Расчет интерференции в опыте Юнга.
- •Лекция 3. Интерференция света
- •Интерференция в тонких пленках
- •2. Кольца Ньютона
- •3. Применение интерференции
- •Лекция 4. Дифракция света
- •Принцип Гюйгенса – Френеля.
- •Дифракция Френеля на круглом отверстии.
- •Дифракция Френеля на небольшом диске.
- •Лекция 5 Дифракция Фраунгофера
- •Дифракция от одной прямоугольной щели
- •Дифракционная решетка
- •Голография
- •Лекция 6 Поляризация света
- •Естественный и поляризованный свет
- •Поляризация света при отражении. Закон Брюстера.
- •Явление двойного лучепреломления и его особенности. Дихроизм.
- •Природа двойного лучепреломления.
- •Применение поляризованного света.
- •Лекция 7 Распространение света в веществе
- •Дисперсия света.
- •Поглощение света.
- •Рассеяние света.
- •Лекция 8 Тепловое излучение
- •Характеристики теплового излучения.
- •2. Поглощательная и отражательная способности тел.
- •3. 3Аконы теплового излучения.
- •4. Оптическая пирометрия
- •Лекция 9 Фотоэффект
- •Законы внешнего фотоэффекта
- •Уравнение Эйнштейна для фотоэффекта
- •Фотон и его свойства
- •Эффект Комптона
- •Люминесценция, фотолюминесценция и ее основные закономерности
- •Физические принципы устройства приборов ночного видения
- •Лекция 10 Теория атома водорода по Бору
- •Линейчатый спектр атома водорода
- •Модели атома Томсона и Резерфорда
- •Постулаты Бора
- •Спектр атома водорода по Бору
- •Лекция 11 Элементы квантовой механики
- •Корпускулярно-волновой дуализм свойств вещества. Гипотеза де Бройля.
- •Природа волн де Бройля
- •Соотношение неопределенностей Гейзенберга
- •Уравнение Шредингера. Волновая функция.
- •Физический смысл волновой функции
- •Лекция 12 Атом водорода в квантовой механике
- •Уравнение Шредингера для атома водорода
- •Квантовые числа.
- •Спин электрона.
- •Лекция 13 Оптические квантовые генераторы
- •Физические основы работы окг. Спонтанное и индуцированное излучение.
- •Термодинамическое равновесие. Нормальная населенность уровней.
- •Неравновесное состояние. Инверсия населенности уровней.
- •Рубиновый лазер
- •Газовый лазер
- •Лекция 14 Атомное ядро и основы ядерной энергетики
- •Состав и характеристики ядра
- •Энергия связи и дефект масс
- •Ядерные силы
- •Радиоактивность
- •Лекция 15
- •Реакция деления тяжелых ядер
- •Цепная реакция деления
- •Управляемая цепная реакция. Ядерные реакторы.
- •Термоядерная реакция синтеза легких ядер
- •Принципиальная схема устройства термоядерной бомбы
- •Проблемы управления термоядерной реакцией
- •Лекция 16 Элементарные частицы
- •Космические лучи
- •Элементарные частицы
- •Основные свойства.
- •Характеристики элементарных частиц.
- •Мюоны и их свойства.
- •Мезоны и их свойства.
- •Частицы и античастицы
- •Классификация элементарных частиц. Кварки.
Модели атома Томсона и Резерфорда
Для объяснения спектров атомов были предложены различные модели атомов.
В 1903 году английский физик Томсон
предложил модель атома, представляющую
собой непрерывно заряженный положительный
шар радиусом
![]() м,
в которую вкраплены электроны. Суммарный
отрицательный заряд, равен положительному
заряду шара и поэтому атом нейтрален.
м,
в которую вкраплены электроны. Суммарный
отрицательный заряд, равен положительному
заряду шара и поэтому атом нейтрален.
Однако, в 1911 году английский физик
Резерфорд своими опытами по рассеянию
![]() -
частиц опровергает утверждение Томсона
о непрерывном распределении положительного
заряда внутри шара. В своем опыте
Резерфорд обнаружил, что при прохождении
-
частиц опровергает утверждение Томсона
о непрерывном распределении положительного
заряда внутри шара. В своем опыте
Резерфорд обнаружил, что при прохождении![]() -
частиц через золотую фольгу толщиной
1мкм основная их часть испытывает
незначительные отклонения, но некоторые
-
частиц через золотую фольгу толщиной
1мкм основная их часть испытывает
незначительные отклонения, но некоторые![]() -
частицы (примерно одна из 20000) отклоняются
на углы равные
-
частицы (примерно одна из 20000) отклоняются
на углы равные![]() .
На основании этих исследований Резерфорд
предложил планетарную модель атома.
Согласно этой модели в центре атома
находится положительно заряженное
ядро, имеющие размеры
.
На основании этих исследований Резерфорд
предложил планетарную модель атома.
Согласно этой модели в центре атома
находится положительно заряженное
ядро, имеющие размеры![]() м.
Вокруг ядра по орбитам вращаются
электроны. Число электронов равно заряду
ядра.
м.
Вокруг ядра по орбитам вращаются
электроны. Число электронов равно заряду
ядра.
Столкновение с ядром
![]() -
частиц происходят крайне редко из-за
его малых размеров. Но планетарная
модель оказалась в противоречии с
законами классической механики и
электродинамики:
-
частиц происходят крайне редко из-за
его малых размеров. Но планетарная
модель оказалась в противоречии с
законами классической механики и
электродинамики:
Вращающийся электрон имеет заряд, движется он ускоренно и поэтому должен излучать. Излучая энергию, он приближается к ядру по спирали. Расчеты показывают, что он упадет на ядро через
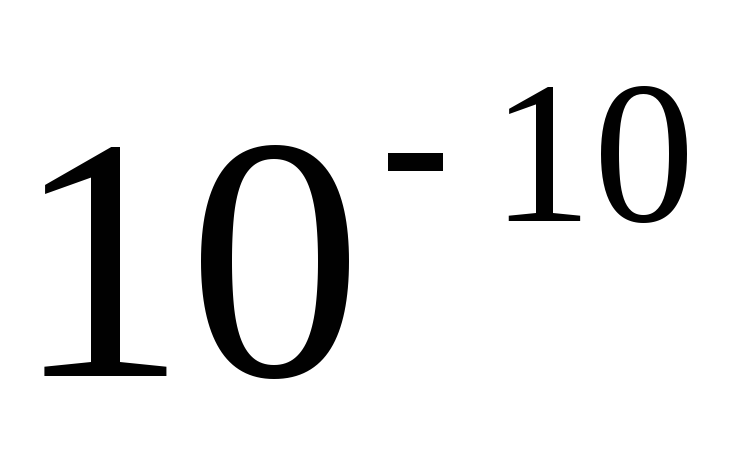 с.
То есть атом Резерфорда не устойчив.
с.
То есть атом Резерфорда не устойчив.По мере приближения к ядру радиус траектории электрона убывает. Момент инерции его
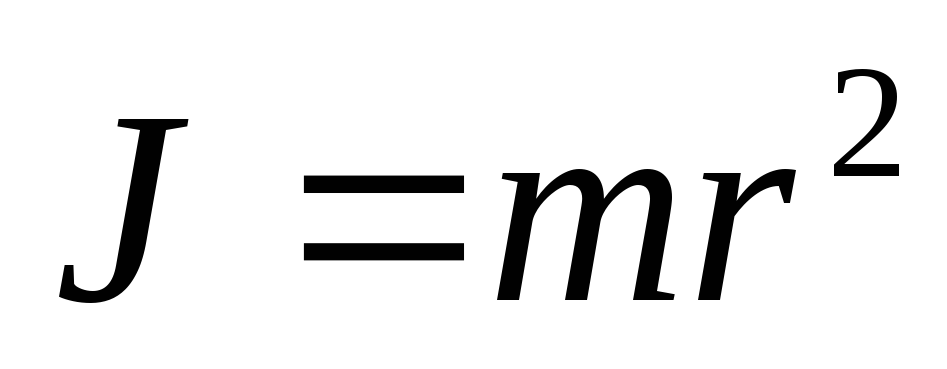 убывает. Но по закону сохранения момента
импульса
убывает. Но по закону сохранения момента
импульса .
Так как
.
Так как непрерывно убывает,
непрерывно убывает, должно расти. Поэтому спектр излучения
должен быть сплошным, а не линейчатым.
должно расти. Поэтому спектр излучения
должен быть сплошным, а не линейчатым.
Таким образом, планетарная модель атома не могла объяснить ни устойчивость атома, ни характер спектра.
Постулаты Бора
Для того, чтобы объяснить линейчатые спектры атомов датский физик Нильс Бор в 1913 году вводит два постулата.
Первый постулат Бора (постулат стационарных
состояний): в атоме существуют стационарные
(не изменяющиеся во времени) состояния,
в которых он не излучает энергию. Энергии
этих состояний образуют дискретный
ряд:
![]() ,
,![]() ,
…,
,
…,![]() .
Стационарным состояниям атома
соответствуют орбиты, по которым движутся
электроны. Хотя электроны движутся по
стационарным орбитам с ускорением, они
не излучают и не поглощают энергию.
.
Стационарным состояниям атома
соответствуют орбиты, по которым движутся
электроны. Хотя электроны движутся по
стационарным орбитам с ускорением, они
не излучают и не поглощают энергию.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные значения момента импульса, удовлетворяющие условию:
![]() ,
,![]() 1,
2, 3,…,
1,
2, 3,…,
где
![]() - масса электрона,
- масса электрона,![]() - его скорость по
- его скорость по![]() -ой
орбите радиуса
-ой
орбите радиуса![]() ,
,![]() .
.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) квант с энергией:
![]() .
.
При
![]() происходит излучение фотона (переход
из состояния с большей энергией в
состояние с меньшей энергией), при
происходит излучение фотона (переход
из состояния с большей энергией в
состояние с меньшей энергией), при![]() - поглощение фотона (переход атома в
состояние с большей энергией).
- поглощение фотона (переход атома в
состояние с большей энергией).
Набор возможных дискретных частот
![]() определяет линейчатый спектр атома.
определяет линейчатый спектр атома.
Спектр атома водорода по Бору
Постулаты, выдвинутые Бором, позволили
рассчитать спектр атома водорода и
водородоподобных систем, состоящих из
ядра с зарядом
![]() и одного электрона (ионы
и одного электрона (ионы![]() ,
,![]() ),
а также теоретически вычислить постоянную
Ридберга.
),
а также теоретически вычислить постоянную
Ридберга.
Рассмотрим движение электрона в водородоподобной системе по стационарным круговым орбитам.
Решая совместно уравнение
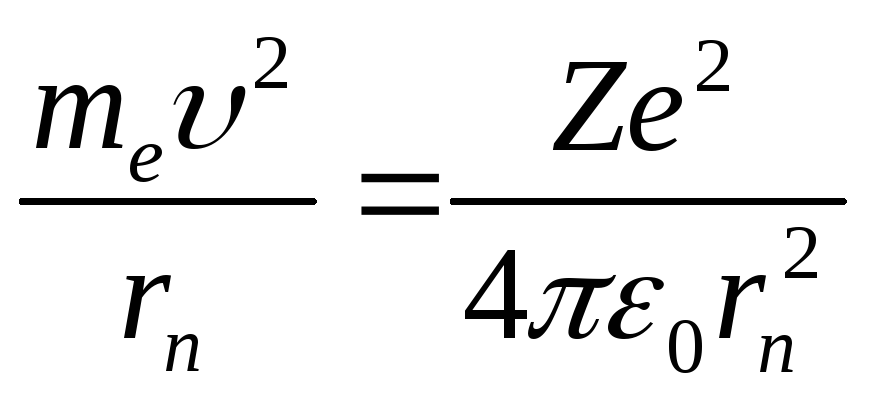 ,
вытекающие из планетарной модели
Резерфорда, и уравнение для момента
импульса стационарных орбит
,
вытекающие из планетарной модели
Резерфорда, и уравнение для момента
импульса стационарных орбит![]() ,
получим выражение для радиуса
,
получим выражение для радиуса![]() -ой
стационарной орбиты. Помножим правую
и левую часть первого уравнения на
-ой
стационарной орбиты. Помножим правую
и левую часть первого уравнения на![]() :
:
![]() .
.
Возведем обе части второго уравнения
![]() ,
в квадрат:
,
в квадрат:
![]() .
.
Из этих уравнений можно выразить значение радиуса:
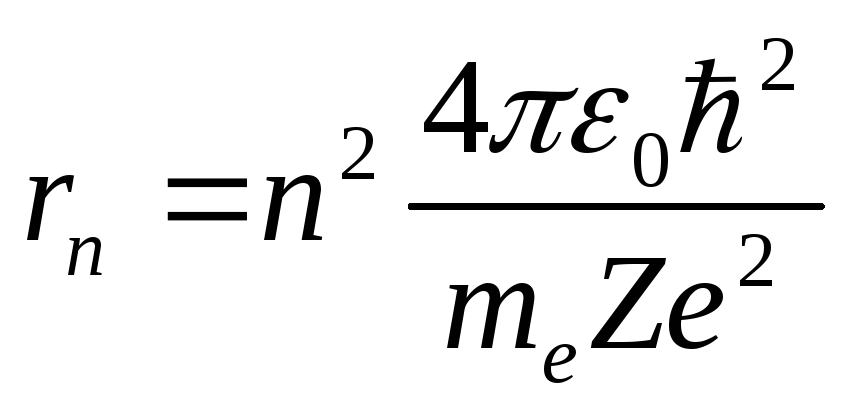 ,
,![]() 1,
2, 3, …
1,
2, 3, …
Из этого выражения следует, что радиусы
орбит растут пропорционально квадрату
целых чисел. Для водорода (![]() )
радиус первой электронной орбиты (
)
радиус первой электронной орбиты (![]() )
равен:
)
равен:
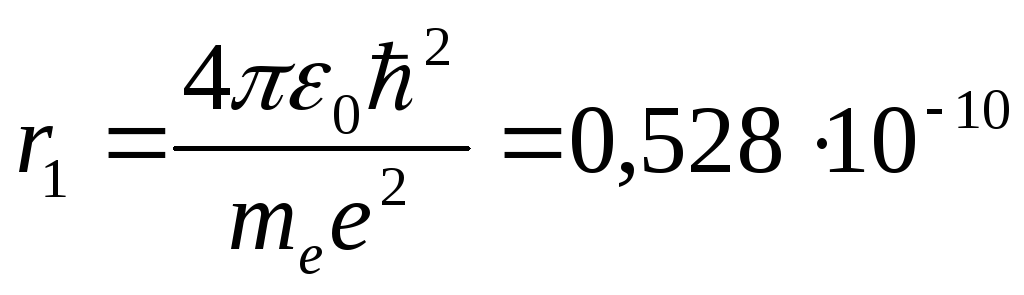 м,
м,
что соответствует размерам атома, рассчитанным из молекулярно-кинетической теории газов.
Теперь подсчитаем полную энергию
электронов, находящихся на стационарных
орбитах. Полная энергия электрона
складывается из его кинетической энергии
![]() и потенциальной энергии в электростатическом
поле ядра
и потенциальной энергии в электростатическом
поле ядра![]() :
:
![]() .
.
Учитывая уравнение
 и выражение для радиуса
и выражение для радиуса![]() -ой
орбиты
-ой
орбиты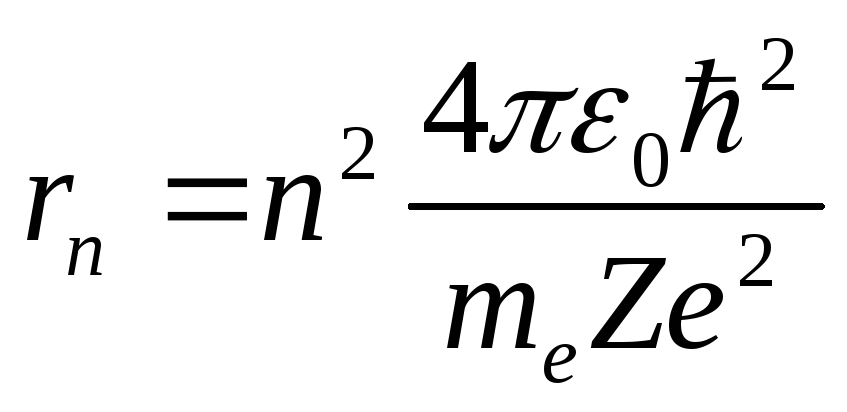 ,
получим выражение для полной энергии
в виде:
,
получим выражение для полной энергии
в виде: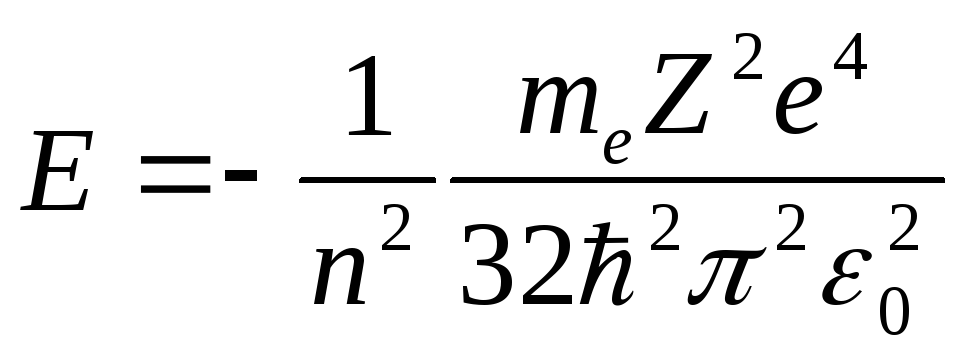 .
.
Учитывая, что
![]() ,
окончательно получим:
,
окончательно получим:
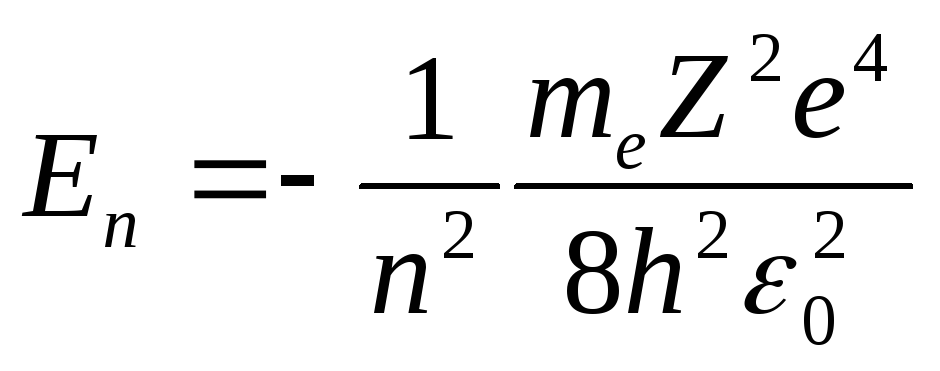 .
.
Энергетические состояния атома образуют
последовательность энергетических
уровней, меняющихся в зависимости от
значения
![]() .
Число
.
Число![]() ,
определяющее энергетические уровни
атома, называется главным квантовым
числом. Состояние с
,
определяющее энергетические уровни
атома, называется главным квантовым
числом. Состояние с![]() называется основным, состояния с
называется основным, состояния с![]() - возбужденными. Придавая
- возбужденными. Придавая![]() различные целочисленные значения,
получим для атома водорода (
различные целочисленные значения,
получим для атома водорода (![]() )
возможные уровни энергии.
)
возможные уровни энергии.
Энергия атома водорода с увеличением
![]() возрастает (уменьшается ее отрицательная
величина) и энергетические уровни
сближаются с границе, соответствующей
значению
возрастает (уменьшается ее отрицательная
величина) и энергетические уровни
сближаются с границе, соответствующей
значению![]() .
Минимальная энергия атома водорода
равна
.
Минимальная энергия атома водорода
равна![]() эВ при
эВ при![]() ,
максимальная энергия равна нулю при
,
максимальная энергия равна нулю при![]() .
Значение
.
Значение![]() соответствует ионизации атома (отрыву
от него электрона).
соответствует ионизации атома (отрыву
от него электрона).
Согласно второму постулату Бора при
переходе атома водорода из стационарного
состояния
![]() в состояние с меньшей энергией
в состояние с меньшей энергией![]() испускается квант с энергией:
испускается квант с энергией:
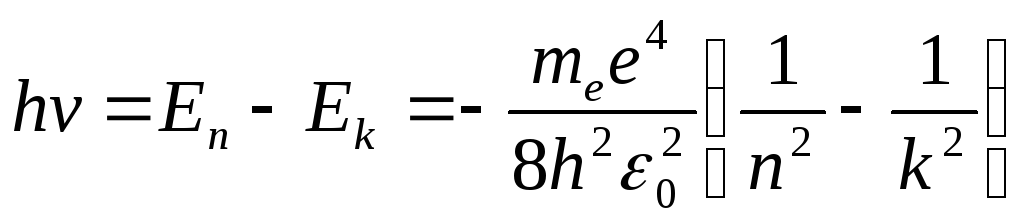 .
.
Откуда частота излучения равна:
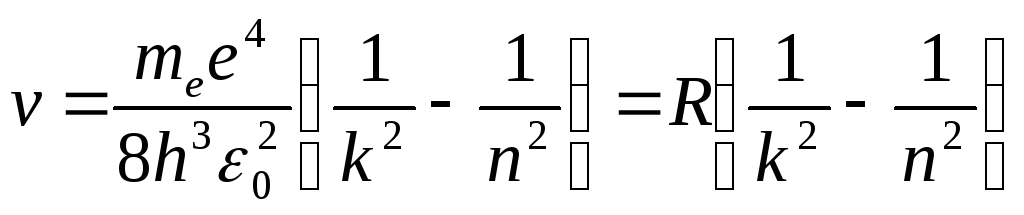 ,
,
где
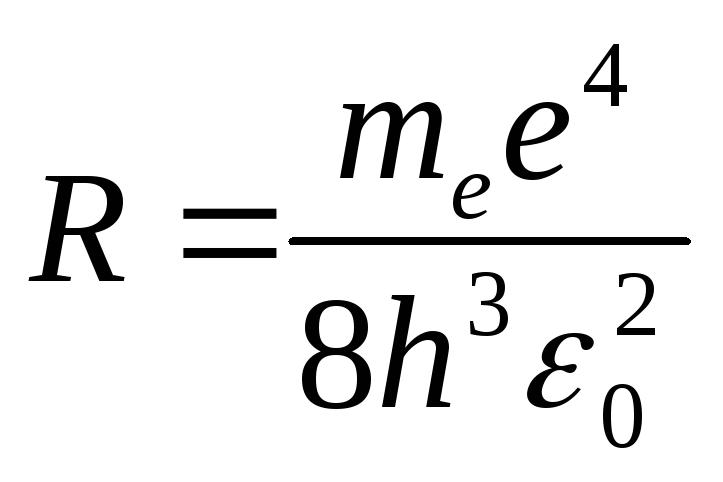 .
.
Величина
![]() ,
рассчитанная по этой формуле, совпала
с экспериментальным значением постоянной
Ридберга в эмпирической формуле для
атома водорода.
,
рассчитанная по этой формуле, совпала
с экспериментальным значением постоянной
Ридберга в эмпирической формуле для
атома водорода.
Подставляя
![]() и
и![]() 2,
3, 4,… получаем серию Лаймана (переходы
с возбужденных уровней
2,
3, 4,… получаем серию Лаймана (переходы
с возбужденных уровней![]() на основной
на основной![]() ).
При подстановке
).
При подстановке![]() 2,
3, 4, 5, 6 и соответствующих им значений
2,
3, 4, 5, 6 и соответствующих им значений![]() получим серии Бальмера, Пашена, Брэкета,
Пфунда и Хэмфри.
получим серии Бальмера, Пашена, Брэкета,
Пфунда и Хэмфри.
Спектр поглощения атома водорода является также линейчатым, но содержит только серию Лаймана. Так как свободные атомы водорода находятся в основном состоянии, то при сообщении атомам энергии извне могут наблюдаться лишь переходы из основного состояния в возбужденные.
Таким образом, теория Бора позволила вычислить частоты спектральных линий атома водорода и водородоподобных систем, но не могла объяснить их интенсивности и почему вероятность различных переходов разная. Теория Бора не смогла объяснить спектр атома гелия, содержащего два электрона в поле ядра. Теория Бора содержит внутренние противоречия: она основывается на классической физике, но вводит квантовые постулаты. Теория Бора является переходной от классической физики к квантовой.
