
- •Тема 5. Химическая термодинамика.
- •1.Что изучает химическая термодинамика?
- •2. Дайте определение понятию «химическая система».
- •3. Перечислите типы химических систем, дайте их характеристику.
- •4.Какие типы термодинамических процессов могут протекать в химических системах? Дайте их характеристику.
- •5.Какие параметры влияют на термодинамическое состояние системы?
- •6.Сформулируйте 1 закон термодинамики. Дайте определение понятиям «теплота», «работа», «внутренняя энергия».
- •7.Какие виды работ чаще всего совершаются в химических системах?
- •8.Дайте определение энтальпии. В чем она измеряется?
- •9.Что такое тепловой эффект реакции? Дайте определение экзо- и эндотермической реакции.
- •10.Что такое термохимическое уравнение? Перечислите особенности записи термохимических уравнений.
- •11.Сформулируйте закон Гесса и следствие из закона Гесса.
- •12.Что такое стандартная энтальпия образования вещества?
- •13.Что такое энтропия? в чем она измеряется?
- •14.Сформулируйте 2 и 3 законы термодинамики.
- •15.Как рассчитывается изменение энтропии в процессе химической реакции?
- •16.Дайте определение энергии Гиббса. Для чего используется эта величина?
- •17.Какими факторами определяется самопроизвольность протекания реакции?
- •Тема 6. Химическая кинетика и химическое равновесие.
- •Тема 7. Фазовые равновесия
- •Тема 8. Электрохимия
15.Как рассчитывается изменение энтропии в процессе химической реакции?
-------------------------------------------------------------------------
16.Дайте определение энергии Гиббса. Для чего используется эта величина?
Изменение энергии Гиббса в системе при протекании химической
Реакции ∆Gназывают энергией Гиббса химической реакции:
Энергию Гиббса можно понимать как полную химическую энергию системы
ее можно использовать в расчете равновесия
17.Какими факторами определяется самопроизвольность протекания реакции?
– стремлением к образованию прочных связей между частицами, более сложных веществ, сопровождающимся уменьшением внутренней энергии системы. Эта тенденция в изобарно-изотермических условиях характеризуется энтальпийным (энергетическим) фактором
– стремлением к разъединению частиц, к беспорядку, характеризуемым возрастанием энтропии.
Тема 6. Химическая кинетика и химическое равновесие.
Что изучает химическая кинетика?
Кинетика химическая (от греч. kinetikos-движущий), раздел физ. химии, изучающий химическую реакцию как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления. Кинетика химическая устанавливает временные закономерности протекания хим. реакций, связь между скоростью реакции и условиями ее проведения, выявляет факторы, влияющие на скорость и направление хим. реакций.
Что такое гомогенные и гетерогенные реакции?
Гомогенные реакции протекают в однородной среде (например, в газовой фазе
или жидком растворе). Гетерогенные реакции протекают в неоднородной среде —
между веществами, которые находятся в разных фазах (твердой и жидкой, газовой
и жидкой, двумя твердыми и т. д.). Таким образом, гомогенные реакции происходят
равномерно во всем объеме, заполненном реагентами, гетерогенные — только на
некоторых граничных поверхностях, на границе раздела фаз.
Дайте определение скорости химической реакции.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенной реакции).
От каких факторов зависит скорость химической реакции?
Скорость химических реакций зависит от природы реагирующих веществ, их
концентраций и внешних условий, определяемых температурой, агрегатным состо-
янием или степенью измельченности (для гетерогенных систем), наличием катали-
заторов; воздействия электрической, механической энергии, различных излучений.
Как зависит скорость химической реакции от концентраций реагентов?
чем больше концентрация, тем, как правило, выше скорость реакции.
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Сформулируйте закон действующих масс для скорости химической реакции. Приведите его математическое выражение.
при постоянной температуре скорость химической реакции прямо пропорциональ-на произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
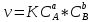 ;
;
Что такое константа скорости реакции? От чего она зависит?
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Как зависит скорость химической реакции от температуры?
Чем выше температура - тем быстрее реакция. Течение некоторых реакций вообще не возможно ниже определенного температурного порога.
Сформулируйте правило Вант-Гоффа, приведите его математическое выражение.
правило Вант-Гоффа: скорость большинства реакций при повышении температуры на каждые 10 градусов увеличивается в2÷4раза.
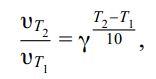
Что показывает температурный коэффициент скорости реакции?
Температурным коэффициентом называется число, показывающее,
во сколько раз увеличивается скорость реакции (а, следовательно, и констан-та скорости реакции) при увеличении температуры на каждые 100С.
Что такое катализатор?
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции
Дайте определение энергии активации реакции. От чего она зависит?
энергия активации— это дополнительная энергия, которой должны обладать частицы для ослабления химических связей в исходных веществах и для преодоления сил от-талкивания между электронными оболочками при сближении молекул и атомов взаимодействующих веществ.
Зависит она от того, насколько активны чатицы вещества, если значение активности достоточно большое, то увеличивается энтропия - мера беспорядка в системе... частицы начинают более хаотично двигаться и чаще сталкиваются между собой, следовательно данное взаимодействие и есть начало химической реакции. Значение энергии активации достаточно большое для молекул и очень маленькое для ионов в растворе, потому при сливании двух растворов, признаки реакции появляются мгновенно( выделяется газ, выпадает осадок и т.д.). А катализаторы увеличивают скорость хим реакции как раз из за того, что они снижают энергию активации.
Каков механизм действия катализатора?
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ.
Приведите уравнение Аррениуса, поясните какие величины входят в это выражение.
Аррениуса Уравнение - выражает зависимость константы скорости химическойреакции k от температуры
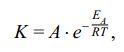
где A— предэкспоненциальный множитель;Ea— энергия активации реакции;T—
температура;R— универсальная газовая постоянная.
Дайте определение химического равновесия.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.

Что такое константа равновесия? Напишите математическое выражение для константы равновесия, поясните, какие величины туда входят.
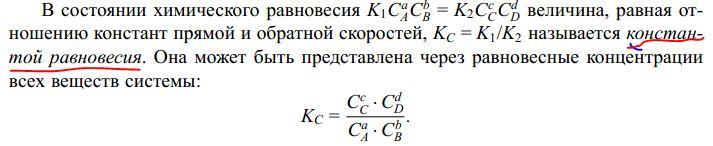
Сформулируйте принцип Ле-Шателье.
принцип Ле Шателье: если на систему, находящуюся в равно-весии, оказывать внешнее воздействие, то равновесие смещается
в том направлении, которое ослабляет эффект внешнего воздействия.
Какие факторы влияют на смещение химического равновесия в системе и каким образом?

