
ТОХТ
.pdf
Given
Пример 5. Целевой продукт В получают в РИС при последовательных реакции второго порядка в изотермических условиях.
Исходные данные:
Решение
Задачу решаем в программе Mathcad.
Given
131
∫
Пример 6. Целевой продукт В получают в РИС при последовательных реакции второго порядка
в изотермических условиях c рециклом непревращенного реагента А по схеме, представленной на рис. 10.2.
Исходные данные:
Рис. 10.2. Схема потоков при рециркуляции непревращенного реагента А, если целевой продукт В является промежуточным продуктом последовательной реакции: 1 – реакционный узел; 2 – блок отделения непревращенного реагента; 3 – блок рециркуляции
Решение
Задачу решаем в программе Mathcad.
132

Given
∫
Пример 7. Целевой продукт В получают при последовательных реакции второго порядка в изотермических условиях в РИВ объемом V=1 м3:
c рециклом непревращенного реагента А по |
схеме, представленной на |
|
рис. 10.2. |
|
|
Из экспериментальных данных известно, что |
k1= 2 ч-1 и k2/k1 = 0,5. Опто- |
|
вая цена реагента равна SА=20 руб·моль-1; СA,0=2 моль·л-1; затраты на |
выде- |
|
ление и рециркуляцию непревращенного реагента А Srec= 3руб·моль-1; |
SR,0=4 |
|
pyб; SR,V= 2руб ·м-3·ч-1. ∑
Найти оптимальную степень конверсии в условиях рециркуляции непревращенного реагента А, если: а) побочный продукт является бесполезным отходом; б) побочный продукт утилизируется и его товарная цена составят 7
руб./кмоль. |
|
Решение |
|
Из рис. 10.2 находим, что без учета потерь |
, откуда |
133 |
|
В соответствии с кинетикой процесса получим для РИВ
Интегральная селективность по промежуточному продукту В для последовательных реакций первого порядка в РИВ
|
|
|
[ |
] |
|
( )
Часовой экономический баланс по переменным затратам в общем виде будет равен:
∑
И после подстановок т:
|
|
|
|
|
|
|
|
|
∑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
∑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Подставляя выражение |
|
|
|
|
|
|
|
|
|
, получим уравнение, связанное со |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
всеми параметрами процесса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
∑ |
|
|
|
|
|
|
|
|
|
( |
|
|
|
|
)[ |
|
|
] |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
По нему при разной степени ХА находим каждое слагаемое: |
|
|
|
|
|||||||||||||||||||||||||||||||||
ХА |
|
0,1 |
|
|
0,2 |
|
|
0,3 |
|
0,4 |
|
0,5 |
|
0,6 |
|
|
0,7 |
|||||||||||||||||||||||
ФВ |
|
0,97 |
|
|
0,94 |
|
|
0,91 |
|
0,87 |
|
0,83 |
|
0,78 |
|
|
0,71 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
20,6 |
|
|
21,3 |
|
|
|
22,0 |
|
23,0 |
|
24,1 |
|
25,7 |
|
|
|
28,2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
0,22 |
|
|
0,45 |
|
|
|
0,69 |
|
1,05 |
|
1,44 |
|
1,98 |
|
|
|
2,86 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
1,9 |
|
|
2,0 |
|
|
|
2,2 |
|
2,6 |
|
2,9 |
|
3,4 |
|
|
|
4,2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
27,8 |
|
|
12,8 |
|
|
|
7,7 |
|
5,2 |
|
3,6 |
|
2,6 |
|
|
|
1,8 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
SB |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
без утилиза- |
|
54,3 |
|
|
40,1 |
|
|
|
36,9 |
|
34,8 |
|
34,6 |
|
35,7 |
|
|
|
38,2 |
|||||||||||||||||||||
ции |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
с утилизацией |
|
54,08 |
|
|
39,65 |
|
|
|
36,21 |
|
33,75 |
|
33,16 |
33,72 |
|
|
35,34 |
|||||||||||||||||||||||
Графическое изображение полученных данных представлено на рис. 10.3. Материальные затраты (кривая 1) растут с повышением степени конверсии в связи со снижением селективности, уменьшаясь при утилизации побочных веществ (кривая 1-1) . Энергетические затраты (кривая 2) увеличиваются при снижении степени конверсии из-за роста рециркулирующего потока, а амортизационные отчисления (кривая 3) растут с повышением степени конверсии в результате уменьшения удельной производительности установки.
134
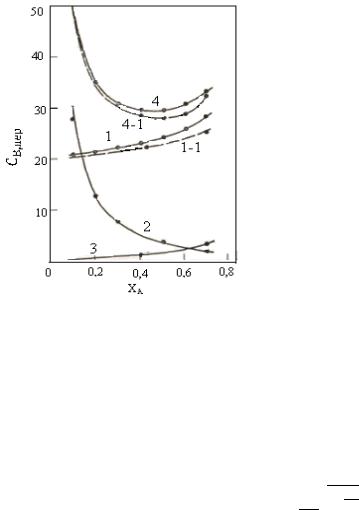
Рис. 10.3. Зависимость переменных слагаемых себестоимости от степени конверсии:
1 – материальные затраты без утилизации побочных продуктов; 1-1 - то же с утилизацией последнего; 2 - энергетические расходы, связанные с отделением и рециркуляцией непревращенного реагента; 3- амортизационные отчисления; 4 – сумма переменных затрат в себестоимости продукции без утилизации побочного продукта, 4-1- то же с утилизацией последнего.
Таким образом, сумма переменных слагаемых себестоимости имеет минимум при определенных степенях конверсии (в рассмотренном примере при ХА= 0,45 без утилизации побочного продукта и при ХА=0,50 С утилизацией).
Оптимальная степень конверсии |
увеличивается, если |
рецикл непревращен- |
ного реагента отсутствует. В этом случае слагаемое |
себестоимости SА/Фв |
|
превращается в SА/ХА·ФВ И минимум себестоимости находится вблизи степе- |
||
ни конверсии, соответствующей |
максимальном выходу целевого продукта |
|
ηВ = ХА·ФВ, В данном примере при ХА=0,75. |
|
|
( )
В приведенных в этом разделе примерах оптимизировался только один параметр при постоянстве остальных. В действительности необходимо отыскивать глобальный минимум себестоимости, или удельных приведенных затрат, либо максимум прибыли, являющийся функцией множества параметров процесса. Такая многопараметрическая задача оптимизации выходит за рамки данного курса.
Вопросы для самопроверки
1.Назовите затраты, из которых складывается себестоимость продукции.
2.Расскажите об оптимизации производства по экономическим критериям.
3.Расскажите об оптимизации реакционного узла для проведения простых реакций без рецикла непревращенного реагента.
4.Расскажите об оптимизации реакционного узла для проведения сложных реакций без рецикла непревращенного реагента.
5.Расскажите об оптимизации реакционного узла для проведения простых реакций с рецикла непревращенного реагента.
Контрольные задачи
Приведены в Сборнике задач по курсу «Теория химико-технологических процессов органического синтеза» - Инженерные расчеты в химической технологии (работа 6).
135

136
Тема 11. Нуклеофильные реакции
Нуклеофильные реакции имеют важное значение в промышленности основного органического и нефтехимического синтеза. К их числу относятся процессы замещения и расщепления галогенпроизводных, спиртов и эфиров сульфокислот (синтез спиртов, простых эфиров, меркаптанов, сульфидов, аминов, ненасыщенных веществ, α-окисей и других гетероциклических соединений), реакции присоединения (синтезы из α-окисей, альдольная конденсация, получение азотсодержащих производных альдегидов и кетонов, некоторые реакции присоединения по двойным и тройным связям), процессы этерификации и другие превращения кислот и их производных.
11.1. Нуклеофильное замещение 11.1.1. Механизмы нуклеофильного замещения
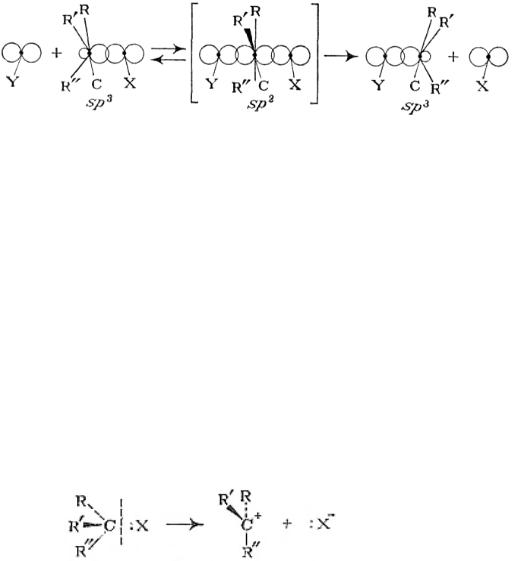
Некаталитическое нуклеофильное замещение может происходить в одну или две элементарные стадии. Одностадийный процесс представляет собой элементарную реакцию SN2-замещение, где индекс 2 указывает на бимолекулярность реакции (рис.11.1).
Рис. 11.1. Схема бимолекулярной реакции замещения SN2
Как видно схемы, из приведенной на рис. 11.1, нуклеофил своей неподеленной парой р-электронов атакует углеродный атом в молекуле RR'R"CX со стороны, противоположной замещаемой группе. При образовании активированного комплекса электроны σ-связей при атакуемом атоме углерода переходят из состояния sp3- в состояние sр2-гибридизации. В результате углеродный атом оказывается в одной плоскости с группами R, R' и R", а нуклеофил и замещаемая группа связываются с ним за счет его р-орбитали. Распад активированного комплекса в продукт RR'R"CY сопровождается обратным переходом углеродного атома в состояние sp3-гибридизации и обращением конфигурации исходного соединения, которое вызвано присоединением атома Y со стороны, противоположной разорвавшейся связи С‒X.
При двухстадийном нуклеофильном замещении разрыв связи С‒X и образование связи С‒Y происходят не одновременно. Первой элементарной реакцией является мономолекулярный гетеролитический разрыв связи С‒X с образованием карбкатиона (рис. 11.2):
Рис. 11.2. Схема образования карбкатиона
137

Заряженный углеродный атом карбкатиона находится в одной плоскости с тремя σ-связями С‒R и с равной вероятностью атакуется нуклеофилом как со стороны отщепившейся группы X, так и с противоположной. В результате последующей бимолекулярной реакции нуклеофила с карбкатионом (вторая стадия) образуется смесь двух продуктов замещения X на Y ‒ с сохранением и с обращением конфигурации (рис. 11.3):
50 % 50 %
Рис. 11.3. Схема взаимодействия карбкатиона с нуклеофилом
Первая стадия ‒ мономолекулярная реакция гетеролиза ‒ идет значительно медленнее и лимитирует скорость процесса. В связи с этим двухстадийный процесс нуклеофильного замещения принято обозначать символом SN1, где цифра 1 означает мономолекулярность определяющей стадии.
Механизмы SN1 и SN2 легко различить кинетически, если нуклеофил не является растворителем. Реакция SN2 является элементарной и всегда описывается кинетическим уравнением второго порядка:
[ ][ ]
Двухстадийная реакция SN1 в общем случае описывается более сложным кинетическим уравнением. При его выводе необходимо учитывать, что реакция образования карбкатиона обратимая:
|
k |
|
|
|
|
|
k |
|
R X |
1 |
R |
X |
; |
R |
Y |
2 |
R Y |
k- |
|
|||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
Применяя принцип стационарности Семенова-Боденштейна
[ ] [ ][ ] [ ][ ]
легко найти концентрацию карбкатиона и подставить ее в выражение для скорости накопления продукта, что дает:
[ ][ ] |
|
[ |
][ |
] |
|
|
|
|
|
|
|
[ |
] |
[ |
] |
|
|
|
|
||||
Из уравнения (11.2) |
следует, |
что скорость рассматриваемой реакции |
|||
должна уменьшаться по мере накопления аниона Х- или при добавлении его в реакционную массу. Этот эффект получил название эффекта общего иона.
Если анион Х– обладает слабой нуклеофильностью или если к действию реагента Y– добавляется реакция с растворителем HY, сопряженным основанием которого является нуклеофил (например, НО- в воде, RO- в спирте), чле-
ном |
[ |
] |
в знаменателе уравнения (11.2) можно пренебречь и после со- |
кращения |
[ |
] получим уравнение (11.3) |
|
|
[ |
|
] |
|
В этом |
случае k1 является истинной константой скорости гетеролиза по |
|
связи С‒X, и эта скорость, в отличие от скорости SN2 реакций, не зависит от концентрации нуклеофила. Такому же кинетическому уравнению соответствует
138
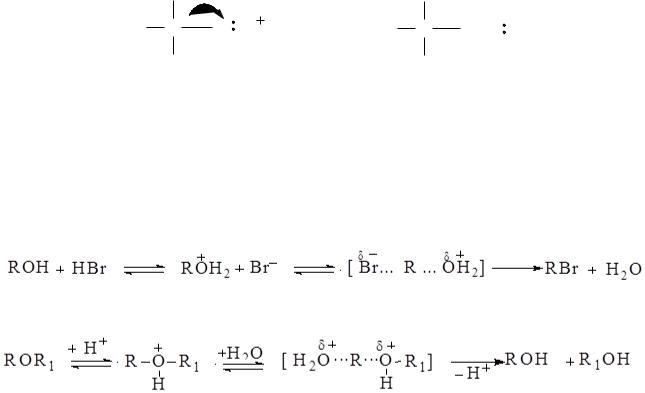
SN2 реакция, когда единственным нуклеофильным реагентом является сам растворитель, концентрация которого входит в выражение для константы скорости. В этом случае механизмы SN l и SN2 можно различить по активационным параметрам: для SN1 характерна положительная энтропия активации, для SN2 ‒ отрицательная. При SN l механизме из-за уменьшения упорядоченности системы при удлинении рвущихся связей и образовании карбкатиона энтропия возрастает. При SN2 механизме, наоборот, образование активированного комплекса из двух частиц или молекул приводит к возрастанию упорядоченности системы и следовательно к уменьшению энтропии по сравнению с исходным состоянием. Кроме того, для реакции с оптически активным соединением при SN l механизме происходит рацемизация, а при механизме SN2 ‒ обращение оптической активности.
Механизм рассматриваемых реакций нуклеофильного замещении является в действительности более сложным. В настоящее время общепринято, что разрыв связи С‒X существенно облегчается или вообще становится возможным лишь за счет взаимодействия замещаемой группы X с электрофилами. Образование донорно-акцепторной (а) или водородной (б) связи
C X E |
C X ... HA |
а |
б |
ведет к предварительной поляризации связи С‒X и облегчает ее последующий разрыв. Замещение некоторых групп (–ОН, –OR, –SH, –SR, –NH2,
–NHR, –NR2) вообще невозможно без сильного взаимодействия их с электрофилами. Например, замещение гидроксильной группы спирта при действии только бромид-аниона невозможно, но эту же реакцию легко осуществить в кислой среде. Предварительное протонирование гидроксильной группы поляризует связь С–О и делает возможным замещение этой группы анионом брома:
Сходным путем осуществляются превращения простых эфиров, меркаптанов и аминов, например:
Кроме сильных протонных кислот (НС1, H2SO4) катализаторами реакций нуклеофильного замещения являются кислоты Льюиса (Ag+, Hg2+, HgCl+, HgCl2, SnCl4, А1СЦ, SbCl5, Cu2Cl2, BF3). Их действие зависит от природы отщепляемой группы. Например, протонные кислоты сильно ускоряют замещение О‒, S‒ и N‒содержащих групп и мало влияют на скорость замещения галогенов, поскольку последние являются слабыми основаниями и плохо протежируются. Атомы галогенов дают, однако, прочные донорно-акцепторные комплексы с некоторыми кислотами Льюиса, и их образование облегчает разрыв связи С‒Hal при последующей реакции замещения. Так, хлористый аллил
139
медленно гидролизуется водой, но в присутствии однохлористой меди легко дает аллиловый спирт:
CH |
CH CH |
Cl : Cu Cl |
H O |
CH |
CH CH OH HCl |
Cu Cl |
2 |
|
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
При этом может произойти изменение механизма с SN2 в некаталитической реакции на SN1‒ в каталитической:
RCl |
Cu Cl |
R |
Cu Cl |
; |
R |
Y |
RY |
||
|
2 |
2 |
|
2 |
3 |
|
|
|
|
Ослабление С‒Х‒связи и уменьшение энергии переходного состояния в реакциях нуклеофильного замещения происходит и при образовании комплекса за счет водородной связи. Так, скорость метанолиза трифенилхлорметана описывается кинетическим уравнением третьего порядка:
[ ][ ]
Это согласуется с механизмом, согласно которому замещение хлора происходит только при условии его специфической электрофильной сольватации другой молекулой спирта:
(C H ) CCl |
CH OH |
(C H ) C |
Cl ... HOCH |
||
6 |
5 3 |
3 |
6 |
6 3 |
3 |
Образовавшийся комплекс дает далее продукт замещения:
|
|
|
|
|
|
|
H C |
6 |
|
C H |
|
|||
|
|
|
|
|
|
|
5 |
|
|
|
6 |
5 |
|
|
(C H ) |
C |
Cl ... HOCH |
CH OH |
|
CH O |
|
... |
C |
... |
Cl |
... |
HOCH |
||
6 6 3 |
|
3 |
|
|
||||||||||
|
|
|
|
3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
H |
|
|
C H |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
(C H ) |
C |
OCH |
3 |
HCl |
CH OH |
|
|
|||||
|
|
6 |
6 3 |
|
|
|
|
|
3 |
|
|
|
|
|
Такой тип механизма замещения называют многоцентровым, иногда механизмом push–push из-за того, что нуклеофил выталкивает замещаемую группу, а электрофил оттягивает (англ. pull) ее от реакционного центра.
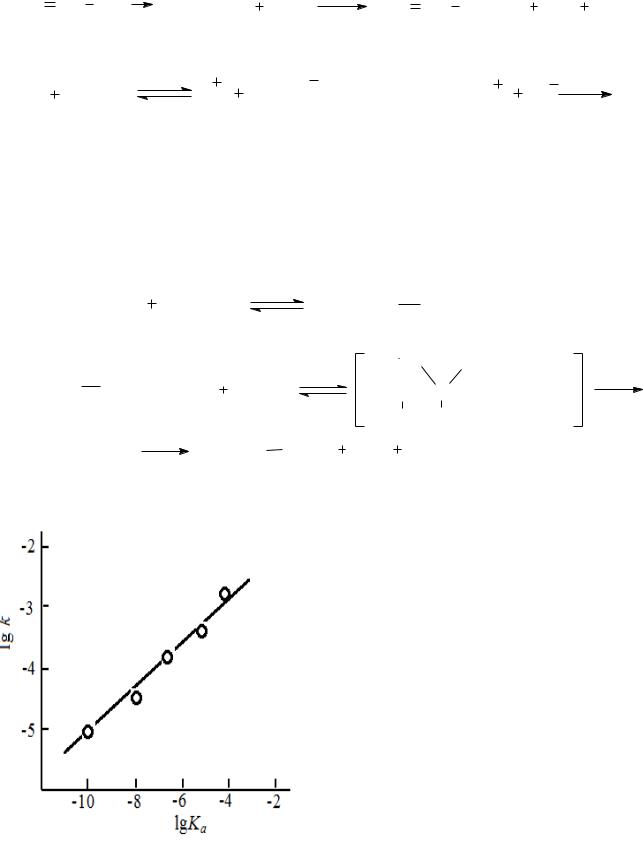
|
Каталитическая активность со- |
|||
|
единений, обладающих кислотными |
|||
|
свойствами, возрастает с увеличени- |
|||
|
ем их кислотности. Это хорошо |
|||
|
видно из рис. 11.4, на котором гра- |
|||
|
фически |
изображены данные по |
||
|
скорости |
сольволиза |
трет- |
|
|
бутилбромида в присутствии за- |
|||
|
мещенных фенолов (0,3 моль/л). |
|||
|
Вещества с кислотными свой- |
|||
|
ствами (вода, спирты, карбоновые |
|||
|
кислоты и др.) часто используются |
|||
|
как растворители для нуклеофиль- |
|||
|
ных реакций. Очевидно, что спе- |
|||
|
цифическая сольватация ими за- |
|||
Рис. 11.4. Зависимость скорости реак- |
мещаемой группы ведет к ускоре- |
|||
нию процесса и возможности его |
||||
ции сольволиза трет-бутилбромида в при- |
||||
сутствии фенолов от их кислотности Ка |
проведения в умеренных условиях. |
|||
|
140 |
|
|
|
