
ТОХТ
.pdf

2
Тема 1. Характеристика химических процессов
1.1. Классификация химических реакций
Химические процессы органической технологии характеризуются протеканием большого числа химических реакций с участием промежуточных активных частиц, которые существенным образом влияют на скорость и направление превращения исходных веществ. Вследствие огромного разнообразия химических реакций их, как правило, классифицируют по общим признакам. Применительно к реакциям промышленного органического синтеза в основу могут быть положены следующие признаки.
А. Фазовое состояние реагентов и продуктов реакции.
Если компоненты реакционной системы находятся в пределах одной фазы (газ, жидкость, твердая фаза), реакцию называют гомофазной. При существовании двух или более фаз (газ – жидкость, газ‒ жидкость ‒ твердая фаза и др.) реакцию называют гетерофазной.
По зоне протекания химического процесса реакции делятся на гомогенные и гетерогенные. Гомогенные реакции протекают в объеме какой-либо одной фазы, гетерогенные - на поверхности раздела фаз, например, реагент - гетерогенный катализатор.
Этерификация уксусной кислоты этанолом в жидкой фазе в присутствии серной кислоты относится к гомогенным гомофазным реакциям, а в присутствии твердого катализатора к гетерогенным гомофазным каталитическим реакциям.
Процессы окисления органических соединений в жидкой фазе молекулярным кислородом относятся к гомогенным гетерофазным реакциям, т.к. взаимодействие органического субстрата происходит с растворенным кислородом. Аналогичным образом протекает сульфирование ароматических углеводородов, когда реагенты находятся в двух несмешивающихся фазах, а реакция протекает в объеме одной из фаз (кислотной фазе).
Б. Природа воздействия физического агента на реакционную систему.
При воздействии теплоты и радиации на реакционную систему происходит активация реагентов за счет теплового движения молекул и протекает термическая реакция. При этом реакция протекает изотермически, если в течение всего процесса температура постоянна, и неизотермически, если температура меняется
входе реакции, при отсутствии теплоотвода реакция протекает адиабатечески.
Вэкзотермических реакциях происходит выделение теплоты (Δ Н < 0), в эндотермических - поглощение теплоты (Δ Н > 0). В термонейтральных реакциях энтальпия реакции равна нулю (Δ Н =0).
При воздействии света и радиации (α, β, γ – излучения) протекают фотохимические реакции и радиационно-химические реакции.
При пропускании электрического тока через реакционную систему в объеме системы или на поверхности электродов протекают электрохимические реакции.
Механохимические реакции протекают в твердом теле или при его механическом разрушении.
3
В. Катализ и ингибирование реакций При введении в реакционную систему катализатора, ускоряющего хими-
ческий процесс, происходит так называемая каталитическая химическая реакция. Катализатор многократно вступает в промежуточные химические реакции и регенерируется к моменту образования конечного продукта. Если катализатор образуется в процессе химической реакции, то такая реакция называется автокаталитической.
Введение в реакционную систему соединения, которое тормозит или останавливает химическую реакции, называется ингибированием химического процесса, а введенное вещество – ингибитором.
Г. Стехиометрии и механизм химических реакций С точки зрения стехиометрии все химические реакции подразделяются на
простые и сложные.
Простые (однозначные) реакции характеризуются тем, что при их протекает единственное необратимое превращение и не образуется иных стабильных продуктов, кроме записанных в уравнении реакции:
Простые реакции могут быть элементарными и неэлементарными. Элементарные реакции протекают при непосредственном взаимодействии исходных веществ, т.е. при этом отсутствуют какие-либо микростадии, через которые идет реакции. Неэлементарные реакции имеют ряд химических микростадий, в которых участвуют промежуточные комплексы или частицы, не фигурирующие в стехиометрическом уравнении, например,
→
Каждая их промежуточных стадий, составляющих неэлементарную реакцию является элементарной.
Совокупность связанных друг с другом элементарных реакций, из которых состоит неэлементарная реакция, составляет механизм реакции, точнее, кинетический механизм реакции.
Стехиометрически сложные (многозначные) реакции – реакции, которые записываются в виде двух или более стехиометрического уравнения.
Сложные реакции состоят из простых по стехиометрии реакций. К ним относятся:
а) Обратимые реакции:
б) Параллельные реакции
в) Последовательные реакции:
4

Д. Тип реакции (направление протекания реакции)
Простые реакции могут протекать по следующим направлениям:
а) Реакции присоединения (символ Ad), например:
R |
R |
|
|
R |
R |
|
C |
C |
X2 |
X |
C |
C |
X |
R |
R |
|
|
R |
R |
|
б) Реакции элиминирования (отщепления) (символ Е), например:
|
R |
R |
|
R |
R |
|
X |
C |
C |
X |
C |
C |
X2 |
|
R |
R |
|
R |
R |
|
в) Реакции замещения (символ S), например:
R X Y |
R Y X |
г) Реакции изомеризации (перегруппировки), например:
CH |
3 |
CH |
2 |
CH |
2 |
CH |
3 |
CH |
3 |
CH CH |
3 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
Е. Характер изменения связи (тип механизма реакции) а) Гомолитические (радикальные) реакции
Если в процессе реакции происходит разрушение или образование двухвалентной связи с участием частиц с неспаренными электронами ‒ радикалов, то такие реакции называют гомолитическими или радикальными.
Радикальные реакции обозначаются индексом R и могут протекать по различным направлениям (типам).
Например:
|
|
|
R O2 |
|
R |
|
O O |
(AdR) |
|
|
|
R |
|
CH2 |
CH2 |
R |
CH2 |
CH2 |
(ER) |
|
|
||
CH3 |
CH3 |
Cl |
CH3 |
CH2 |
HCl |
|
|
|
|||
CH3 |
CH2 |
Cl |
CH |
CH |
Cl |
Cl |
(SR) |
|
|||
|
|
|
2 |
|
3 |
|
2 |
|
|
|
|
CH |
3 |
CH |
Cl |
|
CH |
CH |
HCl |
|
|
||
|
3 |
|
|
|
|||||||
|
|
|
|
|
|
3 |
2 |
|
|
||
CH |
|
CH |
Cl |
|
CH |
|
CH |
|
|
(S |
) |
|
|
3 |
Cl |
Cl |
R |
|
|||||
3 |
2 |
2 |
|
|
2 |
|
|
||||
б) Гетеролитические (ионные) реакции Если в процессе реакции расщепление связи происходит с переходом элек-
тронной пары к одному из партнеров связи, а образование связи – с обобществлением электронной пары одного из реагентов, то такая реакция называется гетеролитической или ионной.
В гетеролитических реакциях химические превращения происходят с уча-
5

стием ионов (катионов и анионов) и могут относиться либо к нуклеофильным реакциям (индекс N), либо электрофильными реакциями (индекс Е).
Реакция является нуклеофильной, если атакующий реагент выполняет функцию нуклеофила (донора электронной пары). Реакция относится к электрофильной, если атакующий реагент – электрофил (акцептор электронной пары).
Нуклеофильные реагенты: отрицательные ионы, соединения с неподеленными парами электронов, соединения с этиленовыми двойными связями и ароматические вещества.
Электрофильные реагенты: положительные ионы, кислоты Льюиса, ацетилены, соединения с карбонильными группами, галогены.
Нуклеофильные и электрофильные реакции (по типу реакции) могут протекать как реакции присоединения, замещения или изомеризации.
Нуклеофильное и электрофильные присоединение, например:
R |
R |
|
H |
R |
R |
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
C |
C |
B |
C |
C |
H |
(Ad |
) |
||
|
|
|
|
|
|
|
|
N |
|
R |
R |
|
|
R |
R |
|
|
|
|
|
|
|
|
|
|
|
|
||
R |
R |
|
B |
R |
R |
|
|
|
|
|
|
Y |
|
|
|
|
|
|
|
C |
C |
Y |
C |
C |
B |
(Ad |
) |
|
|
|
|
|
|
|
|
|
E |
|
|
R |
R |
|
|
R |
R |
|
|
|
|
|
|
|
|
|
|
|
|
||
Нуклеофильное и электрофильное замещение, например
R X |
Y |
R |
Y |
X |
(S ) |
|
|
|
|
|
N |
R X |
Y |
R |
Y |
X |
(SE) |
Нуклеофильная и электрофильная изомеризация (перегруппировка), например:
|
|
|
|
CH |
|
|
|
|
3 |
CH |
CH |
CH CH |
CH |
C |
3 |
2 |
3 |
3 |
|
|
|
|
|
CH |
|
|
|
|
3 |
Ж. Число частиц, принимающих участие в элементарных реакциях или в лимитирующей стадии неэлементарных реакций
- Мономолекулярные реакции, например:
CH3 CH3  CH3 CH3
CH3 CH3
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
C |
CH |
|
|
|
|
CH |
2 |
CH |
CH |
3 |
||||||||||||
2 |
|
|
|
|
|
|
|
|
|||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R |
|
|
CH2 |
|
CH2 |
R |
|
|
|
|
CH2 |
|
CH2 |
||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
||||
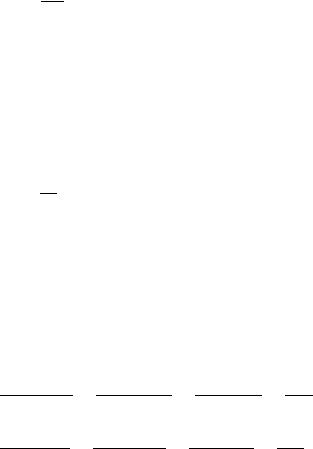
-Бимолекулярные реакции
-Тримолекулярные реакции
Согласно буквенным символам в обозначении реакции указывается направление (тип) реакции, тип реагента (механизм) и молекулярность. Первой обозначается направление реакции, затем – тип реагента и далее цифрой – молекулярность. Например: SN1, SN2, AdN 2, SЕ2, AdЕ 2, Е1, Е2 и т.д.
1.2. Материальные расчеты для химических реакций
Первичной основой учения о химических превращениях веществ является стехиометрия, на которой базируются все количественные соотношения при химических реакциях.
В технике количества веществ чаще всего выражают через их массу mi, измеренную в г, кг или т. Однако при химических реакциях вещества расходуются и образуются в мольных соотношениях, поэтому для материальных расчетов более удобно их мольные количества ni, выраженные в моль или кмоль. Они связаны с массой соотношением
где Мi молекулярная масса вещества.
Соотношение (1.1) позволяет после расчета количества вещества в молях перейти к расчетам в кг.
Мольные количества ni используют для характеристики периодических процессов. В непрерывных процессах, когда вещества подаются и выходят из реактора непрерывно, более приемлемой материальной характеристикой является мольный поток, который для стационарного режима выражается уравнением:
где Fi – мольный поток, моль/время или кмоль/время; t – время, за которое подают или выводят из реактора ni молей вещества.
Для каждой простой реакции, которая записывается уравнением
можно написать следующее равенство, являющееся основным соотношением баланса реакции:
где ni и ni,0, Fi и Fi,0 ‒ мольные количества или мольные потоки веществ соответственно в любой момент реакции и в исходной смеси.
Эти равенства справедливы при условии, что стехиометрические коэффициенты расходуемых веществ берутся со знаком минус, а образующихся – со знаком плюс. При этом величина n (или F) всегда положительна, инвариантна в
7
отношении участников реакции называется полнотой реакции. Из равенства (1.3) вытекает уравнение материального баланса простой реакции
Зная начальные и конечные мольные количества (ni,0, ni) |
или мольные пото- |
|
ки (Fi,0, Fi) для одного вещества, вычисляют значения полноты реакции |
(n |
|
или F) по формулам (1.3.1- 1.3.2), а затем по формулам (1.4.1 -1. 4.2) |
рассчи- |
|
тывают мольные количества или мольные потоки для всех |
других веществ, |
|
участвующих в реакции. |
|
|
Из уравнений (1.3) следует, что мольное соотношение образующихся или расходуемых веществ при простых реакциях равно соотношению стехиометрических коэффициентов этих веществ в уравнении реакции:
( )
( )
Пример 1. Полагая, что реакция диспропорционирования циклогексена с образованием бензола и циклогексана
3 |
C H |
2 |
C H |
C H |
|||
6 |
10 |
6 |
12 |
6 |
6 |
||
|
A |
|
|
B |
|
Z |
|
является простой, вычислить мольное количество продуктов реакции, если из-
вестно, что nA,0 =12 кмоль, nB,0 = nZ,0 =0; nA= 3 кмоль. По уравнению (1.3.1) находим полноту реакции n:
Тогда по уравнения (1.4.1) имеем:
Материальный баланс представлен в табл. 1.1.
Таблица 1.1. Материальный баланс диспропорционирования циклогексена
Вещество |
Концентрация |
Молекулярный |
Количество вещества |
|
Объем |
||
вес |
кмоль |
|
кг |
|
V, м3 |
||
|
|
ЗАГРУЖЕНО |
|
|
|
|
|
С6Н10 |
|
82 |
|
12 |
|
984 |
|
ИТОГО |
|
|
|
|
|
984 |
|
|
|
ПОЛУЧЕНО |
|
|
|
|
|
С6Н10 |
|
82 |
|
3 |
|
246 |
|
С6Н12 |
|
84 |
|
6 |
|
504 |
|
С6Н6 |
|
78 |
|
3 |
|
234 |
|
ИТОГО |
|
|
|
|
|
984 |
|
Для материального расчета сложных реакций для каждой из независимых реакций по аналогии с выражением (1.3) можно записать уравнения полноты реакции
8
где индекс i соответствует веществу, а индекс j ‒ реакции.
Тогда, имея в виду, что каждое из веществ может участвовать в нескольких
реакциях |
∑ |
получим |
|
|
|
|
|
|
∑ |
|
|
|
|
|
|
|
∑ |
|
|
|
|
|
|
Пример 2. |
При |
дегидратации этанола протекают реакции |
|||||
|
|
C2H5OH |
C2H4 |
|
H2O |
||
|
|
|
|||||
|
|
A |
B |
|
Z |
||
|
|
2 C2H5OH |
(C2H5)2O |
|
H2O |
||
|
|
|
|||||
|
|
A |
C |
|
|
|
Z |
Рассчитать материальный баланс процесса, если FA,0 = 1000 кмоль/ч, |
|||||||
FB = 300 кмоль/ч, FC = 200 кмоль/ч. |
|
|
|
|
|||
Решение. |
|
|
|
|
|
|
|
По уравнению (1.7) |
|
|
|
|
|
||
FB = 0 + 1∙F1 |
|
F1= 300 |
|
|
|
|
|
FC= 0 + 1∙ F2 |
|
F2 = 200 |
|
|
|
|
|
Тогда
FA = 1000 - 1∙300 - 2∙200 = 300 кмоль/ч FZ = 0+ 1∙300 + 1∙200 = 500 кмоль/ч
На основании данного расчета составлена таблица материального баланса
(табл. 1.2).
Таблица 1.2. Материальный баланс процесса дегидратации этанола
Вещество |
Мол. вес |
Количество вещества |
||
кмоль/ч |
кг/ч |
|||
|
|
|||
|
|
Загружено |
|
|
Этанол |
46 |
1000 |
46000 |
|
ИТОГО |
|
|
46000 |
|
|
|
Получено |
|
|
Этанол |
26 |
300 |
13800 |
|
Этилен |
28 |
300 |
8400 |
|
Диэтиловый эфир |
74 |
200 |
14800 |
|
Вода |
18 |
500 |
9000 |
|
ИТОГО |
|
|
46000 |
|
1.3. Безразмерные количественные характеристики химических процессов
Кроме мольных количеств и потоков в химии и технологии большое значение имеют безразмерные характеристики материального баланса - степень конверсии, селективность и выход.
Степень конверсии реагента А - доля прореагировавшего исходного реагента А относительно его начального количества:
9

В таком написании степень конверсии может меняться от 0 до 1, но ее нередко выражают в процентах, умножая правые части предыдущих выражений на 100. При этом обычно степень конверсии определяют по основному исходному реагенту А, но ее можно аналогично записать и для других реагентов, например для реагента Y:
В предыдущем примере дегидратации этанола степень его конверсии составляет:
Из уравнения (1.8) следует
Дли простых и обратимых реакций, когда имеются единственное независимое превращение, степень конверсии — вполне достаточная характеристика материального баланса.
Из уравнения (1.8) можно вывести зависимости ni (Fi) от nА,0 (FА,0) и степени конверсии основного реагента ХА:
| |
| |
Если реагент Y взят в избытке , т.е.
В этом случае степень превращении, найденная по реагенту А, связана с количеством второго реагента FY следующим соотношением:
( )
Для сложных реакций степень конверсии показывает лишь долю превращенного реагента, но не дает представления о направлениях его превращения, которое определяется селективностью и выходом.
Селективность представляет собой количественную оценку эффективности целевой реакции по сравнению с побочными реакциями. Различают полную (интегральную) селективность и дифференциальную селективность.
Интегральная селективность – это доля (или процент) превращенного исходного реагента А, израсходованная на образование данного продукта В в соответствии со стехиометрией:
10
