
КонспектЛекцХимияГорохов
.pdfГенри: растворимость газа при постоянной температуре пропорциональна его давлению.
При растворении жидкостей в жидкостях возможны три варианта растворимости: а) неограниченная растворимость; б) ограниченная растворимость и в) практически полная нерастворимость.
Изменение растворимости твердых веществ с изменением температуры определяется знаком и величиной теплового эффекта растворения. Например, растворимость NaCl практически мало зависит от температуры, что связано с почти нулевым тепловым эффектом растворения. Излом кривой для сульфата натрия обусловлен разрушением кристаллогидрата при 32,40 С. Резкое изменение хода кривой растворимости сульфата натрия обусловлено значительной эндотермичностью процесса растворения кристаллогидрата и экзотермичностью растворения безводной соли . [10, стр. 158]
Важной характеристикой раствора является его состав или концентрация компонентов. Для выражений концентраций компонентов раствора применяются различные способы:
1. Молярная доля (Ni) или молярное содержание данного компонента, выраженное в процентах:
N |
|
= |
ni |
N |
(%) = |
ni 100 |
, |
|
∑ni |
|
|||||
|
i |
|
i |
|
∑ni |
||
где ni – количество i-го компонента, моль.
2. Массовая доля (ω) или массовое содержание данного компонента, выраженное в процентах:
ωi = |
mi |
ωi (%) = mi 100 / ∑mi , |
|
||
|
∑mi |
|
где mi – масса данного компонента.
3. Объемная доля (Ii) или объемное содержание данного компонента, выраженное в процентах:
Ji = Vi  V Ii (%) = Vi 100
V Ii (%) = Vi 100 V ,
V ,
где V – объема раствора, Vi – объем данного компонента.
71
4. Молярность – количество i-го компонента в молях в одном литре раствора:
ci = ni / V ,
где V – объема раствора, л.
5. Моляльность (mi) – количество i-го компонента (в молях) в 1000 г растворителя:
mi |
= |
ni 1000 |
, |
|
M |
||||
|
|
|
где: М – масса растворителя.
72
10 Разбавленные растворы неэлектролитов
Давление насыщенного пара растворителя над раствором нелетучего вещества.
Закон Рауля.
Температура кипения растворов нелетучих веществ. Эбулиоскопия.
Температура замерзания растворов нелетучих веществ. Криоскопия.
Осмотическое давление. Осмос и его значение.
Свойства раствора всегда отличаются от свойств каждого из его компонентов. Изменение свойств связано с характером взаимодействия между компонентами и с уменьшением концентрации молекул каждого вещества при распределении в нем другого вещества. Представляют интерес очень разбавленные растворы, при образовании которых ∆Η ≈ 0 и ∆V ≈ 0. В таких растворах частицы растворенного вещества находятся на большом расстоянии друг от друга и их взаимное влияние можно исключить, а растворитель практически не меняет своих свойств. Свойства разбавленных растворов описываются более простыми уравнениями и приближаются к идеальным.
Опыт показывает, что давление насыщенного пара растворителя над раствором нелетучего вещества всегда ниже, чем у чистого растворителя при той же температуре. Иллюстрацией этому может служить простой эксперимент. Под стеклянный колпак ставят стакан с чистым растворителем и другой стакан с таким же количеством раствора. Спустя некоторое время уровень жидкости в стакане с растворителем понижается, а уровень раствора повышается. Происходит перенос растворителя из одного стакана в другой, что обусловлено более низким давлением пара над раствором.
73
Понижение давления над раствором будет тем значительнее, чем больше введено вещества или чем меньше мольная доля растворителя в растворе, т. е. давление насыщенного пара растворителя над раствором Р1 пропорционально мольной доле растворителя N1:
|
Р1 = К N1 |
|
|
(29) |
В пределе, когда N |
=1, т. е. растворенного вещества нет, Р |
1 |
= Р0 |
, т. е. |
1 |
|
1 |
|
К1 = Р10 . Следовательно, это уравнение может быть записано так: Р1 = Р10 N1 , т.
е. давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.
Уравнение, являющееся математическим выражением закона Рауля,
можно |
преобразовать. Так |
как |
N +N =1, то |
Р |
1 |
= Р0 |
(1− N |
2 |
) = Р0 |
−Р0 |
N |
2 |
||
|
|
|
|
1 |
2 |
|
1 |
|
1 |
1 |
|
|||
Р10 −Р1 |
= Р10 N2 . Разделив последнее равенство на Р10 |
получим: |
|
|
|
|
|
|||||||
|
|
Р10 −Р1 |
= N2 |
или |
∆P = N2 |
|
|
|
|
|
|
|
(30) |
|
|
|
Р10 |
|
|
|
|
|
|
|
|||||
|
|
|
|
Р10 |
|
|
|
|
|
|
|
|
|
|
Следовательно, относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе (закон Рауля).
Растворы, подчиняющиеся закону Рауля при всех температурах и концентрациях, называют идеальными. В идеальном растворе молекулы растворителя взаимодействуют с растворенным веществом так же, как взаимодействуют между собой молекулы растворителя и между собой молекулы растворенного вещества.
С давлением насыщенного пара связаны другие свойства растворов, например, их температура кипения. Жидкость закипает тогда, когда давление ее насыщенного пара становится равным внешнему давлению Рв. Для того чтобы найти температуру кипения жидкости, достаточно построить график зависимости ее насыщенного пара от температуры и найти температуру Т0, при которой Р=Рв. Точка Т0 и будет соответствовать температуре кипения жидкости при внешнем давлении Рв.
74

Р |
1 |
2 |
Рв =1,013 105 Па
Р10 = f (T)
Р1 = f (T)
Т0 Т1 Т
Рисунок 3 – Зависимость давления пара растворителя над чистым растворителем ( Р10 ) и над идеальным раствором (Р1) от температуры
Так как кривая зависимости давления насыщенного пара над раствором
(2) нелетучего вещества от температуры проходит ниже соответствующей кривой для растворителя (1), то температура кипения Т1 раствора всегда будет выше, чем у растворителя (Т1>Т0). Эта разность температур кипения будет тем больше, чем выше концентрация раствора. Разность между температурами кипения раствора и растворителя является характерным свойством раствора и носит название повышения температуры кипения ∆Τк = Т1 − Т0 .
Учитывая понижение давления пара над раствором, можно показать, что растворы нелетучих веществ должны замерзать при температуре более низкой, чем чистый растворитель. Этим объясняется то, что вода в морях (и соленых озерах) замерзает при температуре ниже нуля.
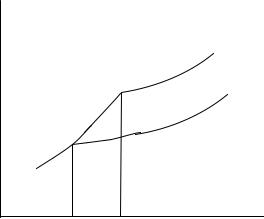
Для графического определения температуры замерзания (рисунок 4) надо начертить кривые зависимости давления насыщенного пара от температуры для жидкого (1) и твердого (3) растворителя и над раствором (2).
75
Р
|
1 |
P0 |
= f (T) |
1ж |
2 |
|
|
Р10тв = f (T) |
Р1=f(T) |
3 |
|
Т1 |
Т10 |
Т |
Рисунок 4 – Зависимость давления пара растворителя над твердым ( Р10 тв ) и жидким ( Р10 ж ) растворителем и над раствором (Р1) от температуры
Кривая (3) имеет больший угол наклона, чем кривая (1). Это вытекает из
уравнения Клапейрона-Клаузиуса: |
|
|
|
|
||
|
d ln P |
= |
λ |
|
|
(31) |
|
|
RT2 |
|
|||
|
dT |
|
|
|||
Для сублимации dP/dT больше, чем для испарения, |
так как теплота |
|||||
сублимации λс больше теплоты испарения λ |
на величину |
скрытой теплоты |
||||
плавления. Точка пересечения кривых 1 и 3 определяет температуру Т10 , при которой жидкая и твердая фаза находятся в равновесии. Это и есть температура замерзания растворителя. Для определения температуры замерзания раствора аналогично находят точку пересечения кривой зависимости давления пара растворителя над раствором (2) с кривой для твердой фазы (3). Это возможно, так как при замерзании раствора в виде твердой фазы выделяется чистый растворитель (всоленых озерах ледпресный). Посколькукривая(2) проходитнижекривой(1), то температура замерзания раствора Т1 будет всегда ниже температуры замерзания чистого растворителя Т10 . Разность этих температур Т10 −Т1 , являющуюся также характерным свойством раствора, называют понижением температуры замерзания раствора ∆Τ3 .
Так как для разбавленных растворов понижение давления пара пропорционально концентрации, то и повышение температуры кипения и
76
понижение температуры замерзания разбавленных растворов пропорционально их концентрации. При записи данной зависимости концентрацию принято выражать моляльностью. Таким образом,
∆Τзам = К m ∆Τкип = Е m
Коэффициенты пропорциональности называются эбулиоскопической Е и криоскопической К константами.
Константы Е и К не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Поскольку ∆Τкип , ∆Τзам изменяются пропорционально числу молей растворенного вещества, а каждый моль содержит одинаковое число молекул, то эти характеристики раствора зависят только от числа частиц растворенного вещества. Отсюда повышение температуры кипения и понижение температуры замерзания растворов пропорциональны числу частиц растворенного вещества и не зависят от его природы (второй закон Рауля).
Метод изучения свойств растворов, основанный на измерении температуры их замерзания был детально разработан Бекманом. Он получил название криоскопии. Сейчас это один из самых точных методов изучения растворов: точность измерения ∆Τзам в настоящее время доведена до 0,000001
град.
Эти методы широко используются для вычисления молекулярных масс. Они применимы также для выяснения химических изменений веществ при их растворении. Так, если при растворении вещество диссоциирует, то найденное значение М меньше величины, соответствующей его истинной формуле и, наоборот, если вещество в растворе ассоциировано, то значение М выше значений, рассчитанных по формуле. Из этих методов исследования разбавленных растворов самым точным и поэтому наиболее применяемым является криоскопический.
Представим себе, что раствор какого-нибудь вещества определенной концентрации находится в сосуде, погруженном в другой сосуд с раствором того
77
же вещества меньшей концентрации. Если бы стенки внутреннего сосуда были пористыми, то есть через них могли бы проходить молекулы обоих компонентов смеси, то в системе протекала бы обычная диффузия. Будем считать, однако, что стенки внутреннего сосуда изготовлены из особого вещества, сквозь которого свободно проходят молекулы растворенного вещества (такие материалы называются полупроницаемыми). Обычная диффузия, связанная с переходом молекул растворенного вещества из раствора с большей концентрацией в раствор с меньшей концентрацией, в этом случае невозможна, так как стенки сосуда непроницаемы для его молекул. Но процесс выравнивания концентрации смеси здесь возможен: молекулы растворителя могут переходить из внешнего сосуда во внутренний. Такой процесс, представляющий собой одностороннюю диффузию через полупроницаемую перегородку, называют осмосом.
Пфеффер (1877) сконструировал специальный прибор для измерения осмотического давления – осмометр с полупроницаемой перегородкой из ферроцианида меди – и измерил осмотическое давление водных растворов сахара в широкой области температур и концентраций. Данные Пфеффера послужили экспериментальной основой открытого Вант-Гоффом (1887) закона осмотического давления. Вант-Гофф показал, что осмотическое давление ( π) в
разбавленных растворах подчиняется уравнению: |
|
π = RTC |
(34) |
где π – осмотическое давление раствора, КПа; |
|
С – его мольно-объемная концентрация (молярность), моль/л; R – универсальная газовая постоянная, 8,314 Дж/моль.К;
Т – абсолютная температура раствора.
Осмотическое давление имеет очень большое значение в процессах жизнедеятельности различных организмов, определяя распределение растворенных веществ и воды в тканях. Осмотическое давление крови у человека составляет примерно 8,1.105 Па (8 атм).
При уменьшении в организме содержания воды возникает чувство жажды, утоление которой восстанавливает водно-солевое равновесие и
78
осмотическое давление крови. От осмотического давления зависит так называемая сосущая сила клетки, достигая у семян при 6%-ной окружающей влажности величины 4,05.107 (400 атм), что обеспечивает необходимое для прорастания поглощение воды из сравнительно сухой почвы.
79
11 Коллоидные системы
Некоторые свойства коллоидных систем, способы получения их, строение коллоидных частиц.
Механизм процессов самопроизвольно уменьшения поверхностной энергии и формирования поверхностного слоя.
Агрегативная и кинетическая устойчивость дисперсных систем, структурообразование.
Области практического применения коллоидной химии.
Коллоидные системы (коллоиды, коллоидные растворы) – дисперсные системы с предельно высокой дисперсностью при условии сохранения гетерогенности, т. е. поверхности раздела между дисперсной фазой и средой. Термин «коллоиды» (клееподобные тела), введенный Грэмом в 1861 г. давно устарел и лишь для краткости и по исторической традиции применяется вместо правильного современного научного термина «предельно высокодисперсные микрогетерогенные системы» (ультрамикрогетерогенные системы). Основные своеобразные свойства коллоидных систем определяются не только дисперсностью, но и характером физико-химического взаимодействия обеих фаз (1) и (2) системы на их общей границе раздела, что определяет по величине удельной свободной поверхностной энергии σ1,2 на границе раздела фаз большую или меньшую лиофильность коллоидных систем.
Гетерогенность, или наличие межфазной поверхности, предполагает наличие поверхностного натяжения. Поверхностное натяжение определяет как бы степень гетерогенности, резкость перехода от одной фазы к другой, различие между соприкасающимися фазами. Чем сильнее выражена гетерогенность и чем более резко различаются сопряженные фазы по своей природе, тем больше поверхностное натяжении. Второй признак – дисперсность определяется размером частиц, площадью поверхности.
80
