
КонспектЛекцХимияГорохов
.pdf15 Химические источники тока
Понятие об электродном потенциале. Гальванический элемент ДаниэляЯкоби.
Электродвижущая сила элемента. Электрохимические цепи. Топливные элементы.
Переход энергии химической реакции в энергию электрического тока и обратно происходит в электрохимических системах, состоящих их электролитов и электродов. Электрод-система, состоящая из двух фаз, одна из которых является электролитом, а другая – металлом или полупроводником. Между компонентами фаз происходит реакция (электродный процесс), сопровождающаяся переходом электрических зарядов из одной фазы в другую и возникновением скачка потенциала на границе их раздела.
Существует несколько теорий, объясняющих механизм возникновения скачка потенциала на границе раствор-металл. Наиболее совершенной является сольватационная теория электродного потенциала, основы которой высказаны Л.В. Писаржевским, затем развиты Н.А. Изгарышевым и дополнены работами Герни. Согласно этой теории скачок потенциала на границе раствор-металл обусловлен двумя процессами: 1) диссоциацией атомов металла на ионы и электроны внутри металла; 2) сольватацией ионов металла, находящимися на поверхности металла, при соприкосновении его с раствором, содержащем молекулы растворителя L. Обе стадии и общая реакция на границе растворметалл могут быть записаны в следующем виде:
_ |
(1) |
М МZ+ + z e |
|
MZ+ + nL MZ+ nL |
(2) |
_________________ |
|
_
M + nL MZ+ nL + ze
121
Каждая стадия имеет определенную энергетическую характеристику: для первой – это работа выхода катиона UM, для второй – энергия сольватации Usolv. При Usolv>UM начальный процесс будет заключаться в переходе металла в раствор:
_
M + nL MZ+ nL + z e
Если Usolv<UM, то начальный процесс будет представлять собой выделение металла из раствора.
_
MZ+ nL + z e M + nL
В результате раствор вблизи металла приобретает электрический заряд, противоположный по знаку заряду самого металла. Образуется, как принято говорить, двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором.
Толщина этого слоя в растворе зависит от концентрации раствора, от заряда металла и от температуры, его часто называют диффузным слоем. Если металл при погружении в раствор заряжается положительно, то в диффузном слое концентрация катионов будет понижена, а анионов – повышена по сравнению с концентрацией их в растворе.
Необходимо учитывать, что ионы того и другого знака, взаимодействуя с молекулами воды, гидратируются. Само взаимодействие ионов с молекулами воды изменяется под действием поля и неодинаково для разных зон двойного слоя. Электрическое поле действует и на молекулы воды, способствуя их определенной ориентации и деформируя их.
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл / раствор образуется двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором. Величина этой разности потенциалов зависит от свойств металла и раствора, в особенности от концентрации ионов металла в растворе и от характера взаимодействия между частицами в двойном электрическом слое.
122
Рассмотрим систему, в которой два электрода (цинк и медь в виде пластинок) опущены в растворы своих солей, разделенные диафрагмой. Каждый из металлов может выделить в раствор то количество ионов, которое отвечает равновесию его с раствором.
_
Zn Zn2+ + 2e
_
Cu Cu 2+ + 2e
Однако отвечающие такому равновесию потенциалы этих металлов неодинаковы. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода. Если пластинки соединить проволокой, то разница этих потенциалов приводит к переходу соответствующего числа электронов с цинковой пластинки на медную. Это нарушает равновесие двойного слоя на обеих пластинках, снова возникает разность в зарядах пластинок, вызывающая переход электронов с цинковой пластинки на медную. В результате возникает самопроизвольно протекающий процесс, при котором цинковая пластинка растворяется, а на медной выделяется металлическая медь. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Если реакцию проводить в условиях наиболее близких к обратимым, то разность потенциалов между электродами элемента максимальна и получаемая электрическая работа наибольшая. Наибольшая разность потенциалов данного элемента называется его электродвижущей силой и обозначается э.д.с.
В основе работы элемента Якоби лежит реакция: Zn + CuSO → Cu + ZnSO
Эта реакция в обычных условиях может протекать самопроизвольно. При вытеснении металлическим цинком меди из раствора сульфата меди электроны переходят непосредственно от атомов цинка к ионам меди. При таком взаимодействии процесс необратим и работа, которая могла бы совершаться за счет этой реакции, не используется.
123
Проводя указанную реакцию в гальваническом элементе, мы разделяем
процессы окисления |
и восстановления, осуществляя |
их |
на различных |
электродах. Окисление |
_ |
на |
отрицательном |
цинка Zn = Zn2+ + 2e происходит |
_
электроде, восстановление меди Cu 2+ + 2e = Cu – на положительном.
Схема электрохимической цепи элемента Даниэля-Якоби записывается следующим образом:
(−)Zn | ZnSO4aq MCuSO4aq | Cu(+)
Вертикальной сплошной чертой обозначается граница между металлом и раствором и пунктирной чертой – граница между двумя электролитами в элементе. Если на границе между двумя электролитами устранен диффузионный потенциал, то границу между электролитами обозначают двумя вертикальными черточками.
Как видно, в гальваническом элементе идет химическая реакция, а во внешней цепи элемента протекает электрический ток, т. е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Электрическая работа равна произведению разности равновесных потенциалов катода и анода элемента на количество электричества. Если на электродах испытывает превращение один моль вещества, то по закону Фарадея через систему протекает количество электричества, равное nF, где n – число молей эквивалентов в одном моле вещества. Если гальванический (электрохимический) элемент работает термодинамически обратимо при постоянных температуре и давлении, то согласно второму началу термодинамики уменьшение энергии Гиббса равно максимальной полезной работе, которая равна электрической энергии nFEЭ, получаемой от элемента:
−∆G = W' |
= nFE |
, |
(43) |
m |
э |
|
|
где EЭ – электродвижущая сила (ЭДС) элемента. Уравнение (43) показывает связь между химической и электрической энергиями. При известных значениях энергии Гиббса реакции ∆G можно рассчитать EЭ и, наоборот.
124
Между ЭДС электрохимического элемента, константой равновесия электрохимической реакции и активностями реагентов существует зависимость. Рассмотрим окислительно-восстановительную реакцию,
аА+bВ=сС+dD
протекающую обратимо в электрохимическом элементе, и найдем для этого элемента значение ЭДС (Е). Обозначим активности реагирующих веществ через aA, aB, aC, aD. Согласно уравнению изотермы химической реакции энергия Гиббса этой реакции равна:
− ∆G = RT(ln Ka |
− ln |
aCc adD |
(44) |
|
aaA aBb |
||||
|
|
|
где Ка – константа равновесия; aC, aD, aA, aB, - начальные (неравновесные) активности реагентов. Учитывая формулу (43), получаем термодинамическое выражение для ЭДС элемента:
Eэ |
= |
RT |
(ln Ka |
−ln aCc adD ) |
(45) |
|
|
nF |
|
aaA aBb |
|
ЭДС элемента, относящуюся к стандартным условиям, когда aA=aB=aC=aD =1, обозначают Е0 и называют стандартной ЭДС. При активностях участников реакции равных единице, из (45) получим:
|
E0 = |
b0 |
ln Ka |
|
(46) |
|||
|
n |
|
||||||
|
|
|
|
|
|
|
||
где b0 |
= |
RT |
|
= 8,61 10−4 |
T ; |
(47) |
||
F |
||||||||
|
|
|
|
|
|
|||
при 298 К b0=0,0258 В.
В зависимости от природы и свойств электродов, из которых составлена электрохимическая система, различают химические и концентрационные цепи. В химических цепях электроды отличаются друг от друга химическими свойствами. В этих цепях источником электрической энергии служит химическая реакция. Различают химические цепи с двумя и одним электролитом. К электрохимическим элементам с двумя электролитами относится элемент Даниэля-Якоби.
125
Химические цепи с одним электролитом могут быть двух видов. В цепях первого вида на одном электроде протекает реакция с участием катиона электролита (электрод первого рода), а на другом электроде – с участием аниона электролита (электрод второго рода). Так, например, в химической цепи:
(−)Zn | ZnCl2(aq) | Hg2Cl2 ,Hg(+)
на положительном и отрицательном электродах протекают реакции:
_
(+)Hg2Cl2( т) + 2e 2Hg(т) + 2Cl−
_
(−)Zn2+ + 2e Zn( т)
суммарная реакция в электрохимическом элементе имеет вид: Hg2 Cl2( т) + Zn(т) 2Hg( т) + 2Cl− + Zn2+
В элементах второго вида с одним электролитом на обоих электродах, протекают реакции с участием одного и того же аниона электролита. Один электрод – газовый, другой – второго рода. Примером может служить элемент:
(-)Hg, Hg2Cl2|KCl(aq)|Cl2, Pt(+)
Реакции на электродах:
|
_ |
|
|
|
(+)Cl2 + |
2e |
2Cl− |
|
|
|
_ |
|
|
|
(−)Hg2Cl2(т) + 2e 2Cl− + 2Hg( т) |
||||
Суммарная реакция в элементе: |
|
|
|
|
2Hg( т) +Cl2(г) Hg2 Cl2( т) |
||||
Для ЭДС цепи имеем |
|
|
|
|
E = E+ − E− = E0 − |
|Cl2 |
− E0 − |
= E0 |
|
|
Cl |
Cl |
|Hg2Cl2 ,Hg |
|
В этом элементе ЭДС не зависит от концентрации электролита (KCl) и равна стандартной ЭДС
Е=1,360-0,268=1,092 В
Химические цепи с одним электролитом широко применяются в физикохимических исследованиях из-за отсутствия в них диффузионного потенциала.
126
Концентрационные электрохимические цепи состоят из электродов с одинаковыми потенциалопределяющими реакциями, которые отличаются друг от друга активностями участвующих в них веществ. В связи с этим концентрационные цепи делятся на две группы:
а) цепи, в состав которых входят два электролита с различной активностью ионов, например:
М|МА||МА|М
а1 |
а2 |
б) цепи с одним электролитом и с электродами, отличающимися по |
|
количественному составу, например, с амальгамными или газовыми: |
|
(Hg)M|MZ+|M(Hg) |
|
a1 |
a2 |
Pt, H2|H+|H2, Pt
P1 P2
Процессы, протекающие в концентрационных электрохимических цепях, удобно рассмотреть на примере цепи первой группы. Потенциалопределяющие реакции на обоих электродах одинаковы:
_
MZ+ + z e M
Но вследствие различия в активностях ионов в растворах электродные потенциалы различны. Если a1<a2, то левый электрод будет иметь потенциал более отрицательный, чем правый. При отборе тока от концентрационной цепи на левом электроде идет растворение, а на правом – выделение металла. При этом изменяются активности ионов в растворах: а1 возрастает, а2 уменьшается.
Электрическая работа концентрационной цепи равна работе выравнивания активностей потенциалопределяющих ионов в растворах у электродов. В соответствии с этим э.д.с. цепи будет:
E = |
RT ln |
aM+z (2) |
||
|
||||
|
zF a |
+z |
(1) |
|
|
|
M |
|
|
127
Аналогичные уравнения справедливы для расчета э.д.с. концентрационных цепей с амальгамными и газовыми электродами. Для амальгамных цепей
Е = |
RT |
ln |
a1 |
, |
|||||
|
|
a 2 |
|||||||
|
ZF |
|
|
|
|||||
для цепей с газовыми электродами: |
|
|
|
|
|
|
|
|
|
E = |
|
RT |
ln |
P1 |
|
|
|||
|
|
P |
|
|
|||||
|
|
ZF |
|
|
|
|
|||
|
|
|
|
|
2 |
|
|||
Среди гальванических элементов, |
получивших большое практическое |
||||||||
применение, находит «сухой» элемент. Цинковый сосуд, в котором помещается этот элемент, представляет собой анод; катодом служит угольный стержень. Электролит содержит мелко размельченный MnO2, а также хлорид аммония; оба эти вещества участвуют в восстановительной реакции. Анодную и катодную реакции обычно описывают уравнениями:
_
Zn → Zn2+ + 2e
_
2MnO2 + 2NH+4 + 2e → Mn2 O3 + 2NH3 + H2 O
Выделяющийся на катоде аммиак образует с ионами цинка комплексный ион Zn(NH3 )24+ , и элемент может действовать до тех пор, пока не израсходуется один из реагентов. Обычно цинковую оболочку элемента делают достаточно толстой, чтобы предотвратить вытекание из нее электролита. Казалось бы, при нагревании сухого элемента или выдерживании его некоторое время в разомкнутом состоянии произойдет его регенерация, однако таким путем достигается лишь диффузия продуктов реакции от электродов, где повышение их концентрации приводит к перенапряжению, или возникновению обратного потенциала, который препятствует протеканию прямой реакции. Таким образом, «сухой» элемент невозможно регенерировать или перезарядить; и поэтому его называют первичным элементом.
Вторичными называют электрохимические элементы, основанные на легко обратимых электродных реакциях. Наиболее известным элементом
128
такого типа является свинцовый аккумулятор. На его электродах происходят обратимые реакции окисления и восстановления свинца
|
|
_ |
|
|
Pb( тв) +SO42− |
PbSO4( тв) + 2e |
(на аноде) |
|
|
_ |
|
PbO2( тв) |
+ 4Н+ +SO42− |
+ 2e PbSO4(тв) |
+ 2H2 О (на катоде) |
|
|
разрядка |
|
Pb(тв) |
+ PbO2(тв) + 4Н+ + 2SO42− 2PbSO4(тв) + 2Н2 О |
||
Электролитом в полностью заряженном свинцовом аккумуляторе является серная кислота (уд. вес 1,275). При работе свинцового аккумулятора сульфатные ионы и ионы свинца на каждом из электродов образуют сульфат свинца, и это понижает концентрацию серной кислоты в электролите. Поэтому удельный вес электролита позволяет судить о степени расходования запасенной в нем электрохимической энергии. После перезарядки свинцового аккумулятора исходный удельный вес сернокислого электролита восстанавливается. Промышленность выпускает также щелочные аккумуляторы. Наиболее распространенные из них никель-кадмиевые и никельжелезные аккумуляторы. Положительный электрод содержит гидроксид никеля, отрицательный электрод – соответственно кадмий или железо. Ионным проводником служит 20-23%-ный раствор КОН. Суммарные реакции в наиболее простом виде можно записать уравнениями:
заряд
2NiOOH + Cd + 2H2 O разряд 2Ni(OH)2 + Cd(OH)2 ; Е0э =1,45В
заряд
2NiOOH + Fe + 2H2 O разряд 2Ni(OH)2 + Fe(OH)2 ; Е0э =1,48В
К достоинствам никель-кадмиевых и никель-железных аккумуляторов относятся большой срок службы (до 10 лет) и высокая механическая прочность, к недостаткам – невысокие КПД и напряжение. Никель-железные аккумуляторы дешевле никель-кадмиевых, но имеют несколько худшие показатели на единицу массы. Они применяются для питания электрокар, погрузчиков и рудничных электровозов. Никель-кадмиевые аккумуляторы используются для питания аппаратуры связи, радиоприемников, магнитофонов.
129
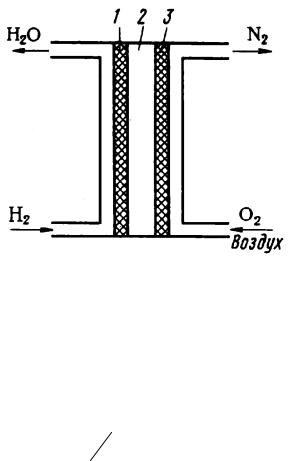
В последние годы затрачиваются большие усилия на создание топливных элементов (ТЭ). В ТЭ химическая энергия восстановителя (топлива) и окислителя, непрерывно и раздельно подаваемых к электродам, непосредственно превращается в электрическую энергию. В качестве восстановителя используют жидкие или газообразные вещества (водород, метан, метанол), а окислителя – кислород воздуха.
Рассмотрим работу ТЭ на примере кислородно-водородной системы с щелочным электролитом (рисунок 5).
1– анод;
2– электролит;
3– катод.
Рисунок 5 – Схема кислородно-водородного топливного элемента
В таком элементе происходит превращение химической энергии реакции окисления водорода:
Н2 + 12 О2 = Н2 О
вэлектрическую энергию. К аноду подводится топливо (восстановитель) в данном примере водород, к катоду – окислитель, обычно чистый кислород или кислород воздуха. Схема кислородно-водородного ТЭ может быть записана в виде:
H2 , M | KOH | M, O2 ,
130
