
КонспектЛекцХимияГорохов
.pdf
Перенося все значения концентраций в правую часть равенства, а постоянные К1 и К2 – в левую и обозначая их отношение через Кс имеем:
K1 |
= |
CHI2 |
= KC |
|
K2 |
CH2 CI2 |
|||
|
|
Постоянная Кс называется константой равновесия. Уравнение является выражением закона действия масс для рассматриваемой реакции. Этот закон был выведен подобным же путем Гульдбергом и Вааге.
Для гомогенных равновесных систем он формулируется следующим образом: произведение концентраций образовавшихся веществ, деленное на произведение концентраций исходных веществ, в равновесной системе при постоянной температуре есть величина постоянная, называемая константой равновесия. В уравнении закона действующих масс концентрации всех веществ записываются в степени, равной их стехиометрическим коэффициентам в уравнении реакции. Предположим, что νА моль вещества А взаимодействует с
νВ моль вещества В с образованием νС моль вещества С и νД моль вещества Д по реакции:
νАА+νВВ νСС+νДД |
|
|||
Тогда имеем: |
|
|
|
|
СνС СνД |
= const = К |
|
, |
(15) |
С Д |
С |
|||
СνАА СνВВ |
|
|
|
|
где СА, СВ, СС, СД – равновесные концентрации веществ;
νА , νВ , νС , νД – стехиометрические коэффициенты;
Кс – константа равновесия.
Если во взаимодействии участвуют газообразные вещества, то равновесие количественно может быть охарактеризовано не через концентрации, а через равновесные давления:
РνС РνД |
= const = К |
|
, |
(16) |
|
С Д |
|
||||
РνАА РνВВ |
Р |
||||
|
|
|
где РА, РВ, РС, РД – равновесные давления участников реакции;
51

Кр – константа равновесия.
Какую информацию несет величина константы равновесия? Прежде всего она позволяет судить относительно содержания реагентов и продуктов реакции в равновесной системе. Например, сравнение двух величин констант при разных температурах Кр=100(25 0С) и Кр=0,01(300 0С) показывает, что при низкой температуре в равновесной смеси больше продуктов реакции С и Д, тогда как при высокой температуре преобладают реагенты – А и В. Это, в свою очередь, позволяет управлять процессом и проводить реакции так, как – диктуют потребности практики.
Различают гомогенные и гетерогенные химические реакции. Гомогенный
– значит однородный. Типичными гомогенными реакциями являются химические процессы в растворах и газах:
2СО(г) +О2(г) 2СО2(г)
|
С2 |
|
|
КС = |
|
СО2 |
|
С2 |
С |
О2 |
|
|
СО2 |
|
|
СН3СООН(р−р) СН3СОО(−р−р) + Н(+р−р) ,
К= ССН3СОО− СН+
СССН3СОО
Химические реакции, в которых реагирующие вещества находятся в различных фазах, называются гетерогенными. Достижение химического равновесия в такой системе соответствует существованию равновесных концентраций или равновесных давлений участников реакции. Однако индивидуальные химические соединения в твердом и жидком состояниях не меняют состава фазы при изменении условий равновесия, оставаясь 100%- ными по составу кристаллическими или жидкими соединениями. В то же время газы, участвующие в химическом равновесии, меняют концентрацию при изменении внешних условий (изменение температуры, объема). Поэтому в гетерогенных химических реакциях в выражение константы равновесия учитываются только переменные равновесные концентрации (равновесные давления) участников реакции. Например,
52
2HgO(к) 2Hg(ж) +О2(г) |
KC |
= CO2 ; |
|
К |
|
СаСО3(к) СаО(к) +СО2(г) |
KC |
= CCO2 ; |
|
К |
|
BaSO4(к) Ba(2p+−p) +SО4(2−p−p) |
KC |
= C |
2+ C |
SO |
2− |
|
|
Ва |
|
4 |
|
|
|
|
|
|
|
p = PO2
р = РСО2
Несмотря на то, что константы равновесия гетерогенной реакции выражается через парциальные давления газообразных реагентов (О2 и СО2) величина Кр будет зависеть от свойств всех участников реакции (HgO и Hg; CaCO3 и CaO). Так, при термодинамической диссоциации MgCO3 и CaCO3 выражение для константы равновесия одно и то же, Кр = РСО2 , но величина ее различна, так как химические потенциалы MgCO3 и MgO отличаются от химических потенциалов СаСО3 и СаО.
На основании термодинамических расчетов, которые здесь опускаются, для реакции
аА + вВ сС+ dD
установлена взаимосвязь между функцией Гиббса и неравновесными концентрациями реагентов и продуктов реакции (уравнение изотермы)
∆G = RT(ln |
|
P |
'c |
P'd |
|
−ln Kp) |
(17) |
|
C |
D |
|
||||
|
a |
b |
|||||
|
|
P |
' |
P' |
|
|
|
|
|
A |
B |
|
|
|
|
∆F = RT(ln |
CC'c |
C'Dd |
|
−ln Kc) |
(18) |
||
|
|
a |
b |
|
|||
|
C'A |
C'B |
|
|
|
||
где Рi’ и Ci’ – неравновесные давления и неравновесные концентрации реагентов и продуктов реакции.
Всякое равновесие лишь относительно и временно. С изменением внешних условий (Т, Р, С) состояние системы изменяется. Применительно к химическому равновесию это означает, что равновесие сдвигается в сторону образования в большем количестве либо продуктов реакции, либо реагентов. Рассмотрим влияние изменений концентраций участников реакции на смещение химического равновесия. Для этого воспользуемся (17). Величина и знак ∆G представляет собой показатель свойства, по которому можно судить о направлении смещения химического равновесия. При ∆G < 0 неравенство
53

показывает, что в реакционной смеси имеется избыток реагентов (А и В) и недостаток продуктов (С и D) по сравнению с равновесным состоянием.
−RT ln Kc + RT ln |
CC'c |
C'Dd |
< 0 KC > |
CC'c |
C'Dd |
a |
|
a |
|
||
|
C'A C'Bb |
|
C'A C'Bb |
||
В этом случае реакция будет идти самопроизвольно в направлении уменьшения концентрации реагентов и увеличения концентрации продуктов до равновесного состояния при котором ∆G = 0 .
При ∆G > 0 получаем:
|
|
CC'c C'Dd |
CC'c C'Dd |
||||
−RT ln Kc |
+ RT ln |
|
|
|
> 0 KC < |
|
|
|
a |
|
a |
||||
|
|
C'A |
C'Bb |
C'A C'Bb |
|||
Неравенство показывает, что |
в |
реакционной |
смеси имеется избыток |
||||
продуктов реакции по сравнению с равновесным состоянием и самопроизвольное прохождение реакции в прямом направлении невозможно. Реакция пойдет в обратном направлении до тех пор, пока не будет достигнуто равновесие, при котором ∆G = 0 . В состоянии равновесия:
Кс = C'Cc C'Dd C'Aa C'Bb
процессы превращения реагентов в продукты реакции и наоборот продуктов реакции в реагенты не прекращается. Прямая и обратная реакции идут, но с одинаковыми скоростями.
Для оценки влияния температуры на состояние равновесия системы используется уравнение изобары химической реакции:
|
|
|
d lnK |
= |
∆Η |
|
|
|
|
(19) |
||||
|
|
|
|
|
RT2 |
|
|
|
|
|||||
|
|
|
|
dT |
|
|
|
|
|
|
|
|||
|
KT |
|
|
∆Η 1 |
|
|
1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(20) |
ln K |
|
|
= − |
|
|
|
|
|
||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
1 |
|
|
2 |
|
|||
Решение уравнения приводит к выражению (20), где ∆Н - изменение энтальпии химической реакции; КТ1 и КТ2 - константы равновесия химической реакции при температурах Т1 и Т2 соответственно.
54
Соотношение позволяет вычислить изменения энтальпии реакции по двум константам равновесия KT1 и KT2 или вычислить константу равновесия при заданной температуре, если известно изменение энтальпии реакции и константы равновесия при другой температуре.
Неопределенное интегрирование уравнения изобары химической реакции
приводит к зависимости К от Т: |
|
|
|
|
|
|
ln К = − |
∆Η |
|
1 |
+ const |
(21) |
|
R |
T |
|||||
|
|
|
|
В координатах ln К- T1 уравнение представляет собой прямую линию,
наклон которой зависит от знака и величины энтальпии реакции.
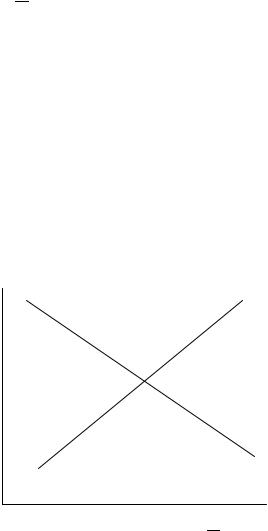
Анализ уравнения показывает, что для экзотермической реакции (∆Н 0)
увеличение температуры ведет к уменьшению константы равновесия, т. е. к уменьшению содержания продуктов реакции и увеличению содержания реагентов в равновесной смеси. Это означает смещение первоначального равновесия в сторону обратной реакции, которая является эндотермической
(∆Н 0) .
lnKp |
1 |
|
∆Н 0 |
2
∆Н 0
Т1 103
1– экзотермический процесс;
2– эндотермический процесс
Рисунок 2 – Зависимость константы равновесия от температуры
55
Для эндотермической реакции (∆Н 0) увеличение температуры ведет к увеличению константы, т. е. к увеличению содержания продуктов реакции в равновесной смеси, что означает смещение равновесия в сторону прямой реакции, для которой как было принято, ∆Н 0 . Равновесие химической реакции всегда смещается при увеличении температуры в сторону эндотермического процесса. Влияние концентрации и температуры на смещение химического равновесия обобщено в принципе Ле-Шателье-Брауна.
56
8 Кинетика химических реакций
Общие понятия и определения.
Термодинамический и кинетический критерий реакционной способности химической системы.
Скорость химической реакции.
Факторы, влияющие на скорость химической реакции (концентрация, температура, катализаторы, среда и др.).
Химическая кинетика – учение о химическом процессе, его механизме и закономерностях развития во времени.
Все химические процессы, наблюдаемые в природе и осуществляемые человеком в его практической деятельности, протекают во времени с определенными скоростями. Часто в химической системе, содержащей исходные химические вещества, могут протекать химические реакции с образованием различных конечных продуктов. Например, из смеси углерода и водорода при определенных условиях (Р, Т, катализатор) могут быть получены альдегиды, органические кислоты, спирты и различные углеводороды. При осуществлении химического процесса стремятся проводить его так, чтобы выход какого-нибудь продукта был максимальным. Для этого надо создать такие условия, при которых скорость образования необходимого продукта будет значительно больше скоростей всех других возможных реакций.
Химическая кинетика, как и термодинамика, является теоретической базой химической технологии. Поэтому состояние и достижения науки в области кинетики и катализа в значительной степени определяют технический уровень производства в химической промышленности.
В последние десятилетия в значительной мере расширились возможности экспериментального исследования кинетики химических процессов в связи с развитием ряда физических методов (спектроскопических, радиоспектроскопических), позволяющих непосредственно, без проведения
57
сложных химических анализов, наблюдать и регистрировать ход химического превращения. Стали доступны количественному исследованию быстро протекающие химические процессы, заканчивающиеся за малые доли секунды, вплоть до пикосекундных реакций. Уникальные возможности для исследования сложных химических превращений в многокомпонентных системах открыли газо-жидкостная хроматография и жидкостная хроматография под высоким давлением. Огромное значение для современной химической кинетики имеет интенсивное развитие вычислительной техники, появление быстродействующих электронно-вычислительных машин. Благодаря им ведется статистическая обработка больших массивов экспериментальных данных по кинетике химических превращений, рассчитывается протекание процессов, описываемых системами большого числа дифференциальных и алгебраических уравнений, появилась возможность математического моделирования реакторов. На базе законов химической кинетики осуществляется подбор высокоэффективных катализаторов.
Рассмотрим какую-нибудь химическую систему, например, смесь СО и Н2 в определенных соотношениях. В этой системе могут протекать различные химические реакции. Встает ряд вопросов: в каком направлении преимущественно будет идти химический процесс при заданных температуре и давлении? Какие условия надо создать, чтобы в результате процесса получить, например, метиловый спирт? Какие свойства системы определяют ее реакционную способность?
Реакционная способность химической системы при заданных условиях характеризуется скоростью и возможной глубиной химической реакции. Направление и глубина химической реакции определяется законами химической термодинамики, согласно которым условия направленности и равновесия химической реакции при постоянных Р и Т записываются в форме ∆r G ≤ 0. В качестве меры химического средства реакции принимается значение нормального (стандартного) сродства ∆r G0 (298). Нормальное сродство может быть меньше и больше нуля. Термодинамически наиболее вероятны реакции, у
58
которых значение нормального средства наиболее отрицательны. Однако химическое сродство определяет только возможную глубину процесса, но не характеризует полностью реакционную способность системы. Примером этого является смесь Н2 и О2, для которой ∆r G(298) ≈ ∆r G0 (298) = −228,61кДж,
следовательно, реакция должна идти практически до конца. Опыт же показывает, что смесь Н2 и О2 при нормальных условиях может существовать практически неограниченно долгое время без заметного образования воды. Таким образом, реакционную способность химической системы нельзя характеризовать только значением ∆r G(Т) . Термодинамическое условие протекания реакции ∆r G 0 при постоянных Р и Т можно принять как термодинамический критерий реакционной способности химической системы. Это условие является обязательным, но не достаточным. Если в смесь Н2 и О2 ввести катализатор в виде платиновой черни, то реакция заканчивается в течение долей секунды. Это указывает на то, что есть еще какие-то факторы, которые ускоряют химический процесс и тем самым дают возможность за короткий отрезок времени проявиться химическому сродству, или, наоборот, затрудняют реакцию, и термодинамические возможности не реализуются. Что же можно выбрать в качестве характеристики кинетического критерия реакционной способности химической системы? Наиболее общим кинетическим критерием реакционной способности химической системы является, конечно, скорость реакции.
Химическая реакция (химический процесс) состоит в превращении одного или нескольких химических веществ, называемых исходными веществами, в одно или несколько других химических веществ, называемых продуктами реакции. В большинстве случаев химический процесс осуществляется не просто путем прямого перехода молекул исходных веществ в молекулы продуктов реакции, а состоит из нескольких стадий. В качестве примера рассмотрим окисление Fe2+ молекулярным кислородом в кислом растворе. Стехиометрическое уравнение реакции записывается в виде:
59
4Fe2+ + 4H+ +O2 → 4Fe3+ + 2H2 O
Прямое столкновение 9 частиц, восемь из которых имеют положительный заряд – событие крайне маловероятное. Более вероятным является протекание приводимой ниже последовательности стадий:
•
Fe2+ +O2 Fe3+ +О−2
••
+Н+ НОО−
2 |
2 |
•
Fe2+ + НО2 → Fe3+ + НО−2
НО−2 + Н+ Н2 О2
•
Fe2+ + Н2 О2 → FeОΗ2+ + ОН
•
Fe2+ +ОН → FeОΗ2+
FeОΗ2+ + Н+ Н2 О+ Fe3+
требуется взаимодействие двух частиц (взаимодействие одноименно заряженных, последняя стадия). Совокупность стадий, из которых складывается химическая реакция, называется механизмом или схемой химической реакции.
Количественные характеристики и закономерности протекания химической реакции во времени неразрывно связаны с их механизмом. В этом состоит отличие кинетических (временных) характеристик химической реакции от термодинамических характеристик – ∆Η, ∆S, ∆G, Кр , Кс – не зависящих от
пути, по которому протекает химическая реакция.
Характерной особенностью большого числа сложных химических реакций является образование промежуточных частиц. Они могут быть реакционно-способными валентнонасыщенными молекулами (Н2О2), ионами
• |
• |
• |
(НО -), свободными радикалами ( НО2 |
, ОН), ионами радикалами (О− ). |
|
2 |
|
2 |
Химическая реакция, протекающая в пределах одной фазы называется гомогенной, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. Сложная химическая реакция, в которой одни стадии
60
