
Произведение растворимости (пр)
В насыщенном растворе малорастворимого электролита произведение концентраций его ионов, возведённых в степень их стехиометрических коэффициентов, есть величина постоянная при данной температуре и называется произведением растворимости (ПР). Так, в насыщенном растворе малорастворимого электролита PbI2 устанавливается динамическое равновесие:
PbI2(тв)
![]() + 2
+ 2![]() .
.
Количественно это равновесие характеризуется константой равновесия:
 .
.
Т.к. малорастворимый электролит PbI2 находится в твердой фазе, его концентрацию принимаем равной единице:
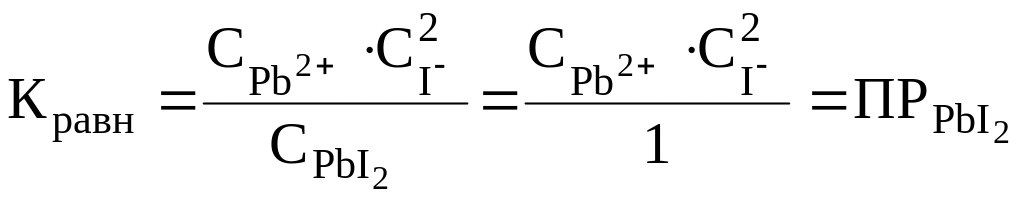 .
.
Таким образом, из закона действующих
масс, получаем выражение для ПР, которое
равно произведению концентраций ионов
электролита в растворе:
![]() =
[Рb2+] [I–]2.
Значения ПР определены при стандартной
температуре и приведены в справочниках.
Величины ПР некоторых соединений
приведены в табл. 1 Приложения. Так, для
йодида свинца при t = 25°С
= 8,7∙10−9.
=
[Рb2+] [I–]2.
Значения ПР определены при стандартной
температуре и приведены в справочниках.
Величины ПР некоторых соединений
приведены в табл. 1 Приложения. Так, для
йодида свинца при t = 25°С
= 8,7∙10−9.
Если малорастворимый электролит, записанный в общем виде как AmBn, диссоциирует по уравнению
AmBn mА+ + nВ–,
то выражение для произведения растворимости будет иметь вид:
![]() .
.
Величина ПР характеризует растворимость
малорастворимого вещества: чем больше
ПР, тем выше растворимость. Например,
йодид свинца хуже растворяется в воде,
чем хлорид свинца (
= 8,7∙10−9 <
![]() = 2,4∙10−4).
= 2,4∙10−4).
1. Условие растворения осадка. Произведение концентраций ионов, возведённых в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости
![]() .
.
2. Условие образования осадка. Произведение концентраций ионов, возведённых в степень стехиометрических коэффициентов, должна быть больше величины произведения растворимости
![]() .
.
Пример 1. Смешивают равные объёмы 0,01 М растворов AgNО3 и NaCl. Будет ли выпадать осадок AgCl, если ПРАgС1 = 1,610–10 (табл. 1)?
Суммарный объём раствора вдвое больше
объёма каждого из исходных растворов.
Следовательно, после смешивания
концентрация ионов Ag+
и Cl– будет вдвое
меньше по сравнению с исходной, т.е.
![]() = 0,005 = 510–3
и
= 0,005 = 510–3
и
![]() = 0,005 = 510–3
моль/л. Находим произведение концентраций
Ag+ и Cl– при
смешивании:
=
2,510–5. Так как
произведение
=
2,510–5 больше
ПРАgС1 = 1,610–10,
то осадок выпадает.
= 0,005 = 510–3
моль/л. Находим произведение концентраций
Ag+ и Cl– при
смешивании:
=
2,510–5. Так как
произведение
=
2,510–5 больше
ПРАgС1 = 1,610–10,
то осадок выпадает.
Ионное произведение воды (Кв). Водородный показатель (рН)
Вода, являясь очень слабым электролитом, диссоциирует на ионы:
Н2О H+ + ОН.
Произведение концентраций ионов H+ и ОН– при данной температуре есть величина постоянная и называется ионным произведением воды (Кв)
Kв = [H+] [ОН–] = 10–14 при 25 C.
Величина Kв изменяется в зависимости от температуры. Так, при температуре 100 С Kв = 7410–14. В водных растворах реакция среды зависит от соотношения концентрации ионов H+ и ОН–. В нейтральной среде [H+] = [ОН–] = 10–7 моль/л; в кислой среде [H+] > [ОН–] при [H+] > 10–7 моль/л: в щелочной среде [H+] < [ОН–] или [H+] < 10–7 моль/л. Вместо концентрации ионов водорода пользуются водородным показателем рН:
рН = –lg[H+].
В нейтральной среде рН = 7, в щелочной среде рН > 7, в кислой среде рН < 7. Для приблизительного определения рН используют разные индикаторы, например, лакмус, фенолфталеин, метиловый оранжевый и др.
Пример 2. Вычислите рН 0,0001 н раствора NaOH. Гидроксид натрия полностью диссоциирует на ионы.
Водный раствор NaOH, имеющий концентрацию 0,0001 н содержит гидроксид-ионов 10–4 моль/л; Следовательно, концентрация Н+ будет
[Н+] = Кв/[ОН–] = 10–14/10–4 = 10–10 моль/л.
Отсюда pH = –lg[H+] = –lg[10–10] = 10
