
Реакции обмена в растворах электролитов
В водных растворах все реакции обмена между электролитами, протекающие без изменения степени окисления, являются реакциями между ионами. Направление таких реакций определяется уменьшением концентрации реагирующих ионов. Последнее может привести к необратимой или обратимой реакции обмена.
Если в результате взаимодействия ионов образуются
малорастворимые электролиты, выпадающие в осадок,
газы,
растворимые слабые электролиты,
комплексные ионы,
то такие реакции практически идут до конца и называются необратимыми. Необратимые реакции сопровождаются уменьшением энергии Гиббса.
Реакции, в которых хотя бы одно из исходных и конечных веществ – растворимый слабый электролит или малорастворимый электролит в виде осадка, протекают не до конца и называются обратимыми. Равновесие этих реакций смещено в сторону образования более слабого (с меньшей Кд) или менее растворимого (с меньшим ПР) электролита. К обратимым реакциям обмена применим принцип Ле Шателье. Изменение энергии Гиббса таких реакций может быть меньше нуля, больше нуля или примерно равно нулю.
Сущность происходящего процесса в реакциях обмена выражается ионно-молекулярными уравнениями. В ионно-молекулярных уравнениях растворимые сильные электролиты записывают в виде ионов, а растворимые слабые электролиты, малорастворимые вещества и газы – в виде молекул.
Пример 3. Составьте сокращенные ионно-молекулярные уравнения для реакций
HNO3 + NaOH = NaNO3 + H2O;
HNO3 + NН4OH = NН4NO3 + H2O;
NaHSO4 + NaOH = Na2SO4 + H2O;
FeS + 2HCl = FeCl2 + H2S.
Определите тип реакции (обратимая/необратимая). Для обратимого процесса определите направление смещения равновесия.
Реакция 1.
Вещество |
Класс |
Электролит |
|
|
HNO3 |
Кислота |
Кд = 3,7 > 1 |
Сильный |
Диссоциирует |
NaOH |
Основание |
Кд = 5,9 > 1 |
Сильный |
Диссоциирует |
NaNO3 |
Соль средняя |
Растворима |
Сильный |
Диссоциирует |
H2O |
|
Кд = 1,8∙10−16<1 |
Слабый |
Не диссоциирует |
Записываем уравнение в ионно-молекулярном виде:
H+
+
![]() +
Na+ + OH−
= Na+ +
+ H2O.
+
Na+ + OH−
= Na+ +
+ H2O.
Сокращаем одинаковые частица в левой и правой частях уравнения. Записываем сокращенное ионно-молекулярное уравнение:
H+ + OH− → H2O.
Слабый электролит (вода) находится только в одной части уравнения, следовательно, реакция необратимая.
Реакция 2.
Вещество |
Класс |
Электролит |
|
|
HNO3 |
Кислота |
Кд = 3,7 > 1 |
Сильный |
Диссоциирует |
NН4OH |
Основание |
Кд = 1,79∙10−5 > 1 |
Слабый |
Не диссоциирует |
NН4NO3 |
Соль средняя |
Растворима |
Сильный |
Диссоциирует |
H2O |
|
Кд = 1,8∙10−16<1 |
Слабый |
Не диссоциирует |
Записываем уравнение в ионно-молекулярном виде:
H+
+
+
NН4OH
=
![]() +
+ H2O.
+
+ H2O.
Сокращаем одинаковые частица в левой и правой частях уравнения. Записываем сокращенное ионно-молекулярное уравнение:
H+ + NН4OH ↔ + H2O.
Слабые электролиты содержатся и в левой (NН4OH, Кд = 1,79∙10−5), и в (H2O, Кд = 1,8∙10−16) правой части уравнения, следовательно, реакция обратимая. Равновесие обратимого процесса будет смещено к воде как к более слабому электролиту
Реакция 3.
Вещество |
Класс |
Электролит |
|
|
NаHSO4 |
Соль кислая |
|
|
|
NaOH |
Основание |
Кд = 5,9 > 1 |
Сильный |
Диссоциирует |
Nа2SO4 |
Соль средняя |
Растворима |
Сильный |
Диссоциирует |
H2O |
|
Кд = 1,8∙10−16<1 |
Слабый |
Не диссоциирует |
Диссоциация кислых и основных солей протекает ступенчато.
NаHSO4 ↔ Na+ +
 ;
;↔ H+ +
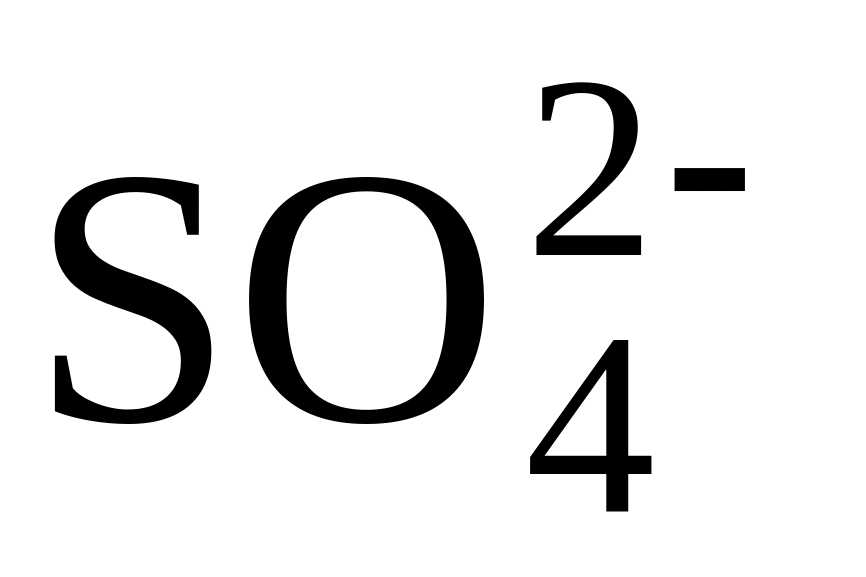 .
.
Первая ступень – разрушение полярной связи, аналогичной связям в соответствующей средней соли Nа2SO4, т.е. по первой ступени процесс протекает. Вторая ступень диссоциации будет совпадать со второй ступенью диссоциации соответствующей кислоты (или основания для основных солей). В рассматриваемом случае – с Н2SO4:
H2SO4 ↔ Н+ + ;
 =
1,0 103;
=
1,0 103;↔ H+ + ;
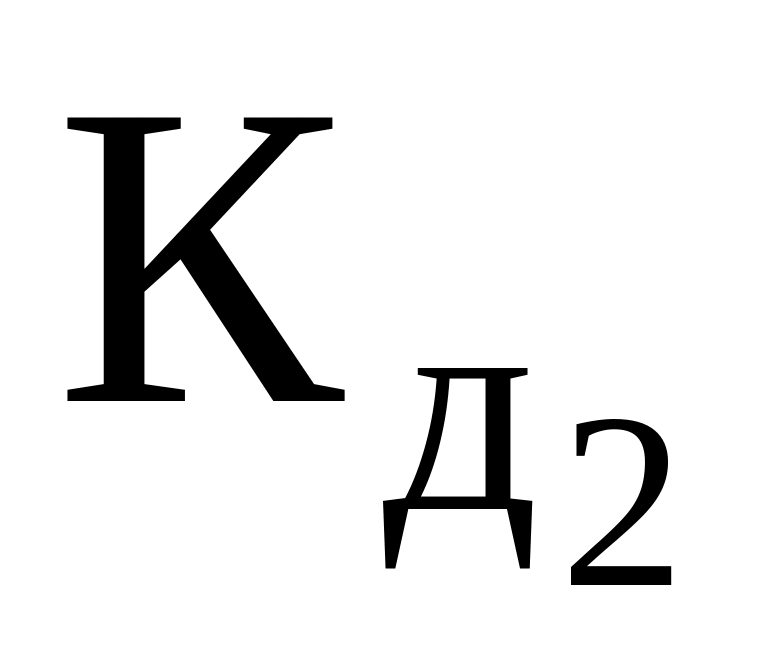 =
1,2∙10−2<1 (слабый электролит, не
диссоциирует).
=
1,2∙10−2<1 (слабый электролит, не
диссоциирует).
Следовательно, в водном растворе кислая соль будет диссоциировать только по первой ступени.
Na+ + + Na+ + OH− = 2 Na+ + + H2O,
+ OH− ↔ + H2O,
И в исходных веществах ( , = 1,2∙10−2), и в продуктах реакции (H2O, Кд = 1,8∙10−16) содержатся слабые электролиты, следовательно, реакция обратима, равновесие смещено вправо – в сторону воды.
Реакция 4.
Вещество |
Класс |
Электролит |
|
|
FeS |
Средняя соль |
Нерастворима ПРFeS=5,0∙10−18 |
Слабый |
Не диссоциирует |
HCl |
Кислота |
Кд = 1∙107 > 1 |
Cильный |
Диссоциирует |
FeCl2 |
Средняя соль |
Растворима |
Сильный |
Диссоциирует |
H2S |
Кислота |
|
Слабый |
Не диссоциирует |
Составляем полное и сокращенное ионно-молекулярные уравнения:
FeS + 2 H+ + 2 Cl− = Fe2+ + 2 Cl− + H2S;
FeS + 2 H+ ↔ Fe2+ + H2S.
Реакция обратима, т.к. слабые электролиты содержатся в обеих частях уравнения: в исходных веществах – нерастворимая соль FeS (ПРFeS=5,0∙10−18), выпадающая в осадок, в продуктах – слабая кислота H2S ( = 6,84∙10−23). Реакция преимущественно будет протекать в сторону образования более слабого электролита – кислоты H2S (6,84∙10−23 < 5,0∙10−18). Т.е. сульфид железа можно растворить в соляной кислоте.
