
КонспектЛекцХимияГорохов
.pdf
являются гомогенными, а другие гетерогенными называется гомогенногетерогенной. Примером гомогенной реакции может служить любая реакция в растворе, примером гетерогенной реакции, любая реакция, идущая на поверхности твердого катализатора, примерами гомогенно-гетерогенных реакций – некоторые реакции между газами, отдельные стадии которых протекают на стенках реакционного сосуда.
Важнейшей количественной характеристикой протекания химической реакции во времени является скорость реакции. Понятие скорости реакции должно характеризовать количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени.
В замкнутой системе, где изменение количества вещества происходит только в результате химической реакции, это изменение может быть
определено как dndt , где n – число молей рассматриваемого вещества в момент
времени t. Численное значение этой производной зависит от природы процесса, условий его протекания и от взятого количества исходных веществ.
На скорость реакции, прежде всего, влияет концентрация реагирующих веществ. Во многих случаях скорость реакции пропорциональна концентрации реагирующих веществ ci, возведенных в соответствующие степени ni (это число не следует отожествлять с количеством вещества):
W = K C1n1 Cn22 ... , (22)
где К- коэффициент пропорциональности – константа скорости реакции, она не зависит от концентрации реагирующих веществ и времени.
Показатели степени n1, n2,… определяются по опытным данным. Уравнение (22) называют дифференциальным уравнением скорости химической реакции. Из уравнения вытекает, что при С1=С2=Сi=1 скорость реакции численно равна константе скорости (ее называют иногда удельной скоростью).
Сумма ∑ni = n называется общим порядком реакции. Показатели степеней ni, в которые возводятся концентрации реагирующих веществ в
61
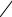
дифференциальном уравнении скорости реакции, определяют порядок реакции по i-му реагенту. В простых реакциях, протекающих в одну стадию, ni – целое, положительное число равное 1, 2, редко 3. В сложных химических процессах ni могут быть равны 0, иметь как целочисленные, так и дробные, положительные и отрицательные значения. Наблюдаемая на опыте скорость химической реакции является совокупностью множества протекающих за единицу времени элементарных химических актов. Элементарным химическим актом называют единичный акт взаимодействия частиц (молекул, ионов, атомов, радикалов и др.), в результате которого образуются новые частицы продуктов реакции или промежуточных соединений. Число молекул, участвующих в элементарном химическом акте, называют молекулярностью реакции. Молекулярность реакции всегда целое положительное число 1, 2, реже 3. Элементарных химических актов с одновременным участием 4-х молекул не бывает (очень мала вероятность столкновения 4-х частиц). В простых реакциях, элементарный химический акт в которых протекает в одну стадию, молекулярность совпадает с порядком реакции. В большинстве случает молекулярность и порядок реакции не совпадают. Совпадение порядка и молекулярности обычно носит случайный характер и ему не следует придавать какого-либо физического смысла. Судить о молекулярности по стехиометрическому уравнению нельзя, между ними нет никакой связи.
С повышением температуры скорость реакции возрастает. Согласно правилу Вант-Гоффа при повышении температуры процесса на 10 0С скорость реакции в области умеренных температур увеличивается в 2-4 раза.
Аррепиус показал, что зависимость константы скорости от температуры может быть выражена уравнением:
d lnK |
= |
Ea |
, |
(23) |
|
dT |
RT2 |
||||
|
|
|
где Еа – энергия активации реакции.
Приняв положение о независимости Еа от Т и проинтегрировав, получим:
К = А e |
−Ea |
RT , |
(24) |
|
62
где А – постоянная интегрирования, предэкспоненциальный множитель. Определив константы скоростей при нескольких температурах, можно
рассчитать А и Еа. Из (24) получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2,3lg |
K1 |
= − |
Ea |
|
( |
1 |
− |
|
1 |
) |
(25) |
||||||
|
R |
|
|
|
|||||||||||||
|
K |
2 |
|
|
|
|
T |
|
T |
|
|||||||
|
|
|
|
|
|
|
1 |
|
2 |
|
|
|
|||||
Ea = 2,3R |
T1 T2 |
lg |
K1 |
|
(26) |
||||||||||||
|
|
K2 |
|||||||||||||||
|
|
|
|
|
T1 −T2 |
|
|||||||||||
Определив Еа по уравнению (26) найдем А. Уравнение (24) можно |
|
||||||||||||||||
записать в линейной форме: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
lg K = − |
|
Ea |
+ lg A |
(27) |
|||||||||||||
2,3RT |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Откладывая на оси абсцисс 1/Т, на оси ординат – lgK получим прямую. |
|||||||||||||||||
Тангенс угла наклона прямой будет равен: |
|
|
|
|
|
|
|
|
|
||||||||
tgβ = −Ea / 2,3R |
|
|
|
|
|
||||||||||||
|
Еа |
= −2,3Rtgβ |
|
|
|
|
(28) |
||||||||||
Величины Еа и А в уравнении Аррениуса мало изменяются с температурой. В небольшом температурном интервале они практически постоянны. В подавляющем большинстве случаев Еа 0 , однако имеются реакции Еа ≈ 0 и даже меньше нуля.
Сильное влияние на скорость химической реакции оказывают некоторые вещества – катализаторы. Катализаторы, образуя с реагентами промежуточные продукты, повышают скорость химических процессов на много порядков, выделяясь в конце реакции в неизменном химическом состоянии. Ионы Mn2+, Cu2+, MоO42-, WO42- и другие в очень незначительных количествах каталитически ускоряют некоторые окислительно-восстановительные реакции. На этом основаны кинетические методы анализа, позволяющие определять эти металлы в количестве 10-12-10-14г. Многотонажные производства (NH3, H2SO4, HNO3, полимерных материалов, нефти) протекают в присутствии катализаторов. Многие катализаторы обладают свойствами селективности.
63
Большое влияние на скорость химических процессов оказывает среда, в которой протекает процесс. Например, скорость реакции:
С2 Н5 I +(C2 H5 )3 N → (C2 H5 )4 NI
внитробензоле почти в 3000 раз больше чем в гексане.
Имеется большая группа химических реакций – окисление молекулярным кислородом, хлорирование и бромирование органических соединений, реакции полимеризации и др., которые начинаются при наличии инициаторов реакции и протекают по цепному радикальному механизму.
Итак, главнейшими факторами, определяющими скорость химических реакций, в общем случае, является строение реагирующих молекул и их концентрация, температура, среда и катализаторы. Для ионных и фотохимических реакций появляются дополнительные факторы – наличие инициатора, характер и интенсивность облучения; для электрохимических реакций – потенциал и природа электродов, сила тока.
64
9 Дисперсные системы
Общие представления о дисперсности и гетерогенности. Классификация дисперсных систем по агрегатному состоянию фаз. Растворы.
Общая характеристика растворов. Растворимость.
Изменение энтропии и энтальпии при растворении. Способы выражения концентрации растворов.
Если в каком-либо веществе (среде) распределено в виде очень мелких частиц другое вещество, то такая система называется дисперсной. Дисперсность (раздробленность) – характеристика размеров частиц дисперсной фазы в дисперсных системах. Мерой раздробленности всякой дисперсной системы может служить либо поперечный размер частиц а (для сферических частиц – диаметр – d, а частиц, имеющих форму куба – ребро куба – l), либо обратная ему величина, т. е. 1/а. Эта величина носит название дисперсности D (D=1/а). Широко применяется и третья характеристика раздробленности – удельная поверхность Sуд, определяемая отношением межфазной поверхности к объему тела S/V. Все эти величины взаимосвязаны. Чем меньше размеры частиц, тем больше дисперсность или удельная поверхность, и наоборот.
Свойства дисперсных систем, в первую очередь их устойчивость, сильно зависят от размеров распределяемых частиц. Если последние очень велики по сравнению с молекулами, дисперсные системы непрочны и распределенное вещество самопроизвольно оседает вниз (или, если оно менее плотно, чем вещество среды, поднимается вверх). Подобные малоустойчивые дисперсные системы со сравнительно крупными распределенными частицами называются взвесями. Наоборот, если распределенное вещество находится в виде отдельных молекул, системы получаются вполне устойчивые, не
65
разделяющиеся при сколь угодно долгом стоянии. Такие системы называются молекулярными растворами (обычно просто растворами).
Наконец, промежуточную область занимают коллоидные растворы, в которых размеры распределенных частиц находятся между размерами частиц взвесей и молекулярных растворов. К коллоидным системам относятся системы, у которых значение а лежит в пределах 1-100 нм, а дисперсность – в пределах 1-100 нм-1. Верхний предел дисперсности коллоидной системы обусловлен тем, что при дальнейшем дроблении вещества в растворе уже будут находиться не агрегаты молекул, а отдельные молекулы, имеющие размер порядка 0,1 нм. Нижний предел дисперсности коллоидных систем определяется резким снижением интенсивности теплового движения частиц с поперечным размером больше 100 нм. Несмотря на установленный предел 100 нм в коллоидной химии рассматривают обычно и более грубодисперсные системы, размер частиц которых может достигать несколько микрометров (микрогетерогенные системы). К микрогетерогенным системам относятся порошки, суспензии, эмульсии, пены и ряд других систем, имеющих огромное практическое значение.
Для объектов коллоидной химии характерны два общих признака: гетерогенность и дисперсность. Эти признаки были выделены одним из основоположников отечественной коллоидной химии Н.Т. Песковым «…одна степень дисперсности не может считаться исчерпывающей характеристикой коллоидного состояния, одним из самых важных признаков коллоидности является многофазность системы, то есть существование в ней физических плоскостей раздела…». Гетерогенность, или многофазность, выступает в коллоидной химии как признак, указывающий на наличие межфазной поверхности, поверхностного слоя. Дисперсность является чисто количественным параметром, указывающим на степень раздробленности, размер межфазной поверхности; гетерогенность же в первую очередь указывает на качественную характеристику объектов. Объекты коллоидной химии
66
качественно отличаются от других наук гетерогенностью, наличием межфазной поверхности.
В зависимости от агрегатного состояния распределяемого вещества (дисперсной фазы) и среды возможны следующие 9 типов дисперсных систем. Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель – дисперсионной среды. Например, дробью т/ж обозначают системы с твердой дисперсной фазой и жидкой дисперсионной средой (твердое в жидкости). Одно из девяти сочетаний г/г в обычных условиях не может образовать коллоидной системы, так как газы при любых соотношениях дают истинные растворы.
Растворами называют однородные системы состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения однородности. Если привести в соприкосновение два или несколько веществ, то можно получить либо новые соединения, либо неоднородную смесь, либо, наконец, однородную систему. В первом случае протекает химическая реакция, во втором – механический процесс, в результате которого получается смесь. Третий же случай – процесс образования раствора – является промежуточным между химическим и механическими процессами. Благодаря отсутствию у растворов постоянства состава и из-за не применимости к ним законов стехиометрии растворы приближаются к механическим смесям. С химическими соединениями их роднит однородность; другим общим признаком являются довольно значительные объемные и энергетические эффекты, сопровождающие процесс растворения многих веществ. По агрегатному состоянию растворы бывают газообразные (воздух, газовые смеси), жидкие (морская вода), твердые (металлические сплавы).
Наибольшее практическое значение имеют жидкие растворы. В этих растворах обычно протекает большинство реакций, так как они создают благоприятные условия для перемещения молекул, для тесного их сближения и химического взаимодействия.
67
Таблица 2. Классификация дисперсных систем по агрегатному состоянию
Дисперсионная |
Дисперсная |
Условное |
|
|
обозначение |
Название системы и примеры |
|||
среда |
фаза |
системы |
|
|
|
|
|
||
|
Твердая |
Т/Т |
Твердые гетерогенные системы: |
|
|
|
|
минералы, бетон |
|
Твердая |
Жидкая |
Ж/Т |
Капиллярные системы: |
|
|
|
адсорбенты, почвы, грунты |
||
|
|
|
||
|
Газообразная |
Г/Т |
Пористые тела: адсорбенты и |
|
|
|
|
катализаторы в газах |
|
|
Твердая |
Г/Ж |
Суспензии и золи: промышленные |
|
|
|
|
суспензии, взвеси, пасты, илы |
|
Жидкая |
Жидкая |
Ж/Ж |
Эмульсии: нефть, кремы, молоко |
|
Газообразная |
Г/Ж |
Газовые эмульсии и пены: |
||
|
||||
|
|
|
флотационные, противопожарные, |
|
|
|
|
мыльные пены |
|
|
Твердая |
Т/Г |
Аэрозоли (пыли, дымы), порошки |
|
Газообразная |
Жидкая |
Ж/Г |
Аэрозоли: туманы, промышленные |
|
|
|
|
в том числе, облака. |
|
|
Газообразная |
Г/Г |
Коллоидные системы отсутствуют |
Растворы состоят из растворителя и растворенного вещества (веществ). Эти понятия условны. Если одним из составляющих растворов веществ является жидкость, а другие – газы или твердые вещества, то растворителем обычно считают жидкость. В других случаях растворителем считают тот компонент, которого больше.
Частицы растворенного вещества, находящиеся в растворе взаимодействуют друг с другом и с молекулами растворителя. Характер этого взаимодействия различен и зависит от типа частиц и природы сил, действующих между ними. В результате этого изменяются свойства системы. На это указывает, в частности, наличие тепловых ∆Η и объемных ∆V эффектов при растворении. Так, при смешении 1 л этилового спирта с 1 л воды объем образующегося раствора оказывается равным не 2 л, а 1,93 л (250 С). В данном случае уменьшение объема (на 3,5%) обусловлено в основном образованием
68
водородных связей между гидроксильными группами молекул спирта и воды, а также разрушением льдоподобных структур воды.
Если процесс растворения протекает с поглощением теплоты ( ∆Η 0 ), то в
соответствии |
с общим |
уравнением |
∆G = ∆Η −T∆S |
энтропия |
системы |
возрастает, т. |
е. ∆S 0 . |
Если же |
растворение |
является |
процессом |
экзотермическим ( ∆Η 0 ), то в соответствии с приведенным уравнением возможны два варианта: ∆S 0 и ∆S 0 . Первый вероятнее, но часто встречается и второй, т. к. в силу специфичности взаимодействия в растворе чем больше ∆Η, тем более должна быть упорядочена структура раствора.
При растворении всегда происходит взаимодействие растворенного вещества с растворителем, называемое сольватацией. Теплоту растворения можно рассматривать как сумму теплот соответствующего фазового перехода (ф. п.) и сольватации:
∆Ηр = ∆Ηф.п. +∆Ηсольв.
Аналогично для энтропии имеем:
∆Sр = ∆Sф.п. +∆Sсольв.
Для частного случая растворения кристаллических веществ в жидкости первое слагаемое в этих уравнениях соответствует разрушению кристаллической решетки, поэтому ∆Ηф.п 0 и ∆Sф.п 0 . Сольватация является процессом экзотермическим ( ∆Ηсольв 0 ), поэтому теплота растворения, будучи суммой ∆Ηф.п и ∆Ηсольв может иметь различный знак. Сольватация означает упорядочение состояния системы (происходит ориентация частиц). Следовательно, ∆Sсольв 0 , однако по абсолютной величине ∆Sсольв обычно невелико, поэтому растворение, как правило, сопровождается возрастанием энтропии.
Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого.
Процесс растворения идет самопроизвольно ( ∆G 0 ) и раствор остается ненасыщенным. Когда энтальпийный и энтропийный факторы станут
69
одинаковыми, т. е. ∆G = 0 , система окажется в состоянии истинного равновесия. В такой системе неопределенно долго могут существовать без каких-либо изменений раствор и избыток растворяемого вещества. Можно получить и пересыщенный раствор, т. е. такой, концентрация которого выше концентрации насыщенного раствора. Он представляет собой систему, находящуюся в кажущемся равновесии ( ∆G 0 ). Встряхивание или внесение в него кристаллов того же вещества вызывают кристаллизацию. Система переходит в состояние истинного равновесия, что сопровождается убылью энергии Гиббса.
Растворимость – наиболее изученное свойство растворов. Для различных веществ она колеблется в значительных пределах. Абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость крайне незначительна. Количественно растворимость вещества определяется его концентрацией в насыщенном растворе. К сожалению, до настоящего времени нет теории, с помощью которой можно было бы предсказать и вычислить растворимость. Это обусловлено сложностью взаимодействия частиц в растворе, а также отсутствием общей теории жидкого состояния. Остается справедливым старинное, найденное из многовекового опыта правило: «подобное растворяется в подобном».
Установлен ряд закономерностей, характеризующих влияние природы растворителя на растворимость. К их числу относится правило Семенченко, согласно которому максимум растворимости отвечает тому растворителю, молекулярное поле которого близко к молекулярному полю растворенного вещества.
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты (сольватация их молекул). Поэтому, согласно принципу Ле-Шателье, повышение температуры понижает растворимость газов. Так как при растворении газообразных веществ в жидкости ∆V 0 , то давление способствует росту растворимости газов. Эта зависимость выражается законом
70
