
- •Поликонденсация
- •Наиболее важные типы реакций поликонденсации
- •Общие закономерности поликонденсации
- •Практические способы проведения поликонденсации
- •Синтез монодисперсных полимеров путем поликонденсации
- •А. Нематричный синтез полипептидов
- •Б. Нематричный синтез полинуклеотидов
- •Матричный синтез полимеров с заданной первичной структурой
Матричный синтез полимеров с заданной первичной структурой
Как уже упоминалось (стр. 59), важнейшие биополимеры – белки и нуклеиновые кислоты - синтезируются в живом организме путем матричной поликонденсации. Для осуществления матричного синтеза полимера необходима макромолекула-матрица, несущая всю информацию о первичной структуре синтезируемой макромолекулы. В ходе синтеза происходит «считывание» этой информации, и разные мономеры вступают в реакции синтеза в определенном порядке. Для этого необходимо, чтобы каждый мономер «узнавал» то место на макромолекуле-матрице, где «записана» информация именно об этом мономере. Иными словами, необходимо некое структурное соответствие между молекулой мономера и соответствующим ему участком матрицы; это соответствие принято называть комплементарностью (в некоторых русскоязычных источниках встречается написание «комплиментарность»; дело, вероятно, в том, что английское слово сomplementary произносится как ‘komplimentry).
Принцип комплементарности макромолекулы-матрицы и синтезируемого полимера может быть использован для синтеза полимеров с определенной первичной структурой любым методом (и полимеризациейи поликонденсацией); ведутся исследования по матричному получению синтетических сополимеров. Однако до настоящего времени единственными эффективными примерами матричных синтезов полимеров являются синтезы белков и нуклеиновых кислот путем матричной поликонденсации. Все эти синтезы протекают в ходе генетических процессов, прежде всего – репликации, транскрипции и трансляции (синтез небольших участков ДНК протекает также в ходе еще одного генетического процесса – репарации).
Во всех этих случаях матрицей является макромолекула нуклеиновой кислоты: при репликации и транскрипции – ДНК, при трансляции – матричной (информационной) РНК. Комплементарное узнавание осуществляется: А. При репликации и транскрипции (а также репарации) - между нуклеотидными звеньями макромолекулы матрицы и мономерами (нуклеозидтрифосфатами); Б. При трансляции – между нуклеотидными звеньями макромолекулы - матрицы и нуклеотидными звеньями антикодонов. Это узнавание осуществляется путем образования водородных связей между гетероциклическими основаниями: для ДНК в парах аденин-тимин (A-T, Ade-Thy) и гуанин-цитозин (G-C, Gua-Cyt), для РНК – в парах аденин-урацил (А-U, Ade-Ura) и гуанин-цитозин. В парах А-Т и А-U образуются две водородные связи, в паре G-C – три:

Эти пары имеют абсолютно одинаковый размер (1,085 нм); это делает возможным построение регулярных вторичных структур (прежде всего, двойной спирали ДНК).
Репликация, транскрипция и трансляция начинаются и заканчиваются в строго определенных местах макромолекулы-матрицы (иначе говоря, для матричных синтезов существуют «старт-сигнал» и «стоп-сигнал»). Начало этих процессов называют инициацией, процесс формирования полимерной цепи – элонгацией, окончание – терминацией. Все эти процессы протекают при катализе несколькими ферментами.
Репликация. В ходе этого генетического процесса происходит удвоение молекул ДНК, т.е. копирование генетической информации. Суть процесса – расплетение двойной спирали ДНК на единичные цепи; каждая из них служит матрицей для синтеза новой (дочерней) цепи из мономеров – дезоксирибонуклеозид-5’-трифосфатов. Синтез катализируется ферментами ДНК-полимеразами, которые осуществляют линейный синтез (т.е. на каждой стадии формирования цепи взаимодействуют полимер и мономер) по направлению 5’→3’ (т.е. на каждой стадии реагируют 3’-концевая группа ОН полимера и 5’-трифосфатная группа мономера:
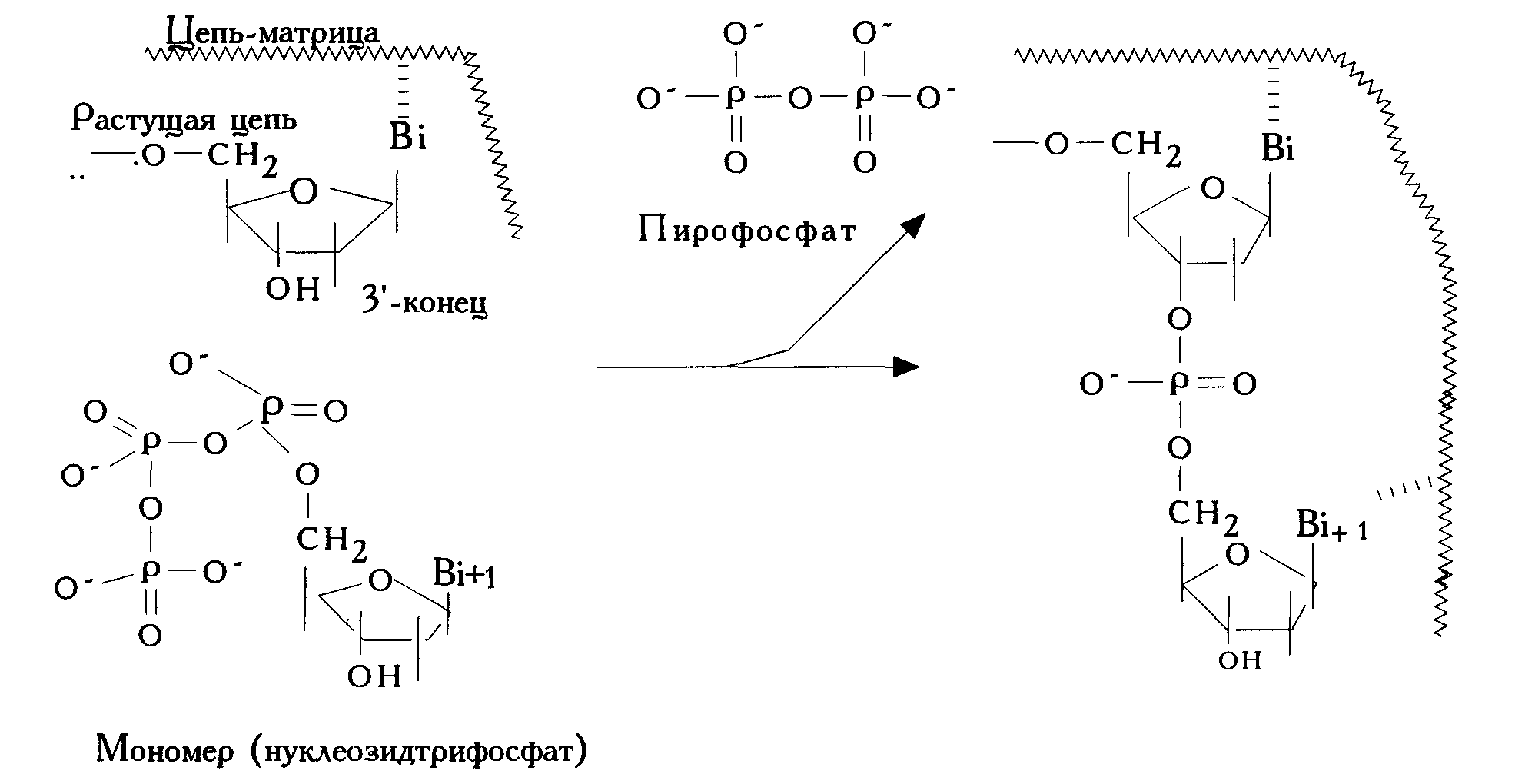
Поскольку каждый мономер узнает свой участок, дочерняя цепь представляет собой точную копию отделившейся [если в ходе синтеза все же к цепи присоединяется «неправильный» мономер (т.е. не комплементарный своему звену матрицы), то фермент осуществляет коррекцию – отщепляет это звено].
Двойная связь начинает расплетаться в каком-то определенном месте; синтез дочерних цепей начинается сразу вслед за началом расплетения двойной спирали; двойная спираль продолжает расплетаться, а вслед за расплетением (движением «репликативной вилки») идет наращивание дочерних цепей. При этом на двух одиночных цепях-матрицах синтез идет по разным схемам. Дело в том, что в двойной спирали исходной (материнской) ДНК цепи ориентированы антипараллельно; поэтому для одной цепи репликативная вилка движется в направлении 5’→3’ (эта цепь называется ведущей), а для другой – в направлении 3’→5’ (эта цепь называется отстающей). Поскольку синтез дочерней цепи может идти только в направлении 5’→3’, то на ведущей цепи она синтезируется в том же направлении, что и движение вилки, а на отстающей – в противоположном направлении. Поэтому на ведущей цепи идет непрерывный синтез «вдогонку» движению вилки, а на отстающей – прерывистый, в виде отдельных фрагментов, называемых фрагментами Оказаки (пока синтезируется один фрагмент, вилка движется в обратном направлении и освобождается место на матрице; тогда синтез этого фрагмента прекращается, и на освободившемся месте начинается синтез второго фрагмента и т.д.):
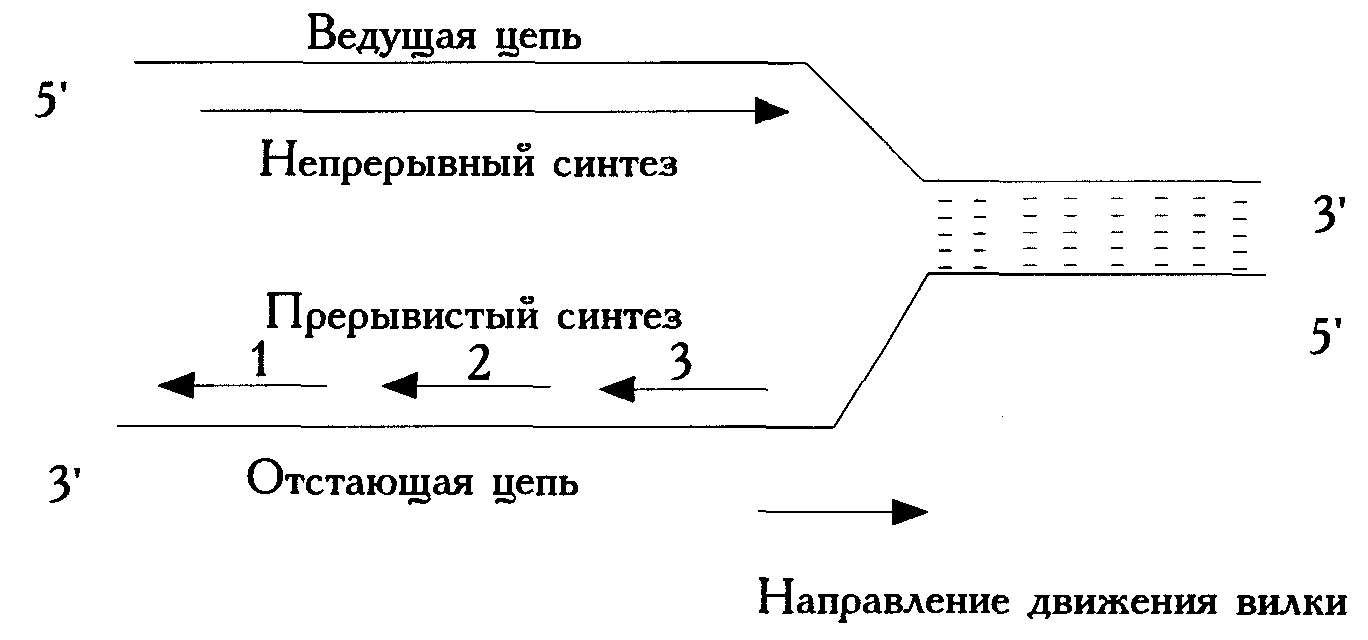
После окончания синтеза фрагменты Оказаки сшиваются специальными ферментами (лигазами) в одну цепь. Таким образом, на одной цепи (ведущей) идет чисто линейный синтез, а на другой – отстающей – блочный (конвергентный).
Дочерние цепи образуют с материнскими цепями двойные спирали– копии исходных двойных спиралей.
Полимеразная цепная реакция (амплификация фрагментов ДНК)
Относительно недавно (К. Маллис, 1988) разработана методика, позволяющая проводить процесс, подобный репликации, не в организме, а «в колбе» (in vitro). Такой процесс получил название полимеразной цепной реакции, ПЦР (Polymerase Chain Reaction, PCR). Полимеразная цепная реакция позволяет многократно увеличивать количество первоначально взятой ДНК; такое увеличение количества (размножение) принято обозначать термином «амплификация». Амплификации по способу ПЦР подвергается не вся нативная ДНК, а ее фрагменты, содержащие гены, интересующие исследователя. Для получения таких фрагментов нативную ДНК подвергают специфическому расщеплению (рестрикции) специальными ферментами – рестриктазами (будут рассмотрены в дальнейшем). Необходимое условие для амплификации: для амплифицируемого фрагмента должна быть известна первичная структура с 3’- концов обеих цепей примерно на 20-30 звеньев.
Для проведения полимеразной цепной реакции необходимо иметь праймеры – олигонуклеотиды длиной 20-30 звеньев, комплементарные первичным структурам обоих цепей с 3’ –концов. Синтез таких олигонуклеотидов разработан достаточно хорошо.
Для проведения ПЦР в реакционный сосуд помещают амплифицируемый фрагмент ДНК, прибавляют большой избыток обоих праймеров и мономеров – дезоксирибонуклеотид – 5’-трифосфатов - и вводят ДНК-полимеразу; обычно используют термостойкую полимеразу, выделенную из термобактерий. Смесь нагревают до 95 0С; при этом двойная спираль амплифицируемого фрагмента ДНК распадается на одиночные цепи; затем быстро охлаждают до 60 0С; при этом праймеры координируются с комплементарными им 3’-концами каждой цепи. Это более вероятно, чем воссоздание распавшейся двойной спирали, т.к. праймеры находятся в большом избытке. Праймеры, ассоциированные с цепями, служат затравками для матричного синтеза ДНК из мономеров, который катализируется ДНК-полимеразой. Синтез идет в направлении 5’→3’; на каждой цепи синтезируется комплементарная ей вторая цепь и, следовательно, количество ДНК удваивается. Далее цикл нагрев-охлаждение повторяется; каждая из макромолекул ДНК снова удваивается и т.д. Таким образом, удается провести несколько циклов и многократно увеличить количество ДНК; большой избыток праймеров и мономеров это позволяет сделать. Проведение ПЦР представлено на приведенной ниже схеме; для упрощения изображены праймеры длиной 7 звеньев, хотя в действительности они заметно длиннее (20-30 звеньев):

Синтез полинуклеотидных цепей идет, разумеется, по той же схеме (полимер + мономер), что и при обычной репликации (стр. 91).
Транскрипция. В ходе этого процесса происходит передача информации от ДНК на матричную (информационную) ДНК (а также на транспортные и рибосомальные РНК). Процесс имеет много общего с репликацией: макромолекула ДНК является матрицей для синтеза макромолекулы РНК из мономеров – рибонуклеозид-5’-трифосфатов; синтез также начинается с расплетения двойной спирали ДНК и протекает в направлении 5’→3’ по линейной схеме при катализе ферментами –РНК-полимеразами. Однако имеются и принципиальные особенности: 1) В отличие от репликации, матрицей служит только одна цепь исходной ДНК (так называемая минус-цепь); 2) Синтезируемая цепь не образует двойную спираль с молекулой-матрицей, а отделяется в виде единичной цепи; молекула-матрица снова образует двойную спираль с ранее отделившейся цепью ДНК (плюс-цепью): двойная спираль ДНК-ДНК устойчивее спирали ДНК-РНК:

И при репликации и при транскрипции синтезируются весьма высокомолекулярные полинуклеотидные цепи с высочайшей скоростью (у эукариот –1000-3000 звеньев в мин., у прокариот – до 50000 тыс. звеньев в мин.). А. Скорость процесса обусловлена: 1. Точной пространственной ориентацией реагирующих частиц: 5’-трифосфатная группа мономера точно подводится к 3’-ОН-концевому звену синтезируемой цепи; это происходит в процессе комплементарного узнавания; 2. Ферментативным катализом, который, как известно, наиболее эффективен. Матричный синтез нуклеиновых кислот, в отличие от нематричного, не требует защиты «лишних групп»: приведенные факторы обеспечивают абсолютную специфичность взаимодействия функциональных групп. Б. Высокая молекулярная масса синтезируемого полимера достигается полным удалением низкомолекулярного продукта реакции – пирофосфата, которых гидролизуется до фосфата [как уже упоминалось (стр. 72), синтез нуклеиновых кислот относится к равновесной поликонденсации].
Трансляция. Матричный биосинтез полипептидов. В ходе трансляции происходит передача генетической информации от матричной РНК (мРНК) на белок.
Матрицей для синтеза полипептидной цепи служит молекула мРНК; при этом возникает проблема перевода информации из 4- буквенного «алфавита» РНК на 20-буквенный «алфавит» полипептидной цепи (одно из значений термина «трансляция» – перевод). Иными словами, необходимо существование структурного соответствия между определенными участками РНК-матрицы и определенными мономерами для синтеза полипептидов - α-аминокислотами. Это соответствие получило название белкового кода. Код является триплетным: каждая аминокислота соответствует участку мРНК, содержащему три нуклеотидных звена; иначе говоря, она кодируется триплетом нуклеотидных звеньев; такой триплет называется кодоном. Совокупность всех кодонов – белковый код.
Белковый код является вырожденным – большинство α-аминокислот кодируется более чем одним кодоном. Кодоны, кодирующие одну и ту же аминокислоту, называют синонимичными; как правило, первые два звена синонимичных кодонов одинаковы, а третье различается: например, пролин (Pro) кодируется четырьмя кодонами: ССU, CCA, CCC, CCG. Из 64 кодонов (это число возможных сочетаний из четырех типов звеньев по три) 61 кодируют α-аминокислоты, а три не кодируют ничего; они называются терминальными или стоп-кодонами; на этих участках матрицы синтез полипептида останавливается. Код, как правило, не перекрывается, кодоны идут «встык» один за другим: если, например, в последовательности GAAUGUCCG первые три звена (GAA) кодируют одну аминокислоту, то вторые три (UGU) – вторую, а третьи (CCG) – третью; в то же время, например, триплет AAU здесь кодоном не является.
Белковый код был расшифрован в 60-х годах ХХ века во многом благодаря использованию синтетических матриц – продуктов поликонденсации олигонуклеотидов (стр. 89).
α-Аминокислоты не могут непосредственно узнавать соответствующие им кодоны, поскольку нет прямой комплементарности между их структурами. Узнавание осуществляется с помощью молекул- посредников (адапторов или уж совсем по русски - переходников) – молекул, которые могут специфически координироваться с одной стороны с кодонами, а с другой – с соответствующими им α-аминокислотами. Такими адапторами являются транспортные РНК (тРНК) – сравнительно низкомолекулярные полинуклеотиды (73-85 нуклеотидных звеньев); эти РНК растворимы и весьма мобильны, что и позволяет им выполнять транспортную функцию – доставку аминокислот к матрице. Транспортная РНК имеет специфическую пространственную структуру («клеверного листа»); один из фрагментов этой структуры («акцепторный стебель») специфически связывается со своей α-аминокислотой (и только с ней!); другой фрагмент («антикодоновая петля») содержит триплет нуклеотидных звеньев, комплементарных кодону, который кодирует именно эту аминокислоту; этот триплет называют антикодоном (например, если аминокислота кодируется триплетом UСA, то в ее тРНК антикодон – AGU).
Перед процессом собственно трансляции происходит узнавание α-аминокислотами «своих» тРНК и далее ковалентное связывание с ними с образованием сложного эфира по 3’-концевому звену «акцепторного стебля» - аминоацил-тРНК:

Ковалентное связывание происходит при участии 5’-аденозинтрифосфата (АТР, рррА), который поставляет необходимую для этого энергию (расщепляясь до аденозинмонофосфата и пирофосфата). Образование аминоацил-тРНК катализируются ферментами – аминоацил-тРНК-синтетазами; каждая из них узнает с одной стороны «свою» α-аминокислоту, а с другой – «свою» тРНК («двойной контроль», практически исключающий ошибки при узнавании).
Далее т-РНК транспортирует связанную с ней α-аминокислоту к матрице, где и происходит «сборка» полипептидной цепи. Матрица – мРНК – образует комплекс с рибосомой – клеточной органеллой, представляющей собой специфический комплекс рибосомальных РНК с белками. Рибосома в ходе синтеза перемещается вдоль цепи мРНК от кодона к кодону (это перемещение называется транслокацией). Именно на рибосоме и происходит синтез полипептидной цепи. Опуская описание строения рибосомы, отметим, что на ней имеются два центра связывания – А-центр (аминокислотный) и Р-центр (пептидный), которые и принимают непосредственное участие в синтезе.
Опять-таки опуская начало (инициацию) процесса трансляции, рассмотрим единичный цикл элонгации – совокупность процессов, при которых полипептидная цепь увеличивается на одно звено (рис. 9)
Один цикл элонгации включает три этапа. Перед первым этапом Р-центр занят тРНК, связанной с С-концевым звеном формирующейся полипептидной цепи; А-центр свободен и находится у кодона, кодирующего следующую аминокислоту. На первом этапе (1) тРНК, связанная с этой следующей аминокислотой (здесь – фенилаланином), узнает кодон этой аминокислоты (при помощи антикодона) и координируется с ним, закрепляясь на А-центре. При этом весьма важно, что пептидная цепь на Р-центре и очередная аминокислота точно ориентированы друг по отношению к другу – группа NH2 очередной аминокислоты точно «нацелена» на сложноэфирный карбонил С-концевого звена пептидной цепи. Такая ориентация обусловлена специфической структурой рибосомы. Точная ориентация позволяет весьма эффективно осуществить ключевой второй этап (2) – образование пептидной связи (конденсацию). Эта реакция идет по типу аминолиза сложного эфира; «спиртовая» компонента – тРНК – вытесняется и остается на Р-центре, а пептидная цепь, удлинившаяся на одно звено, теперь связана с новой молекулой тРНК, прикрепленной к А-центру.
Образование пептидной связи катализируется ферментом – пептидилтрансферазой – и протекает с очень большой скоростью – за время порядка 10-2– 10-3сек.
Далее следует третий этап (3), который состоит из трех стадий. На первой стадии освободившаяся тРНК предыдущей аминокислоты уходит с Р-центра (удаление побочного продукта равновесной поликонденсации). На второй стадии тРНК с прикрепленной к ней пептидной цепью переходит с А-центра на освободившийся Р-центр. Наконец, на третьей стадии рибосома перемещается вдоль цепи мРНК на один кодон (на рисунке — вправо), т.е. происходит транслокация. После этого картина полностью аналогична исходной (до начала первого этапа), но полипептидная цепь имеет на одно звено больше, а рядом с А-центром находится новый кодон; далее все повторяется. Один цикл элонгации проходит в течение порядка 0,05 сек., так что синтез достаточно большого белка из 400 звеньев проходит за 20 сек. Синтез идет в направлении 5'—>3' мРНК и от N-конца полипептидной цепи к ее С-концу.
Терминация трансляции наступает при попадании А-центра рибосомы на стоп-кодон; синтез прекращается, готовая полипептидная цепь отделяется от последней тРНК и покидает рибосому.

Рис. 9. Схема одного цикла элонгации при трансляции
Резюме
Процессы поликонденсации в подавляющем большинстве случаев (за исключением поли- рекомбинации) сводятся к взаимодействию между собой функциональных групп мономеров. Если каждый мономер содержит две группы, образуется линейный полимер (линейная поликонденсация), если три или более – возможно сшивание с образованием трехмерной структуры (трехмерная поликонденсация). Концевые группы полимеров – неиспользованные функциональные группы мономеров.
Для поликонденсации используют самые разнообразные взаимодействия между функциональными группами, из которых, вероятно, наиболее часто – полиацилирование; по этой схеме, в частности, идет синтез белков и по сходной схеме – синтез нуклеиновых кислот.
Реакции поликонденсации протекают по ступенчатым механизмам. Конечный результат линейнойполиконденсации определяется, в основном, двумя факторами: степенью обратимости реакции и соотношением реагирующих групп. По степени обратимости различают равновесную и неравновесную поликонденсацию. В первом случае обратные реакции (деструкции) протекают в заметной степени, поэтому необходимо удаление низкомолекулярного продукта реакции; во втором случае такое удаление не обязательно. Нарушение эквивалентности реагирующих групп во всех случаях ограничивает длину полимерной цепи. Поэтому для достижения высоких молекулярных масс нужно обеспечить строгую эквивалентность групп; напротив, для получения олигомеров нужно использовать рассчитанный избыток одной из групп. Для трехмерной поликонденсации эти ограничения не столь существенны, т.к. для сшивания во многих случаях достаточно неполной глубины процесса.
При обычной непрограммируемой поликонденсации образуются полимеры с высокой степенью полидисперсности; однако, долю молекул любой величины (как по числу, так и по массе) во многих случаях можно достаточно точно рассчитать.
С другой стороны, именно поликонденсация предоставляет возможность осуществления программируемых синтезов, в результате которых образуются монодисперсные полимеры, в том числе сополимеры с заданной первичной структурой. Это могут быть синтезы с контролем каждой стадии формирования полимерной цепи (синтез дендримеров, синтезы полипептидов и полинуклеотидов «в пробирке»). Наиболее совершенный вариант программируемого синтеза – матричный синтез, в ходе которого считывается информация, «записанная» на молекуле-матрице. Это – процессы репликации, транскрипции и трансляции; ферментативный катализ и точная ориентация реагирующих молекул позволяет проводить эти синтезы не только с высочайшей точностью, но и с высочайшей скоростью.
