
- •Поликонденсация
- •Наиболее важные типы реакций поликонденсации
- •Общие закономерности поликонденсации
- •Практические способы проведения поликонденсации
- •Синтез монодисперсных полимеров путем поликонденсации
- •А. Нематричный синтез полипептидов
- •Б. Нематричный синтез полинуклеотидов
- •Матричный синтез полимеров с заданной первичной структурой
Б. Нематричный синтез полинуклеотидов
Если синтез полипептидов сводится к образованию пептидной связи между звеньями, то синтез полинуклеотидов – к образованию фосфоэфирной связи между звеньями. Синтез полинуклеотидов идет по следующей схеме: вначале путем неферментативного химического синтеза получают небольшие блоки – олигонуклеотиды, которые затем «сшивают» с помощью ферментативных реакций; таким образом, здесь используется блочная (конвергентная) стратегия (см. стр. 70). Здесь будет кратко рассмотрена только первая часть схемы – чисто химический синтез олигонуклеотидов.
 В
качестве мономеров при химическом
синтезе олигонуклеотидов используют
нуклеозиды
(99)
и нуклеотиды
(5’-нуклеозидфосфаты)
(100); формальная
схема синтеза следующая:
В
качестве мономеров при химическом
синтезе олигонуклеотидов используют
нуклеозиды
(99)
и нуклеотиды
(5’-нуклеозидфосфаты)
(100); формальная
схема синтеза следующая:
Как и при синтезе полипептидов, здесь необходимо защитить все «лишние» группы, чтобы протекало только взаимодействие 3’-ОН –группы предыдущего звена и 5’-фосфатной группы последующего. Защищать нужно: А. Группы NH2 гетероциклических оснований – цитозина, аденина и гуанина; Б. «Лишние» группы ОН (для ДНК – 5’-ОН-группу нуклеозида и 3’-ОН-группу нуклеотида, для РНК в дополнение к ним – еще и 2’-ОН-группы); В. Для более совершенных вариантов – группу Р-О‾; для более простых вариантов эта группа не защищается.
Рассмотрим наиболее простой вариант синтеза олигонуклеотидов – так называемый фосфодиэфирный метод (на примере синтеза дезоксирибоолигонуклеотидов):
П ри
взаимодействии 5’-защищенного нуклеозида
(102) и 3’-защищенного нуклеотида (103)
образуется защищенный с двух концов
динуклеотид (104). Далее снимают защиту
с одного из концов динуклеотида (в данном
примере удаляют защитуY
с 3’-конца); освободившаяся группа (в
данном случае 3’-ОН) реагирует со
следующим мономером (здесь –
3’-защищенным нуклеотидом) с образованием
дизащищенного тринуклеотида (105) и т.д.;
к сожалению, «и т.д.» в этом варианте не
идет дальше четвертого звена. [группы
NH2
гетероциклических оснований Bi
в этом варианте защищены; их защита
здесь не рассматривается].
ри
взаимодействии 5’-защищенного нуклеозида
(102) и 3’-защищенного нуклеотида (103)
образуется защищенный с двух концов
динуклеотид (104). Далее снимают защиту
с одного из концов динуклеотида (в данном
примере удаляют защитуY
с 3’-конца); освободившаяся группа (в
данном случае 3’-ОН) реагирует со
следующим мономером (здесь –
3’-защищенным нуклеотидом) с образованием
дизащищенного тринуклеотида (105) и т.д.;
к сожалению, «и т.д.» в этом варианте не
идет дальше четвертого звена. [группы
NH2
гетероциклических оснований Bi
в этом варианте защищены; их защита
здесь не рассматривается].
В качестве защитных групп для 5’-ОН-групп наиболее часто используются тритильная (трифенилметильная) группа (Z = Ph3C) или ее замещенные в бензольных ядрах аналоги; эта защита легко снимается в мягких условиях в кислых средах. В качестве защитной группы для 3’-ОН-группы чаще всего используется ацетильная (Y = CH3CO); она снимается действием водного раствора аммиака. В качестве конденсирующего агента при образовании фосфоэфирной связи используют уже знакомые по пептидному синтезу карбодиимиды (прежде всего DСС), а также арилсульфохлориды ArSO2Cl.
Фосфодиэфирный способ предоставляет для синтеза олигонуклеотидов ограниченные возможности по сравнению с фосфотриэфирным, в котором защищена также группа Р-О‾; однако для принципиального понимания стратегии синтеза олигонуклеотидов рассмотрения фосфодиэфирного метода вполне достаточно.
Олигонуклеотиды с малым числом звеньев (например, тримеры), достаточно легко получаемые даже по фосфодиэфирному методу, можно подвергать «обычной» гомополиконденсации, используя эти олигонуклеотиды как мономеры типа а-R-b. Для этого продукт рассмотренного выше синтеза [например, соединение типа (105)] фосфорилируют по 5’-ОН-группе (это сделать нетрудно, т.к. первичная 5’-ОН-группа активнее вторичной 3’-ОН-группы); полученное соединение (106) подвергают поликонденсации с использованием тех же конденсирующих реагентов, что и в программируемом синтезе:
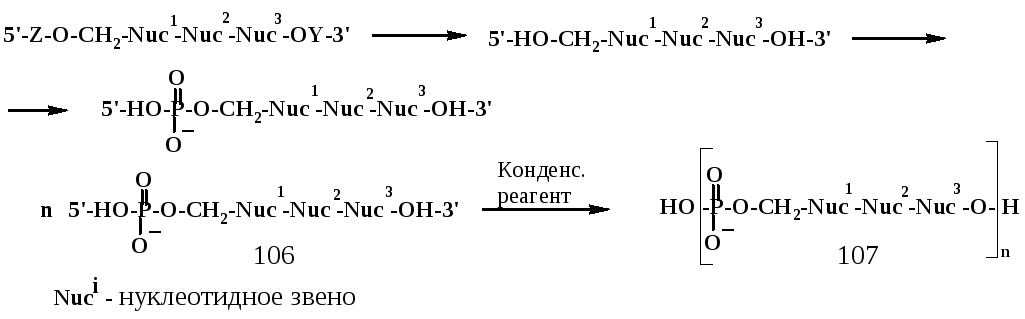 Подобные
«гомополимеры» с олигонуклеотидными
элементарными звеньями использовались
для расшифровки белкового кода; они
также могут служить относительно легко
доступными моделями для изучения свойств
природных полинуклеотидов.
Подобные
«гомополимеры» с олигонуклеотидными
элементарными звеньями использовались
для расшифровки белкового кода; они
также могут служить относительно легко
доступными моделями для изучения свойств
природных полинуклеотидов.
Далее коротко рассмотрим матричную поликонденсацию.
