
Лекции / Лекции (Павлова) / L29
.docЛекция №29.
Характеристика функции внутренней энергии вытекает из фундаментального уравнения (т.е. уравнение первого начала термодинамики + уравнение второго начала термодинамики):
U=(S,V,i)=(S,V,n1,n2,…,nk).
Если система открытая - мольное число компонента.
З где (k
– химический интеграл)![]()
![]()
Р![]() ассмотрим
закрытую систему, где последний член
не учитывается
ассмотрим
закрытую систему, где последний член
не учитывается
Определим физический смысл частных производных:
()![]()
![]()
На основе внутренней энергии, энтропия и объем рассчитать энтальпию системы. Т.к. функция является характеристикой, то это можно сделать.
![]() H=+pV
H=+pV
Рассчитать энергию Гельмгольца через внутреннюю энергию:
![]() F=U-TS
F=U-TS
Рассчитать энергию Гиббса:
![]() G=U+pV-TS
G=U+pV-TS
П подставим
в общую формулу![]()
В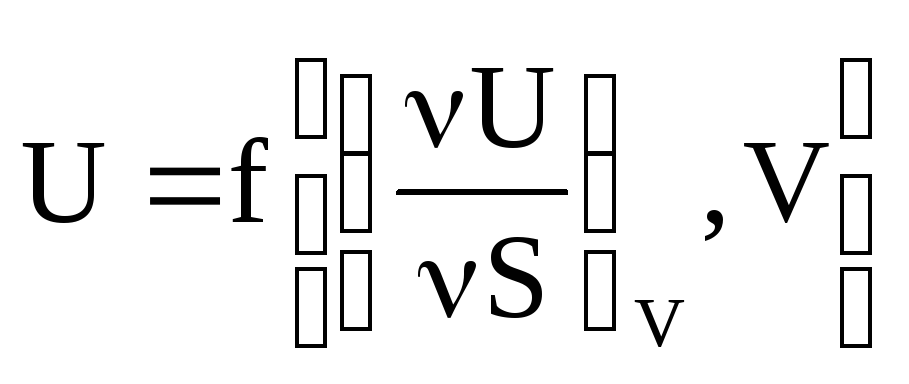
можно
найти
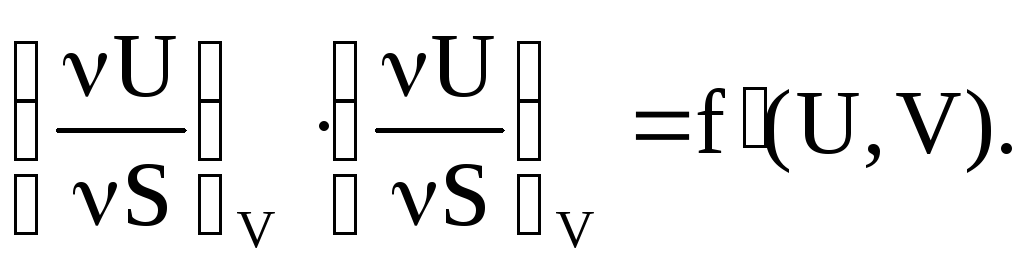 ыражение
для частной производной
ыражение
для частной производной
Р
Т.е. мы не получаем
простого выражения, поэтому здесь
внутренняя энергия не рассматриваем
как характерную функцию.
![]() Вывод
для ():
температура является мерой возрастания
внутренней энергии с увеличением
энтропии при V=const.
Вывод
для ():
температура является мерой возрастания
внутренней энергии с увеличением
энтропии при V=const.
Давление – мера убыли внутренней энергии при изоэнтропическом увеличении объема системы.
Зависимость внутренней энергии от объема и энтропии:

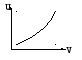 S=const V=const
S=const V=const
![]()
![]()
![]() Характер
наклона функции определяется знаком
первой производной и надо еще определить
характер выпуклости или вогнутости,
что определяется второй производной,
т.е. надо найти выражение
Характер
наклона функции определяется знаком
первой производной и надо еще определить
характер выпуклости или вогнутости,
что определяется второй производной,
т.е. надо найти выражение
![]() Положительный
знак производных указывает, что U
от V
и U
от S
будут выпуклыми, разница в том, что одна
функция возрастающая, а другая –
убывающая.
Положительный
знак производных указывает, что U
от V
и U
от S
будут выпуклыми, разница в том, что одна
функция возрастающая, а другая –
убывающая.
Аналогично можно сделать для других характерных функций
H=(S,p).
О![]()
![]()
![]() пределим
первые производные этой функции:
пределим
первые производные этой функции:
Функция Массье-Планга – Ф (тоже характеристическая функция) – приведенная термодинамические потенциалы – функции очень удобные для расчета химических равновесий.
(Ф’, Ф’’).
Химическое равновесие.
Изучение химических реакций позволяет решить ряд принципиально важных вопросов:
-
пойдет или нет данная химическая реакция
-
рассчитать const равновесия
-
определить условия, при которых выход веществ окажется максимальным
-
вычислить число компонентов в химической реакции
Первые были заложены в 1865 г. в работах русского физика-химика Бекетова.
Закон действующих масс (или основной закон химического равновесия) впервые был сформулирован Вульдвергом и Вааге в 1867 г. Их вывод основан на кинетическом расширении идеальных газов. В химической кинетике используется термин – обратная химическая реакция, но известно, что все химические процессы протекают в конечном времени и с этой точки зрения все реакции – необратимые процессы.
Т.о. что же такое обратимость химической реакции с кинетической точки зрения? Химические реакции как правило не идут до конца, т.е. до полного израсходования начальных продуктов. В реакционной смеси происходит как прямая так и обратная реакции, по мере расходования исходных веществ скорость прямой реакции падает, а скорость обратной увеличивается из-за накопления продуктов реакции. Когда скорости сравниваются устанавливается термодинамическое равновесие. В этом состоянии не происходит ни накопления ни расходования исходных веществ и продуктов. Суммарная скорость прямой и обратной реакции будет равна 0. Подобное равновесие – химическое, запишем уравнение химичкой реакции в общем виде:
AA+BBCC+DD
A, B, C, D – символы веществ.
А, B, C, D – стехиометрические коэффициенты.
Основной постулат химической кинетики:
С![]() корость
химической реакции пропорциональна
концепции реагирующих веществ в степени
стехиометрических коэффициентов.
корость
химической реакции пропорциональна
концепции реагирующих веществ в степени
стехиометрических коэффициентов.
k
– мольно-объемная
концепция вещества![]()
![]() 1
– коэффициент
пропорциональности.
1
– коэффициент
пропорциональности.
k Перепишем
это равенство из правых частей![]()
![]()
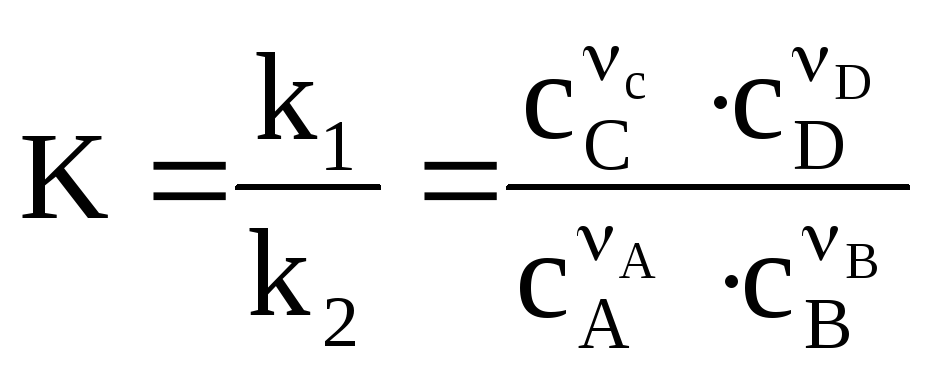 1
и k2
константы, зависимые только от температуры.
1
и k2
константы, зависимые только от температуры.
k – концентрационная константа равновесия.
Весь этот вывод основан на постулатах формальной кинетики. Подход Вульдверга–Вааге применил ли только к простейшим реакциям, но больший интерес представляет термодинамический вывод константы равновесия термодинамической реакции, а ее зависимость от различных термодинамических параметров.
Чем отличаются понятия “обратимая химическая реакция” от понятия “ обратимый процесс”.
Обратимый процесс характеризуется бесконечно малым отличием скоростей прямого процесса и обратного процесса у такого процесса результирующая скорость также бесконечно мала и система бесконечно мало откланяется от положения равновесия, что обратимая химическая реакция, лучше употреблять термин двух сторонняя термодинамическая реакция, в термодинамическом смысле обратима только в непосредственной близости к состоянию равновесия. Двухсторонняя реакция в далеком состоянии от равновесия. Суммарная скорость значительно отличается от нуля. надо пользоваться двухсторонней реакцией, но термин обратимая химическая реакция укрепился и использовать учитывая сказанное выше.
Условие химического равновесия.
Термодинамический вывод для const химического равновесия.
Условием химического равновесия является общее условие термодинамического равновесия системы. Общее условие равновесия в системе можно сформулировать на основе термодинамических потенциалов.
Критерий равновесия системы.
T1p=const, dG=0.
T1V=const, dF=0.
Р![]()
![]()
![]() аскроем
полный дифференциал энергии Гиббса:
аскроем
полный дифференциал энергии Гиббса:
А
условие химического
равновесия в системе можно записать в
виде:![]() налогично
для энергии Гельмгольца.
налогично
для энергии Гельмгольца.
В этом выражение суммирования проводится по всем веществам и продуктов реакции не являются независимыми, они связаны уравнениями химической реакции и пропорциональны стехиометрическим коэффициентам с которым каждое вещество участвует в реакции.
В![]() ведем
новую переменную: химическая переменная
или число пробегов реакции. Будем
учитывать исчезновение веществ знаком
“-”, а образование знаком “+”.
ведем
новую переменную: химическая переменная
или число пробегов реакции. Будем
учитывать исчезновение веществ знаком
“-”, а образование знаком “+”.
Химическая переменная характеризует только одну определенную реакцию. Если в системе протекает несколько реакций, то для каждой из них имеется своя химическая переменная.
П условие
химического равновесия![]()
И![]()
![]() зменение
масс.
зменение
масс.
Химическая переменная характеризует только одну определенную реакцию. Если в системе протекает несколько реакций, то для каждой из них своя химическая переменная.
П ![]()
![]()
![]()
![]() условие
химического равновесия:
условие
химического равновесия:
