
Лекции / Лекции (Павлова) / L4
.docЛЕКЦИЯ №4
Характеристикой отклонений реальных газов от идеального поведения служит мольный объем реальных газов.
Введем фактор сжимаемости:
![]()
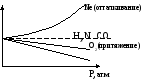
 Z Z
Z Z
CO2
P
Z=1 H2,N2,CO – фактор сжимаемости ид. газа до 1,5 близка к ид. газа.
Сжимаемость Ne больше ид. газа.
Основными причинами отклонений свойств реал. газов от идеальных являются:
-
притяжение молекул;
-
наличие у них собственного объема.
Наибольшее раскрытие вследствие простоты и физической надменности получило уравнение Ван-дер-Ваальса, ввел две поправки в уравнение состояния идеального газа.
(P+a/ν2)(ν-b)=RT (для 1-ого моля);
(P+n2/ν2)(ν-b)=nRT (для n-моль);
поправка “a” учитывает притяжения молекул
поправка “b” – учитывает собственный объем и взаимное отталкивание на малых расстояниях.
Используется прием “предельных условий”:
При больших объемах (малых давл.) и высоких температурах уравнение Ван-дер-Ваальса переходит в уравнение Клайперона – Менделеева.
Силы взаимного притяжения молекул вызывают дополнительное внутреннее давление и кинетическое (для конденсированного состояния) = общему давлению. 1/r6 (потенциал отталкивания), поэтому в уравнении стоит υ2; пар. в отражает свободного газа, кроме собственного объема он учитывает V доступный для перемещения молекул, для сил отталкивания.
Величина b в 4 раза превышает собственный объем мольного газа(т.е. Const а и b зависят от температуры и определяются природой газа, их можно рассчитать используя экспериментальные данные о критических параметрах газа (фундамент. параметры вещества). При повышении P, возрастает число столкновений, в результате газ сжижается, однако существует температура – критическая, выше какое увеличение давления не приводит к снижению газа. При этих температурах энергия to движения частиц, превышает энергию связи между молекулами в жидкости. При toкрит газ можно превратить в жидкость только при определенном давлении – критическом при (t и p)крит возникает Vкрит существует критическая точка: жид и газа, которые сосуществует – одинаковы. В критической точке плотность жидкости и газа одинаковы, зная tкрит и крит можно рассчитать
a=27R2T2/64крит b=RTк/8крит
Недостаток: для различных газов a и b различны, поэтому уравнение Ван-дер-Ваальса не является универсальным, хотя многие годы (реал.) поддаются под описание этого уравнения.
Уравнение не работает при высоких давлениях и в критической точке. Значит теория состояний для всех газообразных и жидких веществ уравнение должно быть справедливо: уравнение единого состояния:
=Pкрит/P; =νк/ν; =Tк/T. (только приведенные величины).
Для описания реальных газов применяют вириальные уравнения (комерлинтное):
ν=RT(1+B/ν+C/ν2+D/ν3+ )
B, C, D – вириальные коэффициенты.
Вириальные коэффициенты зависят от температуры и природы газа(находят из экспериментальных данных to,P,V). С помощью статической механики вириальные коэффициенты можно выразить через силы межмолекулярного взаимодействия.
“b” – отражает парные взаимодействия.
При не высоком давлении значения коэффициентов BCD…
При низкой T коэффициент B – отрицателен, с увеличением Т, В проходит через нулевое значение и становится положительным.
В=0 при ТБойля
ТТБой В0.
В условия , когда РгазаРкрит/2 всеми коэффициентами кроме В можно пренебречь:
Рυ=RT(1+B/).
Первый закон термодинамики –
закон сохранения и превращения энергии в применении К тепловым процессам, которые связаны с превращениями теплоты и работы.
Рассмотрим некоторые понятия:
внутренняя энергия “U” – характеризует общий запас энергии системы, включает в себя все виды взаимодействия и движения частиц, составляющих систему (атомы, молекулы, ядра); в U не входит Eкинет в целом и Eпотент в поле внешних сил, а Eпотент внутр. входит в “U”.
Опыт Гейлюсака(рассмотреть физический смысл этого опыта на экзамене)
Ф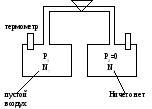 иксирование
температуры при перетекании воздуха
из балона 1 в балон 2, предварительно
система статировалась 12 ч, потом был
открыт кран, воздушной перегородкой из
12.
иксирование
температуры при перетекании воздуха
из балона 1 в балон 2, предварительно
система статировалась 12 ч, потом был
открыт кран, воздушной перегородкой из
12.
|
|
0,76 |
0,38 |
0,19 |
|
- ∆t, оС |
0,61 |
0,34 |
0,20 |
|
+ ∆t, оС |
0,58 |
0,34 |
0,20 |
При переходе воздуха из 12 изменения температуры в каждом болоне равны, классическое значение этого результата состоит в том, что мы имеем представление о внутренней энергии, которая присуща системе.
Правильное толкование опытов ГейЛюсака дал Мастер спустя 35 лет.
Макроскопически равновесная система: доказал Джоуль: поместим всю эту систему в калориметр, и выясним, что тепло не выделяется при переходе газа из 12 (т.е. изменение температуры калориметра=0, т.е. теплота не выделяется). Наблюдаемые в опыте Г.Л. изменения связаны с взаимодействием. В системе обнаруживается поле сил, связанных с притяжением или отталкиванием …. запас энергии; различные процессы сопряжены с изменением этих запасов и их переходами из 1-ой формы в другую; Абсолютное значение внутренней энергии невозможно измерить даже для простейшей системы, однако для целей т/д этого не нужно, важно определить количественное изменение внутренней энергии при переходе системы из первого состояния в другое.
сист.1 сист.2


U1 U2 ΔU=U2-U1.
Если ΔU0, то внутренняя энергия в результате процесса возрастает.
Работа и теплота.(обобщенный физический смысл). Работа и температура – это формы передачи энергии от системы к другой.
Работа (обобщенный т/д смысл) - работа совершаемая системой обусловлена взаимодействием с внешней средой, в результате преодолеваются силы, нарушавшие равновесие в системе.
Работа – макроскопическая форма передачи энергии.
Отличительная особенность работы и энергии.
Чтобы система совершила работу, необходимы внешние силы.
 P2<P1(поршень
поднимается)
P2<P1(поршень
поднимается)
A=P2(V2-V1)=P∆V – работа расширения(нет обмена
вещества системы с внешней средой).
Опыт расширение газа под поршнем.
