
Лекции / Лекции (Павлова) / L3
.docЛекция №3
Закон термодинамического равновесия или нулевой принцип термодинамики доказывает, что материя обладает такими свойствами как температура.
A(PA,VA)= B(PB,VB)=C(PC,VC)=t – эмпирическая температура.
Преобразуем температуру (введем температуру под знак функции):
(P,V,T)=0 – показывает, что для каждой из контактирующих систем существует свое уравнение состояния.
2. Шарля-Гейлюсака.
(закон теплового расширения газа) – объем данной массы идеального газа при p=const линейно возрастает с температурой.
P=const, Vt=V0(1+t)
-
коэффициент одинаков для различных
газов
![]()
П первоначального
объема газа.![]()
![]() ри
нагревании на 1С(К)
первоначальный объем увеличивается на
ри
нагревании на 1С(К)
первоначальный объем увеличивается на
Построим график Vt(t), где t – эмпирическая температура, в широком интервале температур.

T(K) = t,C + 273.15 Учитывая это выражение, перепишем закон Гейлюсака:
T V=k’T
(объем пропорционален температуре)![]()
![]()
и зобарический
процесс
зобарический
процесс
3. Уравнение Клайперона-Менделеева. Уравнение состояния идеального газа.
Задача:
перейти
из состояния 1 в состояние 2 Дано: два
предыдущих закона

P1 T1 V1 P2 T2 V2
Уравнение Клайперона-Менделеева.
![]()

Константа зависит от количества вещества и пропорциональна ему.
Отнесем выражение к первому молю газа, воспользуемся знаком Авогадро: при одинаковых P и to согласно закону Авогадро объемы газов должны быть одинаковы, т.к. количество молекул одинаково N=6,0023*1023.
не зависит от вида газа, обозначим ее буквой R и запишем уравнение Менделеева
PVмал=RT(1 моль газа)
R= универсальная газовая постоянная, независящая ни от каких факторов;
для n молей газа PV=nRT.
![]() Закон
Авогадро
позволяет
найти число R,
согласно закону Авогадро для 1 моля газа
при 0оС
и давлении 1 атм., составляет 22,414 л.
Закон
Авогадро
позволяет
найти число R,
согласно закону Авогадро для 1 моля газа
при 0оС
и давлении 1 атм., составляет 22,414 л.
значение R зависит от того в каких единицах даны P, V, T.
В системе Си: R=8,314 Дж/мольК; 1кал=4,184 Дж; R=1,987 кал/мольК.
R=0,082 литр.атм/мольК
R=8,617*10-5 ЭВ/К.
При всех практических расчетах необходимо соблюдать, чтобы значение R соответствовало P, V, T (в чем они даны).
Температура характеризует макроскопическое свойство системы(экстенсивное свойство). Физический смысл газовой постоянной, для этого нагреем систему на 1о.
было: P1V1T1 стало: Р1V2(T1+1)
запишем уравнение состояния для первой и второй системы:
-
P1V1=RT1 Вычтем из (2) (1),
-
P1V2=R(1/T1+1) в результате получим
P1(V2-V1)=R
P∆V=R P∆V – работа расширения при изобарическом процессе.
R= работе расширения идеального газа при повышении температуры на 1К.
Смесь идеальных газов.
Закон Дальтона.
Введем понятие парциального давления – это собственное давление которое оказывает каждый газ в смеси, причем такое как бы он занимает весь объем.
PiV=riRT
Закон парциального давления для смеси идеальных газов сформулировал Дж.Дальтон.
(1)nобщ=nA+nB+nc+… , где ni – составляющее смеси.
У![]() множим
(1) на множитель RT/V.
множим
(1) на множитель RT/V.
Pобщ=РА+РВ+РС+… - парциальное давление
Используя уравнения Клайперона-Менделеева для смеси в целом и составляющей смеси, запишем определение.
Мольная доля(xi-) определяется через закон Дальтон как отношение парциального давления к общему.
E![]() кин=3/2
KT
– физический смысл – взаимосвязь
макроскопического свойства системы
(Т) с микроскопическим (Е – энергия одной
молекулы).
кин=3/2
KT
– физический смысл – взаимосвязь
макроскопического свойства системы
(Т) с микроскопическим (Е – энергия одной
молекулы).
Т – не связана ни с какими экстенсивными свойствами (например с массой).
Т – мера интенсивности теплового движения.
Общая энергия
 при
Т=const,
сумма энергий молекул постоянна, но
энергии различных молекул различны.
Существует распределение молекул по
энергиям – закон Больцмана, согласно
распределению Больцмана, доля частиц
с энергией εi
определяется формулой:
при
Т=const,
сумма энергий молекул постоянна, но
энергии различных молекул различны.
Существует распределение молекул по
энергиям – закон Больцмана, согласно
распределению Больцмана, доля частиц
с энергией εi
определяется формулой:
Общее
количество частиц
Закон Максвелла (распределение молекул по скоростям)
масса
индивидуальной молекулы
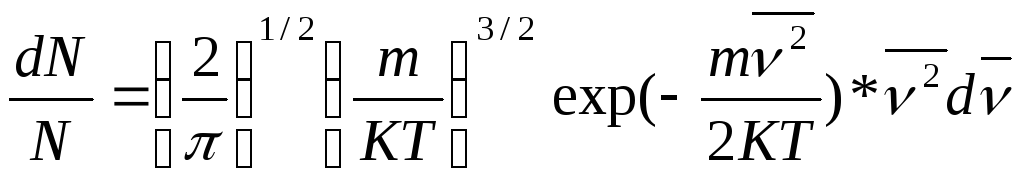

 Вывод
законов Больцмана и Максвелла базируется
на теории вероятности
Вывод
законов Больцмана и Максвелла базируется
на теории вероятности

-
формула Максвелла

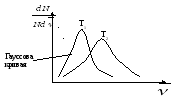 Если
поделить на d
получим
распределение молекул по скоростям:
Если
поделить на d
получим
распределение молекул по скоростям:
T2T1 Острота max – определяется температурой.
max – наиболее характерный способ движения.
все что выше идеальный газ
Реальные газы. Уравнение состояния.
Поведение реальных газов не подчиняется идеальным законам, характеристикой отклонения служит мольный объем газа. Удобной характеристикой отклонения является фактор сжимаемости.
