
Лекции / Лекции (Павлова) / L25
.docЛ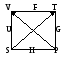 екция
№ 25.
екция
№ 25.
 U=(S,
V, Ук)
U=(S,
V, Ук)
H=(S, p, Ук)
dU=TdS-pdV
G=(T, p, Ук)
Т/д потенциалы функции
естественных переменных. pdV TdS
![]()
![]() Естественная
переменная = механич. + калорические.
Естественная
переменная = механич. + калорические.
G и F зависят от параметров, которые легко изменяются.
G= определяется как =H-TS= энтальпия – связанная энергия.
dG=-SdT+Vdp-A’
в изотермических процессах мах. работа, зависит от процесса и имеем неравенство.
( ) A’max
≤-dGp,T
) A’max
≤-dGp,T
Для конечного процесса
A’max ≤-∆Gp,T
Для обратного: A’ ≤-∆Gp,T
Применим G=H-TS к изотермическому процессу
∆G=G2-G1=∆H-T∆S (верно, т.к. все функции адди….).
() в необратимом процессе работа …. Гиббса.
Рассмотрим когда в системе совершается процесс, но отсутствуют полезные работы, тогда A’max=0, A’max=0 (условия).
d
направление процесса
→ ∆G0, dG0. (T,p=const)
← ∆G0, dG0. Однако это противоречит неравенствам () полученным из взаимосвязи max. полученной работы и энергии Гиббса и второму началу термодинамики. На основании этого Вывод: со вторым началом термодинамики совместимо только одно направление процесса из двух возможных, а именно то которое находится в согласии с неравенствами.()
если процесс (здесь химические реакции) протекает без изменений энергии Гиббса, что соответствует знаку неравенства (dG=0, ∆G=0) процесс идет обратимо и возможность его протекания в прямом и обратном направлении равновероятно по отношению к данному процессу система находится в равновесии.
Уравнения можно рассматривать как условие равновесия системы по отношению к данному процессу. Запишем условие равновесия, когда система находится в равновесии не только по отношению к данному процессу, но и по отношению к процессу в этой системе.
Общий критерий равновесия системы при постоянных давления и температуры записывается как:
dG=0, p=const, T=const, A’=0.
∆G=0, p=const, T=const, A’=0.
Т.о. величина ∆G определяет возможность протекания химической реакции.
Химическое сродство.
Запишем химическую реакцию в общем виде:
Стехиометрический
коэффициент
Когда расходуется А, B молей вещества А, В и образуется L, M молей вещества L, M реакция совершила пробег.
Согласно второму началу термодинамики в закрытой системе (где нет материалов обмена с внешней средой) при отсутствии полезных работ при полном протекании первого пробега реакции выполняется неравенство: ∆G0.
При оговоренных выше условиях сформулируем следующее положение:
-
Химическая реакция может протекать в прямом направлении самопроизвольно, если дифференциальная функция G меньше нуля или изменение функции G меньше нуля, если выполняется dG0, ∆G0 – условия возможности функции.
-
Функция не может протекать в прямом направлении, если dG0, ∆G0. В этом случае данная функция может протекать в обратном направлении.
-
Система находится в равновесии по отношению к отношению к данной функции, если dG=0, ∆G=0 – условие химического равновесия.
Величина ∆G(dG) называется химическим сродством. Важнейшие законы химического сродства в термодинамике описываются в термодинамике уравнениями Гиббса-Гельмгольца:
Если (Т и р)=const (то же) 1. dF0, ∆F0
2. dF>0, ∆F>0
(слова те же ) 3. DF=0, ∆F=0.
Уравнение Гиббса-Гельмгольца.
– выражение
– уравнение Гиббса-Гельмгольца и
является одним из
![]()
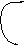 G=H-TS
-S=(G/T)p
– подставим в G.
G=H-TS
-S=(G/T)p
– подставим в G.
наиболее важных соотношений химической термодинамики. Уравнению Гиббса-Гельмгольца
м![]() ожно
придать другую форму.
ожно
придать другую форму.
Т![]() акая
форма более удобна для практических
расчетов. В том, что ↔ идентичны легко
убедиться, если привести дифференц.
левой части.
акая
форма более удобна для практических
расчетов. В том, что ↔ идентичны легко
убедиться, если привести дифференц.
левой части.
![]() Аналогично
можно записать и для функции Гельмгольца:
Аналогично
можно записать и для функции Гельмгольца:
Применим эти соотношения к химической реакции
AA+BB+…=LL+MM+…
энергия Гиббса имеет те же свойства, внутренняя энергия, т.е. энергия Гиббса имеет экстенсивные свойства, т.е. зависит от массы. Обозначим энергию Гиббса индивидуального вещества GA; тогда общая энергия Гиббса, составленная из исходных веществ запишется как:
G1=AGA+BGB+…
Конечная энергия Гиббса:
G2=LGL+MGM+…
С![]() родство
химическое определяется как:
родство
химическое определяется как:
А![]()
![]() налогично
можно оценить изменение энтальпии и
энтропии системы:
налогично
можно оценить изменение энтальпии и
энтропии системы:
![]()
![]()
![]() Применим
уравнение Гиббса-Гельмгольца
Применим
уравнение Гиббса-Гельмгольца
химическое
сродство будет определяться как
![]()
![]()
![]() Применим
эти уравнения к начальным и конечным
веществам, после этого вычтем
соответствующие выражение выражения
друг из друга получим уравнение
Гельмгольца через химическое сродство.
Применим
эти уравнения к начальным и конечным
веществам, после этого вычтем
соответствующие выражение выражения
друг из друга получим уравнение
Гельмгольца через химическое сродство.
А![]()
![]()
![]() налогичное
соотношение точно так же можно получить
для энергии Гельмгольца
налогичное
соотношение точно так же можно получить
для энергии Гельмгольца
Это основные соотношения химической термодинамики на основе которой рассчитывают термодинамические параметры процессов и в частности химических реакций.
![]()
![]() Можно
оценить изменение энтропии в ходе
протекания процесса в системе по формуле:
Можно
оценить изменение энтропии в ходе
протекания процесса в системе по формуле:
С – интегральная
форма уравнения Кирхгофа![]()
![]()
У![]()
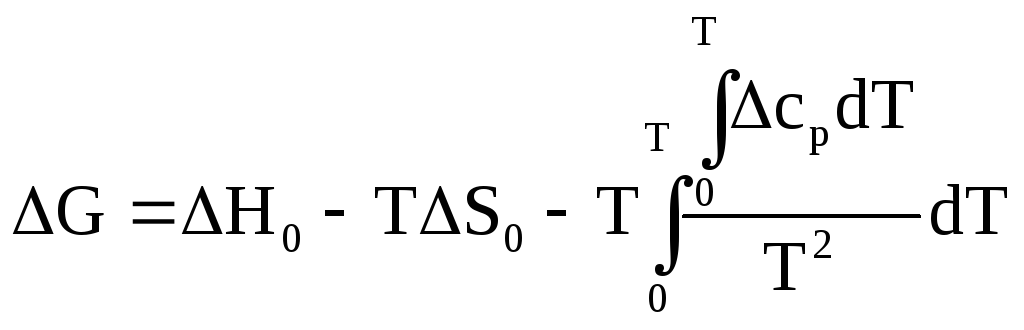 равнение
Гибба-Гальмгольца выражение через
максимальную полезную работу.
равнение
Гибба-Гальмгольца выражение через
максимальную полезную работу.
Соотношение
дает возможность оценивать энергию
Гиббса через работы процессов которые
мы можем проводить обратимо (гальванические
элементы).![]()
![]()
