
Лекции / Лекции (Павлова) / L5
.docЛекция №5.
Работа расширения.
если
p2=0
A=0
A=p2dV
Р![]()
![]() 1=Р2+dр
при расширении процесс будет происходить
медленно – равновесный процесс
1=Р2+dр
при расширении процесс будет происходить
медленно – равновесный процесс
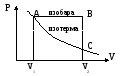 График
зависимости p=(V)
График
зависимости p=(V)
Р
AP=P1(V2-V1)=P2∆V
сплошная кривая
- равновесный

Ai
– площадь маленьких прямоугольников
А![]() равн
>
Aнеравн Аравн
= Аmax
равн
>
Aнеравн Аравн
= Аmax
Чем меньше внешнее давление, тем меньше произведенная работа; если р2=0, то при расширении газ работы не произведет; если внешнее давление р2 лишь на бесконечно малую величину отличаться от ргаза, то произведенная газом работа будет максимальной. Из графика видно, что Анеравн < чем при равновесном расширении. При p=const работа определяется ACBV2V1 – это площадь больше площади всех остальных фигур, т.е. работа, производимая системой в изобарическом процессе, меньше чем в изотермическом.
Теплота – принципиально иная форма передачи энергии, чем работа, передача осуществляется при теплообмене. Теплообмен – микроскопическая, т.е неупорядоченная форма передачи энергии хаотически двигающими частицами. Направление передачи теплота определяется температурой. И теплота, и температура не являются свойствами системы. Передача теплоты или совершение работы осуществляется при взаимоотношении системы с внешней средой или другой системы. Условимся положительной считать теплоту, полученную системой от окружающей среды, а работу, произведенную системой.
Энергия, работа, теплота измеряются в одинаковых единицах в системе SI – Джоуль.
Система или тело обладают Ер, т.к. они находятся в поле действия сил притяжения или отталкивания (сила тяжести, действие упругой деформации).
Физический смысл работы имеет только разность потенциальных энергий на двух уровнях. Энергетические затраты системы определяет количество затраченной работы.
A=i*e; i – фактор интенсивности (давление, силы)
е – фактор экстенсивности (координата, зависящая от массы).
Экспериментальное доказательство наличия …. взаимодействия внутри каждого тела. Различные процессы сопряжены с запаса Евнт и взаимного перехода из первой формы в другую.
Опыт Джоуля-Томпсона.
Дает представление о существовании у материи еще одной функции – энтальпии Н.

выберем условие, когда р1р2 (делаем с помощью поршня).
При заданном условии газ будет перетекать из левой в правую часть, при перетекание 1 моля газа левая уменьшиться на(V1 – 1 моль), правая увеличиться (V2 + 1 моль).
-pV1(изменение объема) – p2V2.
Вся система в эксперименте – изолирована, процесс расширения происходил без обмена энергии с внешней средой (адиабатный), но отдельные части системы притерпели изменения за счет проделанной работы. ∆U=U2-U1 – затраты энергии системы в целом, определяется количеством проделанной работы.
A=-p2V2+p1V1; V – мольный объем.
∆U=A и Q=0
U2-U1=-p2V2+p1V1
H=U2-p2V2=U1+p1V1=const (в данном опыте).
в общем случае H=U+pV – энтальпия – энергосодержание системы.
Н – более сложная функция, чем внутренняя энергия. Н рассматривается как расширенная внутренняя энергия (из-за “+pV”).
Опыт Джоуля-Томпсона знакомит еще с одним видом энергии. Изоэнтропийный – изобарический процесс можно охарактеризовать только с помощью функции энтальпии. В опыте Джоуля-Томпсона H=const dH=0 и работа, которую совершил газ, определяется только ∆U.
Теплота, поглощенная в процессе и протекающая при p=const, равна изменению энтальпии системы, если единственным видом работы является работа расширения, такая формулировка справедлива только для закрытых систем. В опыте Джоуля-Томпсона система была полностью изолирована dH=0 и работа, которую совершил газ, определялась изменением внутренней энергии.
Значение опыта Джоуля-Томпсона: с его помощью был обоснован в термодинамике важнейший термодинамический потенциал системы и открыт эффект Джоуля-Томпсона: при расширении газов наблюдается эффект их охлаждения, причиной является то что расширение связано с работой против сил взаимодействия между частицами.
Понижение температуры определяется коэффициентом Джоуля-Томпсона:
М=(T/dp)H=const – изменение температуры при Н=const, если разность давления в системе составляет 1 атм.; для большинства газов 0
для идеального газа =0.
На эффекте Джоуля-Томпсона основано сжижение газов.
Для дальнейших рассуждений, рассмотрим теплоемкость газов. Из анализов опытов Гей-Люсака и Джоуля-Томпсона и других в телах имеется некоторый запас тепла, которое может расходоваться на совершение работы, этот запас обусловлен движением частиц и взаимодействием между ними, поэтому он зависит от природы частицы и сил, действующих между атомами.
Для количественной оценки тепла, которое тело получает при нагревании, вводится понятие теплоемкости.
Теплоемкость – отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры (При отсутствии химической реакции, переходов вещества из первого агрегатного состояния в другое, и отсутствие полученных видов работ.)
Все кроме Арасш – полезные (А’).
Cмол=Cуд*М.
Для газов различают теплоемкость при p=const и V=const, т.е. Ср и СV.
Если вести нагревание при p=const, то сообщаемая системе теплота пойдет только на повышение температуры, если объем не равен const, т.е. газ имеет возможность расширятся, то для нагревания на 1оС потребуется больше тепла одна часть пойдет на соответствующее увеличение энергии движения частиц газа, а другая часть поглощенного тепла будет израсходована на совершение работы расширения, т.к. процесс происходит при p=const. теплоемкость при p=const равна теплоемкости при V=const плюс теплота которая пойдет на расширение газа.
Сp=CV+A A=K CpCV
Уравнение Майера – Сp-CV=K (сделать доказательство через уравнение состояния pV=KT и путем его дифференцирования и введя условие p=const доказать Ср=СV+А).
Определим единицу измерения количества теплоты (не в системе Си) – каллория.
1ккал=1000кал
1кал(теплотехническая)=4,1868 Дж.
1кал(термохимическая)=4,184 Дж.
Принцип эквивалентности тепла и работы.
Опыты с изменением теплоемкости с неопределенной убедительностью говорят о эквивалентности тепла и работы. Роберт Майер дал правильное толкование опыту Гей-Люсака. Опыт с изучением теплоемкости: при расширении 1 моля газа при высокой температуре работа составляет 0,848 кг*м/град A=R. Но с другой стороны R=1,987 кал/град.
Найдем коэффициент, пересчитывающий одни единицы в другие (коэффициент Майера) (механический эквивалент тепла).
0,848 кг*м/град=1,987 кал/град.
Опыт показал, что работа расширения 1 моля газа при повышении температуры на 1оС составляет A=0,848 кг*м. вместе с тем газовая постоянная составляет R=1,987 кал отсюда 0,848 кг*м=1,987 кал 1 кал=0,427 кг*м.
1 ккал=427 кг*м. – коэффициент пересчета единиц тепла в единицы работы, т.о. механический коэффициент тепла рассчитанный Майером составляет J=427 кг*м.
В дальнейшем результат Майера был подтвержден экспериментами Джоуля, в которых было показано постоянство для систем, совершающих круговой процесс.
