
- •Волновое уравнение
- •Дифракция Френеля на круглом отверстии
- •Дифракция Френеля от диска
- •5.Зоны Френеля. Дифракция Френеля на круглом отверстии и непрозрачном диске.
- •7. Дифракция рентгеновских лучей. Формула Вульфа-Брэгга.
- •8.Поляризация света. Закон Малюса. Поляризация света при отражении и преломлении. Угол Брюстера.
- •9.Распространение света в веществе. Дисперсия света. Нормальная и аномальная дисперсия
- •11.Тепловое излучение. Характеристики теплового излучения. Абсолютно черное тело.
- •12.Законы теплового излучения абсолютно черного тела. Закон Кирхгофа, Стефана-Больцмана. Законы Вина. Закон Релея-Джинса. «Ультрафиолетовая катастрофа».
- •13.Квантовая гипотеза. Формула Планка.
- •14.Корпускулярно-волновая двойственность свойств света.
- •15.Фотоэффект. Фотон, характеристики фотона.
- •16.Давление света.
- •17.Тормозное и характеристическое рентгеновское излучение.
- •18.Эффект Комптона.
- •19.Волновые свойства микрочастиц. Гипотеза де Бройля. Опыт Дэвиссона и Джермера. Дифракция электронов. Прохождение электронов сквозь две щели.
- •20.Соотношение неопределенностей Гейзенберга. Дифракция частицы на щели.
- •21.Волновая функция. Ее физический смысл и свойства.
- •22. Уравнение Шредингера. Движение свободной частицы. Стационарное силовое поле.
- •23.Частица в одномерной бесконечно глубокой потенциальной яме. Квантовая энергия.
- •24.Гармонический осциллятор в квантовой механике.
- •25.Прохождение частицы сквозь потенциальный барьер. Туннельный эффект.
- •26.Боровская теория атома. Опыт Резерфорда.
- •Планетарная модель атома
- •27.Спектральные серии излучения атомов водорода. Спектральные термы.
- •28.Постулаты Бора.
- •29.Расчет энергии и радиусов стационарных орбит водородоподобного атома.
- •30.Опыт Франка и Герца. Ионизационный потенциал.
29.Расчет энергии и радиусов стационарных орбит водородоподобного атома.
Бо́ровскаямоде́льа́тома
(Моде́льБо́ра) —
полуклассическая модель атома,
предложенная Нильсом
Бором в
1913 г. За основу он взял планетарную
модель атома, выдвинутую Резерфордом.
Однако, с точки зрения классической
электродинамики, электрон в модели
Резерфорда, двигаясь вокруг ядра, должен
был бы излучать непрерывно,
и очень быстро, потеряв энергию, упасть
на ядро. Чтобы преодолеть эту проблему
Бор ввел допущение, суть которого
заключается в том, что электроны в атоме
могут двигаться только по определенным
(стационарным) орбитам, находясь на
которых они не излучают, а излучение
или поглощение происходит только в
момент перехода с одной орбиты на другую.
Причем стационарными являются лишь те
орбиты, при движении по которым момент
количества движения электрона равен
целому числу постоянных
Планка[1]:  .
.
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты Rn и энергии En находящегося на этой орбите электрона:
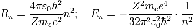
Здесь me — масса электрона, Z — количество протонов в ядре, ε0 — диэлектрическая постоянная, e — заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле.
Радиус первой орбиты в атоме водорода R0=5,2917720859(36)×10−11 м[2], ныне называется боровским радиусом, либоатомной единицей длины и широко используется в современной физике. Энергия первой орбиты E0 = − 13.6 эВ представляет собой энергию ионизации атома водорода.
Основана на двух постулатах Бора:
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
Излучение и поглощение энергии атомом происходит при скачкообразном переходе из одного стационарного состояния в другое, при этом имеют место два соотношения:
ε = En2 − En1, где
 —
излучённая (поглощённая) энергия,
—
излучённая (поглощённая) энергия,  —
номера квантовых состояний. В
спектроскопии
—
номера квантовых состояний. В
спектроскопии 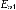 и
и 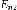 называются термами.
называются термами.Правило квантования момента импульса:

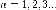
Далее исходя из соображений классической физики о круговом движении электрона вокруг неподвижного ядра по стационарной орбите под действием кулоновской силыпритяжения, Бором были получены выражения для радиусов стационарных орбит и энергии электрона на этих орбитах:
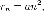
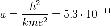 м — боровский
радиус.
м — боровский
радиус.

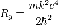 —
энергетическая постоянная
Ридберга (численно
равна 13,6 эВ).
—
энергетическая постоянная
Ридберга (численно
равна 13,6 эВ).
30.Опыт Франка и Герца. Ионизационный потенциал.
Опыт
Франка и Герца.
1913 г. Дж.Франком и
Г.Герцем. Основным элементом
экспериментальной установки является
трехэлектродная лампа, заполненная
газом, например, парами ртути под
давлением 1 мм рт. ст. В отличие от
стандартного включения такой лампы, в
опыте Франка и Герца сетка С имеет
положительный потенциал 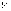 относительно
катода К и играет роль ускоряющего
электрода.
относительно
катода К и играет роль ускоряющего
электрода.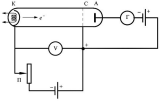 В
начале электрон двигается под действием
анодного напряжения. Пока энергия
электрона меньше энергии атома ртути,
то наблюдается абсолютно упругий удар,
при этом энергии электрона и атома ртути
не меняются,
меняется
только направление. Когда энергия
электрона становится равной энергии
возбуждения атома ртути, то наблюдается
абсолютный неупругий удар, при котором
электрон отдает энергия и его скорость
уменьшается, при этом анодный ток резко
уменьшается. Далее электрон, находясь
в эл. поле катода и анода ускоряются под
действием электрического поля и при
определенном напряжении наблюдается
второй абсолютно неупругий удар.
Напряжение, при котором происходит
уменьшение анодного тока, соответствует
энергии перехода атома ртути в возбужденное
состояние.
В
начале электрон двигается под действием
анодного напряжения. Пока энергия
электрона меньше энергии атома ртути,
то наблюдается абсолютно упругий удар,
при этом энергии электрона и атома ртути
не меняются,
меняется
только направление. Когда энергия
электрона становится равной энергии
возбуждения атома ртути, то наблюдается
абсолютный неупругий удар, при котором
электрон отдает энергия и его скорость
уменьшается, при этом анодный ток резко
уменьшается. Далее электрон, находясь
в эл. поле катода и анода ускоряются под
действием электрического поля и при
определенном напряжении наблюдается
второй абсолютно неупругий удар.
Напряжение, при котором происходит
уменьшение анодного тока, соответствует
энергии перехода атома ртути в возбужденное
состояние.
 Ионизационный
потенциал это – наименьшая энергия,
необходимая для удаления электрона из
электронной оболочки атома. Наибольшая
энергия отрыва – у атомов инертных
газов; наименьшая – у атомов щелочных
металлов: у атома гелия энергия ионизации
составляет 24,5 эВ, а у атома лития – 5,5
эВ. У атома водорода ионизационный
потенциал равен 13,5 эВ.
Ионизационный
потенциал это – наименьшая энергия,
необходимая для удаления электрона из
электронной оболочки атома. Наибольшая
энергия отрыва – у атомов инертных
газов; наименьшая – у атомов щелочных
металлов: у атома гелия энергия ионизации
составляет 24,5 эВ, а у атома лития – 5,5
эВ. У атома водорода ионизационный
потенциал равен 13,5 эВ.
Значения И. п. могут быть определены при эксперим. исследованиях ионизации атомов электронным ударом (см. Франка — Герца опыт) Первый И. п.— И, п., соответствующий удалению наиболее слабо связанного электрона на из нейтрального невозбуждённого атома; удалению из ионизованного атома следующих электронов соответствуют второй, третий и т. д ЭНЕРГИЯ ИОНИЗАЦИИ Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность. На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации, электрона;
мера проникающей способности этого электрона;
межэлектронное отталкивание среди наружных (валентных) электронов.
Энергии ионизации элементов измеряется в Электронвольт на 1 атом или в Джоуль на моль.
