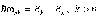- •Волновое уравнение
- •Дифракция Френеля на круглом отверстии
- •Дифракция Френеля от диска
- •5.Зоны Френеля. Дифракция Френеля на круглом отверстии и непрозрачном диске.
- •7. Дифракция рентгеновских лучей. Формула Вульфа-Брэгга.
- •8.Поляризация света. Закон Малюса. Поляризация света при отражении и преломлении. Угол Брюстера.
- •9.Распространение света в веществе. Дисперсия света. Нормальная и аномальная дисперсия
- •11.Тепловое излучение. Характеристики теплового излучения. Абсолютно черное тело.
- •12.Законы теплового излучения абсолютно черного тела. Закон Кирхгофа, Стефана-Больцмана. Законы Вина. Закон Релея-Джинса. «Ультрафиолетовая катастрофа».
- •13.Квантовая гипотеза. Формула Планка.
- •14.Корпускулярно-волновая двойственность свойств света.
- •15.Фотоэффект. Фотон, характеристики фотона.
- •16.Давление света.
- •17.Тормозное и характеристическое рентгеновское излучение.
- •18.Эффект Комптона.
- •19.Волновые свойства микрочастиц. Гипотеза де Бройля. Опыт Дэвиссона и Джермера. Дифракция электронов. Прохождение электронов сквозь две щели.
- •20.Соотношение неопределенностей Гейзенберга. Дифракция частицы на щели.
- •21.Волновая функция. Ее физический смысл и свойства.
- •22. Уравнение Шредингера. Движение свободной частицы. Стационарное силовое поле.
- •23.Частица в одномерной бесконечно глубокой потенциальной яме. Квантовая энергия.
- •24.Гармонический осциллятор в квантовой механике.
- •25.Прохождение частицы сквозь потенциальный барьер. Туннельный эффект.
- •26.Боровская теория атома. Опыт Резерфорда.
- •Планетарная модель атома
- •27.Спектральные серии излучения атомов водорода. Спектральные термы.
- •28.Постулаты Бора.
- •29.Расчет энергии и радиусов стационарных орбит водородоподобного атома.
- •30.Опыт Франка и Герца. Ионизационный потенциал.
Планетарная модель атома
После анализа многочисленных опытов, Резерфордом в 1911 году была предложена планетарная модель атома (ядерная модель атома).
Согласно этой модели в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Вокруг ядра вращаются по орбитам отрицательно заряженные электроны. Электроны движутся вокруг ядра на относительно больших расстояниях, подобно тому, как планеты вращаются вокруг солнца. Из совокупности этих электронов образуется электронная оболочка или электронное облако.
Атом в целом нейтрален, следовательно, абсолютное значение суммарного отрицательного заряда электронов равно положительному заряду ядра: число Z*e протонов в ядре равно числу электронов в электронном облаке и совпадает с порядковым номером (атомным номером) Z атома данного химического элемента в периодической системе Д.И.Менделеева.
27.Спектральные серии излучения атомов водорода. Спектральные термы.
Оптические спектры атомов являются линейчатыми. Это означает, что спектры излучения атомов состоят из отдельных спектральных линий. При этом каждый атом имеет свой характерный линейчатый оптический спектр.
Так, для простейшего атома водорода еще в 1885 г. была найдена эмпирически формула, получившая название обобщенной формулы Бальмера. Оказалось, что с большой точностью длины волн излучения для всех спектральных линий атома водорода описываются удивительно простым по форме соотношением
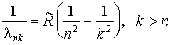 (5.1)
или
для частот излучения
(5.1)
или
для частот излучения
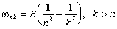 (5.1a)
В
этих формулах
(5.1a)
В
этих формулах 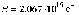 -
постоянная Ридберга,
-
постоянная Ридберга,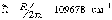 ,
а
,
а  и
и 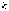 -
целые числа.
Известны
следующие серии
спектральных линий излучения
атома водорода, названные в честь их
первооткрывателей:
-
целые числа.
Известны
следующие серии
спектральных линий излучения
атома водорода, названные в честь их
первооткрывателей:
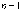 -
серия Лаймана (ультрафиолетовое
излучение)
-
серия Лаймана (ультрафиолетовое
излучение)
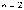 -
серия Бальмера (видимый свет)
-
серия Бальмера (видимый свет)
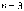 -
серия Пашена (инфракрасное излучение)
-
серия Пашена (инфракрасное излучение)
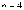 -
серия Брэкетта (инфракрасное излучение)
и др.
-
серия Брэкетта (инфракрасное излучение)
и др.
Схема
линий серии Бальмера в видимой части
спектра атома водорода приведена на
рис. 5.1. На рисунке символами 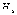 ,
, 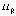 ,
, 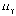 и
и 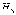 обозначены
характерные линии спектра излучения,
а
обозначены
характерные линии спектра излучения,
а 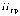 указывает
коротковолновую границу серии,
соответствующую в
формуле (5.1) значениям
указывает
коротковолновую границу серии,
соответствующую в
формуле (5.1) значениям 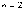 и
и 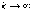 .
.
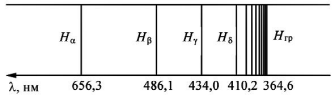 Частота
любой линии спектра излучения атома
водорода может быть представлена в виде
разности двух однотипных выражений,
которые зависят от целочисленных
параметров и называются спектральными
термами.
Действительно, (5.1a) можно
записать в виде
Частота
любой линии спектра излучения атома
водорода может быть представлена в виде
разности двух однотипных выражений,
которые зависят от целочисленных
параметров и называются спектральными
термами.
Действительно, (5.1a) можно
записать в виде
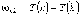 (5.2)
для
которого терм
(5.2)
для
которого терм
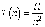 Соотношения (5.1) и (5.2) отражают
присущую атомам квантовую природу.
Действительно, если с помощью формулы
Планка связать частоту излучения атома
с его энергией, то из линейчатости
спектра излучения мы придем к выводу о
дискретности, то есть квантовании
энергии атома.
Соотношения (5.1) и (5.2) отражают
присущую атомам квантовую природу.
Действительно, если с помощью формулы
Планка связать частоту излучения атома
с его энергией, то из линейчатости
спектра излучения мы придем к выводу о
дискретности, то есть квантовании
энергии атома.
28.Постулаты Бора.
ПОСТУЛАТЫ БОРА
Бор сформулировал основные положения теории атома водорода в виде трех постулатов.
1.
Электрон в атоме может двигаться только
по определенным стационарным орбитам,
каждой из которых можно приписать
определенный номер
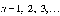 .
Такое движение соответствует стационарному
состоянию атома с неизменной полной
энергией
.
Такое движение соответствует стационарному
состоянию атома с неизменной полной
энергией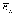 .
Это означает, что движущийся по
стационарной замкнутой орбите электрон,
вопреки законам классической
электродинамики, не излучает энергии.
.
Это означает, что движущийся по
стационарной замкнутой орбите электрон,
вопреки законам классической
электродинамики, не излучает энергии.
2.
Разрешенными стационарными орбитами
являются только те, для которых угловой
момент импульса
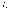 электрона
равен целому кратному величины постоянной
Планка
электрона
равен целому кратному величины постоянной
Планка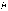 .
Поэтому для
.
Поэтому для -ой
стационарной орбиты выполняется условие
квантования
-ой
стационарной орбиты выполняется условие
квантования
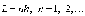 .
.
3.
Излучение или поглощение кванта излучения
происходит при переходе атома из одного
стационарного состояния в другое (рис.
5.4). При этом частота
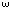 излучения
атома определяется разностью энергий
атома в двух стационарных состояниях,
так что
излучения
атома определяется разностью энергий
атома в двух стационарных состояниях,
так что