
- •III степень — железа заметна при осмотре, изменяет контур шеи, придавая ей
- •1. Эпителиальные опухоли:
- •2. Неэпителиальные опухоли:
- •3. Разные опухоли (злокачественная лимфома, карциносаркома, тератома). Злока- чественная гемангаоэндотелиома.
- •I стадия (то—t1 n0 мо) — опухоль диаметром 3 см, располагающаяся в толще ткани молочной железы, ие переходящая на окружающую жировую клетчатку и кожные покровы.
- •11А стадия (Tl—2n0m0) — опухоль диаметром 3—5 см, переходящая на окружащую клетчатку, с наличием кожных симптомов.
- •116 Стадия (Tl—2n1m0) — опухоль того же размера и вида или меньших размеров, но с наличием метастазов в подмышечных лимфатических узлах.
- •IV стадия (любое сочетание т и n при наличии Ml) — распространенное поражение молочной железы с диссеминацией по коже или обширным изъязвлением; опухоль с отдаленными метастазами.
- •1. Плоскоклеточный (эпидермоидный) рак:
- •4. Крупноклеточный рак: а) светлоклеточный.
- •I. По характеру экссудата: а) гнойные; б) гнилостные.
- •1. Зона кардиальных желез, выделяющих слизь.
- •3. Зона антральных желез, выделяющих растворимую слизь с рН, • близким к рН внеклеточной жидкости, и эндокринных g-клеток, вырабатывающих гормон гастрин.
- •1. Аденокарциномы: папиллярные, тубулярные муцинозные (слизистые), перстне- видно-клеточные.
- •I бассейн собирает лимфу от пилороантрального отдела, прилежащего к большой кривизне;
- •II бассейн собирает лимфу от пилороантрального отдела, прилежащего к малой кривизне, и от части тела желудка;
- •III бассейн (самый большой) собирает лимфу от тела желудка и малой кривизны, прилегающих отделов передней и задней стенок, кардии, медиальной части свода и абдоминального отдела пищевода;
- •IV бассейн собирает лимфу от вертикальной части большой кривизны желудка, прилегающих к ней передней и задней стенок, значительной части свода желудка.
- •I. Острый парапроктит.
- •II. Хронический парапроктит (свищи прямой кишки).
- •I. По локализации: в анальном отделе кишки (10%), нижнеампулярном, средне- ампулярном и верхиеампулярном отделах (60%), ректосигмоидном отделе (30%).
- •II. По типу роста: эндофитный (30%), экзофитный (20%), смешанный (50%).
- •III. По гистологическому строению: аденокарцинома, слизистый, солидный, пло- скоклеточный, недифференцированный, фиброзный рак.
- •IV. По стадии процесса: (от I до IV) или распространенности заболевания (тхм).
- •1900 Г. Австрийский иммунолог Landsteiner открыл группы крови аво.
- •Ордена Трудового Красного Знамени издательство "Медицина" 101000, Москва, Петровернгский пер., 6/8
- •150049, Ярославль, ул. Свободы, 97.
- •Isbn 5-2aS-0dRaD-m
I. По локализации: в анальном отделе кишки (10%), нижнеампулярном, средне- ампулярном и верхиеампулярном отделах (60%), ректосигмоидном отделе (30%).
II. По типу роста: эндофитный (30%), экзофитный (20%), смешанный (50%).
III. По гистологическому строению: аденокарцинома, слизистый, солидный, пло- скоклеточный, недифференцированный, фиброзный рак.
IV. По стадии процесса: (от I до IV) или распространенности заболевания (тхм).
Патологоанатомическая картина. Экзофитные опухоли имеют четкие контуры, растут в просвет прямой кишки. К ним относят полиповидный рак (опухоль на широком или узком основании, выступая в просвет кишки), бляшковидный (опухоль на широком основании, с плоской поверхностью, незначительно выступает в просвет кишки), ворсинчато-папиллярный рак (бугристая опухоль дольчатого строения).
Эндофитные опухоли характеризуются внутристеночным ростом; опухоль поражает стенку прямой кишки на большем или меньшем протяжении, в разной степени проникая в ее толщу (диффузно-ин-фильтративный рак) и сужая просвет кишки. Границы опухоли четко не определяются. На отдельных участках могут возникать изъязвления (эндофитно-язвенный рак). Стенка кишки становится ригидной.
Смешанный тип опухоли прямой кишки характеризуется тем, что наряду с ростом ее в просвет кишки происходит инфильтрация стенки на относительно большом протяжении. Смешанным ростом обладает блюдцеобразный рак, представляющий собой овальной или круглой формы изъязвление с плотными, бугристыми, валикообразно приподнятыми краями.
Гистологическая структура рака прямой кишки различна, однако у подавляющего большинства больных опухоль является аденокарци-номой, реже — слизистым (обычно растет эндофитно), солидным, плоскоклеточным, недифференцированным (обладает инфильтрирующим ростом) или фиброзным раком (скирр). Особенно высокой степенью злокачественности обладают слизистый, солидный, недифференцированный раки.
Принятая в нашей стране классификация рака прямой кишки выделяет четыре стадии заболевания.
Стадия I — небольшая подвижная опухоль (диаметром менее 2 см), не прорастающая стенку кишки и распространяющаяся не глубже подслизистой основы; метастазов нет.
Стадия 11а — опухоль занимает не более полуокружности кишки, не прорастает все слои ее стенкн (но прорастает в мышечный слой); метастазов нет.
Стадия Нб — опухоль таких же размеров, не прорастает кишечную стенку, имеются метастазы в регионарные лимфатические узлы.
Стадия Ша — опухоль занимает более полуокружности кишки, прорастает ее стенки, может быть сращена с окружающими органами и тканями.
Стадия Шб — то же с наличием множественных метастазов в регионарные лимфатические узлы.
Стадия IV — обширная неподвижная опухоль, врастающая в органы малого таза и окружающие ткани с множественными метастазами в регионарные лимфатические узлы или подвижная опухоль при наличии отдаленных метастазов.
Международная классификация рака прямой кишки по системе TNM
Окончательный диагноз при такой оценке ставят на основании клинических данных и результатов гистологических исследований удаленной опухоли.
Т — первичная опухоль.
Т1 — опухоль, занимающая '/3 или менее длины окружности прямой кишки, не прорастающая мышечный слой. . .
Т2 — опухоль, занимающая более /3, но не более /2 окружности кишки, прорастающая в мышечный слой, но не сопровождающаяся симптомами непроходимости кишечника. .
ТЗ — опухоль поражает более /3 окружности кишки, суживает ее просвет; имеются симптомы нарушения проходимости кишкн, опухоль не распространяется на соседние органы и ткани. ,
T4 — опухоль поражает более /4 окружности кншки н сопровождается выраженными симптомами нарушения проходимости кишки, распространяется на соседние органы и ткани.
N — регионарные лимфатические узлы.
NX — недостаточно данных для оценки регионарных лимфатических узлов.
NO — нет признаков метастатического поражения регионарных лимфатических узлов.
N1 — имеется поражение регионарных лимфатических узлов. М — отдаленные метастазы.
MX — недостаточно данных для оценки отдаленных метастазов. МО — нет признаков наличия отдаленных метастазов. Ml — имеются отдаленные метастазы.
Р — глубина поражения опухолью стенки кишки. РХ — глубина поражения неизвестна.
Р1 — опухоль инфильтрирует только слизистую оболочку кишки. Р2 — опухоль инфильтрирует подслизистую основу. РЗ — опухоль инфильтрирует мышечный слой.
Р4 — опухоль прорастает все слон стенкн кишки н выходит за ее пределы. G — степень дифференцировки раковых клеток.
G1 — аденокарцинома с высокой степенью дифференцировки раковых клеток. G2 — аденокарцинома со средней степенью дифференцировки раковых клеток. G3 — анапластическая карцинома.
Рак прямой кишки, разрастаясь, распространяется в просвет кишки и в толщу кишечной стенки (поражая подслизистую основу и мышечный слой), выходя затем за ее пределы и врастая в окружающие органы (влагалище, матка, мочевой пузырь, семенные пузырьки, мочеточники) и ткани. Одновременно с ростом опухоли в толщу кишечной стенки идет распространение ее по окружности прямой кишки. Инфильтрация раковыми клетками стенки кишки, определяемая при гистологическом исследовании, не превышает обычно 4—5 см от видимой на глаз границы опухоли. Метастазирование рака прямой кишки может идти лимфогенным (в регионарные и отдаленные лимфатические узлы), гематогенным (чаще всего в печень) и имплантационным путями (карциноматоз брюшины, распространение раковых клеток по поверхности слизистой оболочки).
Клиническая картина и диагностика. Рак прямой кишки развивается постепенно, клинические проявления возникают лишь при достижении опухолью значительных размеров и сводятся к болевым ощущениям, патологическим выделениям (кровь, слизь, гной) из прямой кишки и нарушению функции кишечника. Выраженность симптомов зависит от стадии заболевания, типа роста опухоли и ее локализации.
Болевые ощущения обычно не являются ранним симптомом рака прямой кишки. Они возникают в начале заболевания лишь при раке, локализующемся в анальном канале, так как обусловлены прорастанием опухолью зоны, богатой нервными окончаниями, растяжением пораженного анального канала при дефекации. При других локализациях опухоли появление болей свидетельствует о распространении ее за пределы кишечной стенки и поражении окружающих органов и тканей. Причиной возникновения схваткообразных болей может быть растяжение стенки кишки вследствие непроходимости, вызванной об-тураций просвета опухолью. Боли при раке прямой кишки постоянны. Они локализуются внизу живота, в крестцово-копчиковой области, в области заднего прохода, могут быть в области поясницы.
Патологические выделения часто являются симптомом, заставляюгцим больного обратиться к врачу. Это постоянный симптом заболевания. Кровотечение из прямой кишки при раке вызвано изъязвлением опухоли и травмой ее каловыми массами. Оно проявляется в виде примеси темного, реже алого цвета крови в кале. Нередко при дефекации вначале выходит небольшое количество крови, а затем кал с примесью крови. Анемизация больных наступает постепенно, так как сильных кровотечений обычно не бывает.
В результате распада опухоли и присоединения инфекции начинается воспаление, проявляющееся выделением из прямой кишки зловонного гноя и слизи в начале дефекации. Гной и слизь могут быть смешаны с каловыми массами или находиться на их поверхности. Наличие гноя и слизи является признаком далеко зашедшего процесса. Выделение крови, гноя и слизи при экзофитных опухолях начинается раньше, чем при эндофитных.
Нарушения функции кишечника проявляются поносом, запором, тенезмами. Понос и его смена запором возникают в результате проктосигмоидита, сопутствующего раку прямой кишки, и могут быть ранними симптомами заболевания. По мере инфильтрации стенки кишки опухолью или обтурации просвета кишки преобладающим симптомом становятся запоры. У некоторых больных возникают частые позывы на дефекацию, которые, однако, не сопровождаются отхождением кала (тенезмы). При этом из прямой кишки отделяется небольшое количество гноя, слизи, крови. Иногда первым симптомом заболевания является изменение формы кала (лентовидный). У некоторых больных имеется чувство неполного опорожнения прямой кишки после дефекации и ощущение наличия инородного тела в ней.
В связи с сужением просвета кишки развивающейся опухолью появляются симптомы кишечной непроходимости: вздутие живота, неотхождение кала и газов, урчание и схваткообразные боли в животе, рвота. Опухоль анального канала, приводя к разрушению сфинктера, может сопровождаться недержанием кала и газов. В зависимости от локализации рака преобладают те или иные перечисленные выше симптомы.
При раке анального канала ведущим и довольно ранним симптомом болезни является тупая постоянная боль в области заднего прохода, которая усиливается при дефекации. В связи с эндофитным ростом опухоли этой локализации часто наступает изъязвление новообразования, что проявляется в виде патологических примесей к калу: вначале крови, затем слизи и гноя. При этом за счет присоединения воспалительного процесса боли усиливаются. При распространении воспаления на пара ректальную клетчатку возникают свищи, через которые выделяются кал, кровь, слизь, гной. При прорастании опухоли в анальный сфинктер на большом протяжении наблюдается недержание газов, кала. Вместе с тем опухоль за счет сужения наиболее узкого отдела прямой кишки быстро приводит к развитию кишечной непроходимости. При раке анального канала метастазы распространяются в паховые лимфатические узлы, о чем нужно помнить при объективном исследовании больного.
При раке ампулярного отдела прямой кишки симптоматика более скудная. Первым симптомом болезни являются патологические примеси к калу. В это же время или несколько позже возникают симптомы нарушения функции кишечника. Боли появляются лишь при прорастании опухоли через все слои стенки кишки. При прорастании опухоли в мочевой пузырь возникают частые позывы на мочеиспускание, лей-коцитурия, микрогематурия, позднее могут сформироваться пузырно-прямокишечные свищи, характеризующиеся выделением кала и газов при мочеиспускании. При формировании влагалищно-прямокишечных свищей наблюдается выделение кала из влагалища. В связи с тем что ампула является наиболее широкой частью прямой кишки, кишечная непроходимость при данной локализации опухоли развивается редко.
Рак ректосигмоидного отдела прямой кишки проявляется прогрессирующими запорами с последующей полной кишечной непроходимостью.
Общими симптомами рака прямой кишки являются анемия, общая слабость, похудание, гипертермия; они появляются в поздние сроки заболевания.
Диагностика рака прямой кишки основывается на данных анамнеза, анализе жалоб больного и проведении специальных методов обследования: осмотра промежности, пальцевого исследования прямой кишки (можно определить около 50% опухолей прямой кишки), ирригогра-фии, ректороманоскопии с биопсией.
Учитывая скудность клинических проявлений рака прямой кишки в ранних стадиях заболевания, следует придавать важное значение жалобам больных на нарушения функции кишечника и при их наличии прибегать к специальным методам обследования. При диспансерном обследовании больных всегда необходимо производить пальцевое исследование прямой кишки.
Пальцевое исследование прямой кишки — наиболее простой и доступный метод, нередко позволяющий установить факт наличия заболевания и в известной мере определить его распространенность. Оно может быть выполнено в коленно-локтевом положении больного, в положении на спине, на корточках, на боку. Наиболее целесообразно сочетать пальцевое исследование прямой кишки в коленно-локтевом положении с исследованием в положении больного на корточках. Последнее положение дает возможным достижение опухолей, расположенных на расстоянии 10—12 см от заднего прохода. У женщин, кроме пальцевого исследования прямой кишки, обязательно выполняют исследование через влагалище.
Пальцевое исследование прямой кишки при раке проводят с целью определения наличия опухоли, ее локализации (расстояние от сфинктера), размеров, протяженности, подвижности, наличия изъязвлений, степени сужения просвета кишки, характера отделяемого из прямой кишки.
Рак прямой кишки при пальцевом исследовании определяют в виде опухолевого узла, выступающего в просвет кишки, или язвы с плотными краями, ригидности и уплотнения стенки кишки. Установив наличие опухоли при пальцевом исследовании прямой кишки, необходимо провести пальпацию паховых областей для определения состояния лимфатических узлов.
Следующим методом исследования прямой кишки является ректо-романоскопия. Она позволяет уточнить данные, полученные при пальцевом исследовании, выполнить биопсию, т. е. верифицировать диагноз путем получения сведений о гистологической структуре опухоли. Кроме того, ректороманоскопия делает возможной диагностику опухолей, недостижимых при пальцевом исследовании прямой кишки, расположенных на расстоянии более 15 см от заднего прохода. Ректоромано-скопию выполняют в коленно-локтевом положении больного, предварительно хорошо подготовив его кишечник. Осмотр слизистой оболочки прямой кишки производят как при введении ректоскопа, так и при его извлечении.
Ректороманоскопия, как и пальцевое исследование, не всегда дает ответ на все вопросы, так как ректоскоп нередко удается провести лишь до опухоли. Протяженность опухоли и состояние расположенных выше нее отделов толстой кишки могут остаться неизвестными. В такой ситуации большую ценность приобретает рентгенологический метод исследования, проводимый с помощью введения в кишку бариевой взвеси (контрастная клизма). Ирригоскопия и колоноскопия позволяют выявить первично-множественное поражение ободочной и прямой кишки.
Для обнаружения отдаленных метастазов, которые наиболее часто возникают в печени, применяют ангиографию (целиакографию), сканирование печени, ультразвуковое исследование, компьютерную томографию, лапароскопию. Из этих методов наиболее информативны компьютерная томография и лапароскопия.
Осложнения. Наиболее частыми осложнениями рака прямой кишки являются острая непроходимость кишечника, перфорация кишки, свищи (пузырно-прямокишечный, влагалищно-прямокишечный, пара ректальный).
Перфорация кишки возникает при непроходимости вследствие чрезмерного растяжения ее стенки выше опухоли. Возможна также перфорация кишки в зоне самой опухоли (особенно часто при ее распаде). Перфорация в брюшную полость ведет к каловому перитониту, перфорация в параректальную клетчатку — к развитию абсцесса или флегмоны.
Дифференциальная диагностика. Рак прямой кишки дифференцируют от геморроя, полипов, сифилиса, туберкулеза. Как для рака прямой кишки, так и для геморроя характерным симптомом является выделение крови, однако при раке кровь темного цвета, измененная, иногда со сгустками, появляется перед выделением кала или смешивается с ним, а при геморрое кровь алого цвета, выделяется в конце акта дефекации.
Гистологическое исследование позволяет дифференцировать рак прямой кишки от полипов, туберкулеза и сифилиса. При сифилисе серологические реакции, а при туберкулезе бактериологические методы исследования способствуют разрешению диагностических трудностей.
Лечение. Основным методом является хирургическое лечение. Его могут дополнять химиотерапия и лучевой метод.
Хирургическое лечение. Во время предоперационной подготовки за 2—3 дня до операции больному назначают бесшлаковую диету, слабительные препараты, производят очистительные клизмы (дважды в день). При наличии частичной непроходимости кишечника подготовку к операции проводят на протяжении 7—8 дней. Нередко в комплекс предоперационной подготовки включают назначение препаратов бак-териостатического действия для подавления кишечной микрофлоры (левомицетин, норсульфазол, трихопол). В последние годы с успехом применяют предоперационную подготовку с помощью ортоградного промывания кишечника (см. «Рак ободочной кишки»).
Радикальные операции при раке прямой кишки направлены на излечение больного путем удаления опухоли и регионарных лимфатических узлов. Наиболее часто используют брюшно-промежностную экстирпацию прямой кишки, переднюю резекцию прямой кишки; брюшно-анальную резекцию прямой кишки с низведением сигмовидной ободочной (или поперечной ободочной) кишки, операцию Хартманна (обструктивная резекция).
Выбор метода радикальной операции при раке прямой кишки определяется главным образом расстоянием опухоли от заднепроходного отверстия. При локализации опухоли на расстоянии менее б—7 см от заднего прохода прибегают к брюшно-промежностной экстирпации прямой кишки. Расположение опухоли на расстоянии более 6—7 см от заднего прохода делает возможным выполнения сфинктеросохра-няющих операций (брюшно-анальная резекция с низведением сигмовидной кишки). При расположении опухоли выше 10—12 см от заднего прохода целесообразна передняя резекция прямой кишки. Операцию Хартманна (обструктивную резекцию прямой кишки) производят при расположении опухоли выше 10—12 см от заднего прохода и невозможности выполнения по тем или иным причинам передней резекции прямой кишки (например, при экстренной операции, выполняемой в связи с непроходимостью кишечника, когда вмешательство производят на неподготовленной кишке).
Выбирая метод радикальной операции при раке прямой кишки, следует учитывать также конституциональные особенности больного, наличие и тяжесть сопутствующих заболеваний.
Операция Кеню (брюшно-промежностная экстирпация прямой кишки) заключается в удалении всей прямой кишки и части сигмовидной ободочной с наложением одноствольного противоестественного заднего прохода в левой половине подвздошной области (рис. 104). Операция состоит из двух этапов — брюшного и промежностного. Брюшной этап операции выполняют из нижней срединной лапаротомии. Перевязывают и пересекают нижнюю брыжеечную артерию (и вену) ниже отхождения от нее левой толстокишечной артерии, рассекают брыжейку сигмовидной кишки, а саму кишку перевязывают. Мобилизуют сигмовидную и прямую кишку. Сигмовидную кишку перевязывают и выводят в левой подвздошной области на брюшную стенку, формируя противоестественный задний проход. Рану брюшной стенки зашивают. Переходят к промежностному этапу. Вокруг заднего прохода накладывают и затягивают кисетный шов. На расстоянии 2—3 см от
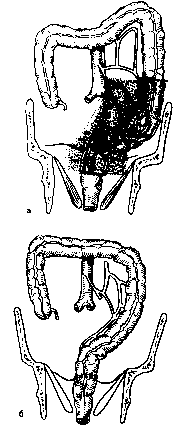
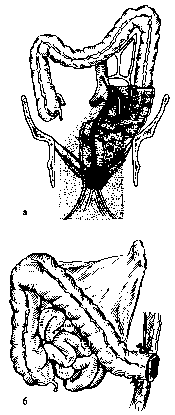
Рис. 104. Операция Кеню — брюшно-про-межностиая экстирпация прямой кишки, а — зона резекции; б — вид после завершения операции.
Рис 105. Передняя резекция прямой кишки.
а — зона резекции; б — вид после наложения анастомоза.
заднего прохода окаймляющим разрезом рассекают кожу, подкожную жировую клетчатку, пересекают заднепроходно-копчиковую связку и мышцы, поднимающие задний проход. Завершив мобилизацию прямой кишки, ее удаляют. Промежностную рану зашивают, оставляя дренаж в пресакральном пространстве.
Целесообразно выполнение операции двумя бригадами хирургов, синхронно выполняющих оба этапа, что более полно отвечает требованиям абластики.
Переднюю резекцию прямой кишки выполняют из нижней срединной лапаротомии. После мобилизации прямой кишки ее пересекают на 4—5 см ниже опухоли. Пересекают сигмовидную ободочную кишку (удаляя тем самым подлежащий резекции участок кишки) и накладывают анастомоз между сигмовидной ободочной кишкой и культей
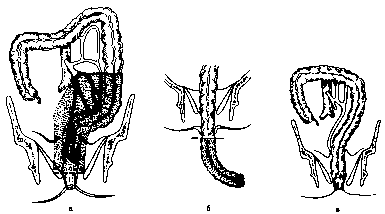
Рис 106. Брюшно-анальная резекция прямой кишки с низведением.
а — зона резекции кишки; б — низведение нисходящей кишки; в — вид после завершения
операции.
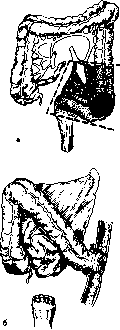
Рис 107. Операция по Хартманну.
а — зона резекции; б — вид после завершения операции.
прямой кишки (рис. 105). В пресакральное пространство вводят дренаж, а в кишку через задний проход — зонд, проводя его выше линии анастомоза — для декомпрессии кишки.
При брюшно-анальной резекции прямой кишки с низведением сигмовидной, нисходящей или поперечной ободочной кишки производят нижнюю срединную лапаротомию. Мобилизуют прямую, сигмовидную и нисходящую ободочную кишки. Рану брюшной стенки зашивают. После растяжения заднего прохода стенку кишки рассекают по прямокишечно-заднепроходной линии и отсепаровывают слизистую оболочку до верхнего края анального канала, перфорируют мышечную оболочку прямой кишки над анальным каналом и отсекают прямую кишку. Низводят прямую и сигмовидную ободочную кишку через задний проход и отсекают сигмовидную ободочную кишку на уровне, определенном при брюшном этапе операции. Края низведенной кишки фиксируют по окружности анального канала (рис. 106).
Операцию Хартманна выполняют из нижней срединной лапаротомии. Мобилизуют сигмовидную и прямую кишки. Пересекают прямую кишку ниже опухоли, культю кишки ушивают. Отсекают пораженный отдел кишки и накладывают одноствольный противоестественный задний проход в левой подвздошной области (рис. 107).
Паллиативные операции преследуют целью лишь продление жизни больного и уменьшение его страданий. Их выполняют при развитии выраженных симптомов кишечной непроходимости и невозможности выполнения радикальной операции. Они заключаются в наложении двуствольного противоестественного заднего прохода на передней брюшной стенке в левой подвздошной области, для чего выводят и вскрывают сигмовидную ободочную кишку.
Комбинированное лечение. Применение предоперационной лучевой терапии в настоящее время считают целесообразным при местно распространенном раке прямой кишки. В этом случае оно позволяет увеличить операбельность и улучшить результаты хирургического лечения, повышая частоту пятилетней выживаемости больных.
Для химиотерапии рака прямой кишки после радикальных операций использовали фторурацил и фторафур, однако данных, которые убедительно свидетельствовали бы об увеличении пятилетней выживаемости больных при таком лечении, не получено.
Прогноз. 5-Летняя выживаемость после радикального хирургического лечения при раке прямой кишки составляет около 40—50%. Она зависит прежде всего от стадии заболевания, гистологической структуры и формы роста опухоли. Прогноз благоприятнее в случае, если операция произведена в I—II стадиях заболевания, при экзофит-ной опухоли, особенно если она имеет высокую степень дифференцировки. Прогноз менее благоприятен у молодых больных, особенно при анальном раке.
НЕПРОХОДИМОСТЬ КИШЕЧНИКА
Непроходимость кишечника — заболевание, характеризующееся частичным или полным нарушением продвижения содержимого по пищеварительному тракту. Наиболее часто непроходимость кишечника наблюдается у лиц в возрасте 40—60 лет, у мужчин несколько чаще, чем у женщин.
Все виды непроходимости кишечника подразделяют на следующие основные группы.
Механическая непроходимость: 1) обтурационная; 2) странгуля-ционная; 3) сочетанная (обусловленная комбинацией обтурации и странгуляции).
Динамическая непроходимость: 1) паралитическая; 2) спастическая.
При механической непроходимости в зависимости от уровня препятствия различают высокую (тонкокишечную) и низкую (толстокишечную) непроходимость.
По степени закрытия просвета кишки выделяют полную и частичную непроходимость. Последняя часто протекает по хроническому типу. В экстренной хирургии большое значение имеет острая непроходимость кишечника. Среди всех острых хирургических заболеваний органов брюшной полости она наблюдается в 3,5—9,0% случаев.
ОСТРАЯ НЕПРОХОДИМОСТЬ
Этиология и патогенез. Обтурационная непроходимость кишечника возникает при закупорке просвета кишки опухолями, исходящими из стенки кишки; Рубцовыми сужениями просвета кишечника; желчными конкрементами, перфорировавшими стенку желчного пузыря и кишки; копролитами, клубками аскарид; проглоченными инородными телами. Обтурационная непроходимость может развиваться также вследствие закрытия просвета кишки извне при сдавлении ее спайками, опухолями или большими кистами, исходящими из соседних органов.
Странгуляционная непроходимость кишечника сопровождается нарушением кровообращения в сосудах брыжейки, возникает в результате заворота кишечной петли вокруг своей оси, образования узла между несколькими петлями кишок, ущемления кишечных петель, их брыжеек и сосудов в грыжевых воротах при наружных и внутренних грыжах, ущемления кишки с брыжейкой под спайками или Рубцовыми тяжами.
К сочетанной механической непроходимости кишечника относят инвагинацию — внедрение одной кишки в другую. При этом внедрившаяся кишка закупоривает просвет другой кишки (обтурация). Наряду с закупоркой просвета кишки происходит также и сдавление сосудов брыжейки инвагинировавшейся петли (странгуляция).
Иногда выделяют спаечную непроходимость кишечника. При этом подчеркивается только этиологический момент возникновения непроходимости — наличие спаек в брюшной полости. Спаечная непроходимость кишечника может протекать по обтурационному или стран-гуляционному типу.
Динамическая непроходимость кишечника характеризуется либо стойким спазмом, либо, наиболее часто, стойким парезом кишечника. В основе функциональных расстройств, ведущих к паралитической динамической непроходимости, лежат острые воспалительные процессы в брюшной полости (холецистит, панкреатит, аппендицит, перитонит) и забрюшинной клетчатке (паранефрит и др.); травмы и травматичные операции, интоксикация, острые нарушения кровообращения в органах брюшной полости (тромбоз брыжеечных сосудов, инфаркт селезенки), забрюшинные гематомы и др. Метаболические нарушения (диабетическая, уремическая кома); интоксикация, гипокалиемия также могут привести к развитию паралитической непроходимости кишечника. Спастическая динамическая непроходимость чаще вызывается аскаридами, отравлением свинцом, плоскостными спайками в брюшной полости, печеночной порфирией. Прекращение или резкое замедление пассажа кишечного содержимого по кишечнику, вызванное обтурацией или странгуляцией кишки, приводит к многочисленным местным и общим функциональным и морфологическим изменениям в организме больного. При всех формах острой непроходимости кишечника начальным и очень важным звеном патогенеза является растяжение стенки кишки жидким содержимым и газом. В связи с этим диаметр кишки выше места препятствия, вызвавшего непроходимость, увеличивается, ее стенка истончается, давление в кишке возрастает. Это ведет к сдав-лению мелких вен и лимфатических сосудов кишечной стенки. Всасывание жидкости и пищеварительных соков замедляется, а затем прекращается (в норме в течение суток в кишечник поступает 6—8 л пищеварительных соков, которые в нормальных условиях почти полностью реабсорбируются).
При острой непроходимости кишечника большая их часть выделяется со рвотой наружу. При этом организм теряет не только жидкость, но и большое количество белка, ферментов и электролитов, главным образом натрия и хлора. Поступление воды в организм извне прекращается, так как выпитая жидкость не всасывается, а лишь усиливает рвоту и степень перерастяжения кишки. У больных развиваются ги-похлоремия и начальная дегидратация организма.
Вследствие сдавления вен в стенке кишки резко нарушается кровоток в микроциркуляторном русле, развивается отек стенки приводящей кишки, отечная жидкость поступает как в просвет кишки, так и в свободную брюшную полость. Наступают гиповолемия и дегидратация. Потеря жидкости достигает 10% массы тела больного и приводит к возникновению гемоконцентрации, относительному увеличению содержания гемоглобина и увеличению гематокрита. Минутный и ударный объемы сердца уменьшаются, развивается гиповолемический шок, централизация кровообращения, нарушение микроциркуляции во всех тканях организма с синдромом диссеминированного внутрисосудистого свертывания. В результате развиваются почечная и печеночная недостаточность, шоковое легкое, дыхательная и надпочечниковая недостаточность.
В ответ на развивающуюся гиповолемию и дегидратацию в организме усиливается выработка антидиуретического гормона и альдо-стерона. Это приводит к сокращению диуреза, реабсорбции натрия и выделению калия с мочой и рвотными массами. В результате развивается гипокалиемия и связанные с ней нарушения тонуса мышц, сократительной способности миокарда, кишечной перистальтики. Гипокалиемия приводит к перераспределению калия между клеткой и внеклеточной жидкостью. Место ионов К в клетке занимают Na и Н , что приводит к развитию внутриклеточного ацидоза и внеклеточного алкалоза, к нарушению функций клетки.
По мере нарастания олигурии выведение К замедляется, уровень его в крови" начинает возрастать, особенно в связи с гибелью клеток и распадом белков. Гипокалиемия сменяется гиперкалиемией, алкалоз — метаболическим ацидозом. Деятельность сердца, легких, печени, почек, ЦНС нарушается в еще большей степени.
Нарушение кровообращения в стенке приводящего отдела кишки, гипоксия ее тканей приводят к некрозу слизистой оболочки на протяжении 40—50 см проксимальнее места препятствия. Проницаемость стенки кишки увеличивается, в связи с чем микроорганизмы из просвета кишки могут проникать в брюшную полость и способствовать развитию перитонита. При тяжелых формах непроходимости (например, толстокишечной, вызванной опухолью) нередко наблюдается перфорация стенки кишки.
Патофизиологические изменения в организме быстрее возникают при высокой тонкокишечной непроходимости (тощая и подвздошная кишка). При низкой толстокишечной непроходимости развитие указанных выше изменений замедлено.
При странгуляционной непроходимости в приводящем отрезке кишки выше места странгуляции происходят аналогичные как местные, так и общие изменения, однако имеются и существенные различия. В результате сдавления сосудов брыжейки ущемленной кишки в ней нарушается прежде всего венозный отток. Кишка становится полнокровной, застойно-синюшной. Ее стенка и брыжейка отекают, артериальное кровоснабжение в них резко нарушается или прекращается. В результате этого развивается не только некроз слизистой оболочки, но и гангрена ущемленной петли кишки. В брюшную полость из просвета кишки поступает большое количество грамотрицательной микрофлоры, развивается перитонит, часто заканчивающийся в более ранние сроки недостаточностью функции печени, почек, сердца, легких, ЦНС и септическим шоком (см. «Перитонит»).
Патологоанатомическая картина. Наиболее выраженные анатомические изменения наблюдаются при странгуляционной непроходимости кишечника. Они характеризуются нарушениями кровообращения и лимфооттока, альтернативно-деструктивными процессами и воспалительными реакциями. Характер и тяжесть изменений в стенке кишечника зависят от сроков существования непроходимости, однако четкого соответствия здесь нет. Это может быть связано с различной степенью компрессии сосудов. Наиболее выражены изменения в отделах кишки, подвергшейся ущемлению, на месте локализации странгуляционных борозд и в приводящем отделе кишки.
Кишечные петли приводящего отдела при механической непроходимости увеличены в диаметре; просвет их переполнен жидким и газообразным содержимым. Стенки кишки в связи с отеком и последующими воспалительными изменениями утолщены; серозный покров их тусклый, гиперемированный. Под серозной оболочкой и в подслизистой основе отмечаются кровоизлияния. Они имеют различную форму и размеры. На слизистой оболочке нередко обнаруживают зоны некроза, а в более поздние сроки заболевания — глубокие язвы, которые часто находятся в стадии перфорации. Указанные некробио-тические и воспалительные изменения в приводящей кишке обнаруживают на протяжении 40—60 см от места препятствия. Петли отводящего отдела кишки находятся в спавшемся состоянии. Деструктивно-воспалительные явления в стенке кишки ниже места препятствия выражены незначительно и имеют протяженность не более 8—10 см.
Изменения во внутренних органах при острой непроходимости кишечника неспецифичны и отражают явления гиповолемического шока, метаболических расстройств и перитонита.
Клиническая картина и диагностика. Ведущими симптомами острой кишечной непроходимости являются схваткообразные боли (появляются в момент возникновения перистальтической волны, определяемой при аускультации брюшной полости), рвота, усиленная перистальтика, задержка стула и газов. Указанные симптомы наблюдаются при всех формах механической непроходимости кишечника, но степень их выраженности бывает различной и зависит от вида, характера и уровня непроходимости, а также от сроков, прошедших с начала заболевания.
Боли — самый ранний и постоянный симптом острой непроходимости кишечника. Они начинаются внезапно, часто без видимых причин. При обтурационной непроходимости боли носят схваткообразный характер. Между периодами схваток они утихают и на короткое время (на 2—3 мин) могут полностью исчезать. При странгуляционной непроходимости боли бывают чрезвычайно интенсивными; носят постоянный острый характер, усиливаясь до «нестерпимых» в период бурной перистальтики.
Рвота возникает у большинства больных (70%): при высокой непроходимости она бывает многократной и не приносит облегчения, при низкой — рвота редкая и в раннем периоде заболевания может отсутствовать. При далеко зашедших формах кишечной непроходимости рвотные массы имеют каловый запах вследствие гнилостного разложения содержимого приводящего отдела кишечника.
Задержка стула и газов — важный, но не абсолютно достоверный симптом непроходимости кишечника. В первые часы заболевания при высокой непроходимости стул может быть самостоятельным, могут частично отходить газы, что объясняется либо неполным закрытием просвета кишки, либо опорожнением от содержимого отделов кишечника, находящихся ниже места препятствия. При низкой непроходимости кишечника (сигмовидная ободочная кишка) стула обычно не бывает.
Общее состояние при непроходимости кишечника у большинства больных тяжелое. Они беспокойны. Температура тела в начале заболевания нормальная или субнормальная (35,5—35,8 °С). При осложнении непроходимости перитонитом температура тела повышается до 38—40 °С. Характерны выраженная тахикардия и низкое артериальное давление.
Язык при выраженной клинической картине сухой, покрыт желтым налетом. В терминальных стадиях заболевания появляются трещины слизистой оболочки, афты, что указывает на тяжелую интоксикацию, обезвоживание и наличие перитонита.
Вздутие живота — один из частых признаков острой непроходимости кишечника. Однако при высокой непроходимости вздутие живота может отсутствовать; при непроходимости нижних отделов тонкой кишки отмечается симметричное вздутие живота. Асимметрия живота наблюдается при толстокишечной непроходимости. В зависимости от уровня непроходимости может быть вздута только правая половина ободочной кишки или вся ободочная кишка. В поздние сроки при возникновении недостаточности илеоцекального клапана живот становится симметрично вздутым. При заворотах сигмовидной ободочной кишки отмечается вздутие верхних отделов правой или левой половины живота, и тогда живот принимает характерный «перекошенный» вид. При динамической паралитической непроходимости вздутие живота равномерное.
При механической непроходимости иногда прослеживается видимая на глаз перистальтика кишечника. Особенно выраженной такая перистальтика бывает при подострых и хронических формах обтурационной непроходимости, когда успевает гипертрофироваться мышечный слой приводящего отдела кишечника.
Брюшная стенка при поверхностной пальпации обычно не напряжена. При глубокой пальпации иногда можно обнаружить наибольшую болезненность в месте расположения кишечных петель, подвергшихся странгуляции. У ряда больных удается прощупать фиксированную и растянутую в виде баллона петлю кишки (симптом Балд), при перкуссии над которой слышен тимпанический звук с металлическим оттенком (положительный симптом Кивуля). В поздние сроки заболевания при сильном растяжении кишечника определяется характерная резистентность брюшной стенки.
Перистальтические шумы в первые часы заболевания усилены, нередко слышны на расстоянии. При аускультации можно определить усиленную перистальтику (урчание, переливание, булькание, симптом падающей капли). Бурная перистальтика более характерна для обту-рации. При странгуляции усиление перистальтических шумов наблюдают в начале заболевания. В дальнейшем вследствие некроза кишки и перитонита перистальтические шумы ослабевают и исчезают (симптом «гробовой тишины»).
При перкуссии живота над растянутыми кишечными петлями определяют высокий тимпанит. Одновременно с этим над растянутыми кишечными петлями слышен шум плеска, что свидетельствует о скоплении в приводящей петле жидкости и газа.
При пальцевом исследовании прямой кишки нередко выявляют баллонообразное расширение ампулы прямой кишки и зияние заднего прохода вследствие ослабления тонуса сфинктера прямой кишки (положительный симптом Обуховской больницы).
При исследовании крови в связи с дегидратацией и гемоконцент-рацией обнаруживают увеличение количества эритроцитов (до 5— 6*10 /л), повышение содержания гемоглобина, высокий уровень ге-матокрита, а в более поздних стадиях при развитии воспалительных изменений лейкоцитоз — 10—20*10 /л и увеличение СОЭ.
В связи с тяжелыми патофизиологическими сдвигами при лабораторных исследованиях наблюдают уменьшение объема циркулирующей плазмы, различные степени дегидратации, снижение содержания калия и хлоридов крови, гипопротеинемию, азотемию и изменения кислотно-основного состояния в сторону как алкалоза, так и ацидоза (в зависимости от стадии заболевания). По мере увеличения сроков заболевания указанные изменения нарастают.
Диагноз основывается на анализе данных анамнеза и клинического исследования. Особое значение при острой непроходимости кишечника имеет рентгенологическое исследование, которое должно быть проведено тотчас, как только возникнет подозрение на это заболевание.
Рентгенологическое исследование при острой непроходимости кишечника заключается в обзорной рентгеноскопии и рентгенографии брюшной полости; в диагностически сложных ситуациях — в иссле-

Рис 108. Рентгенологические признаки различных локализаций кишечной непроходимости.
а — стеноз двенадцатиперстной кишки (инфрапапилляриый); б — высокая тонкокишечная непроходимость; в — низкая тонкокишечная непроходимость; г — толстокишечная непроходимость; 1 — газ в желудке; 2 — газ в тонкой кишке (симптом Клойберв); 3 — жидкость; 4 — «аркада»; 5 — круговые складки Керкринга; б — растянутая газом слепая кишка; 7 — гаустры; 8 — опухоль, обтурируюшая кишку; 9 — растянутая газом толстая кишка; 10 — свободная от газа спавшаяся кишка ниже уровня стеноза.
довании с контрастированием тонкой и толстой кишки путем инте-стиноскопии и ирригоскопии.
Обзорное рентгенологическое исследование живота с целью получения большей информативности выполняют в вертикальном и горизонтальном положениях исследуемого (латероскопия). При этом выявляют отдельные петли кишечника, заполненные жидкостью и газом. В норме газ имеется лишь в ободочной кишке. Наличие газа в тонкой кишке указывает на непроходимость кишечника (рис. 108). Скопления газа над горизонтальными уровнями жидкости имеют характерный вид перевернутых чаш (симптом чаши Клойбера), а также дугообразно или вертикально расположенных петель тонкой кишки, раздутой газом (симптом «органных труб»). Они появляются при странгуляциях через 1—2 ч от начала заболевания, при обтурации — через 3—5 ч. По размерам чаш Клойбера, их форме и локализации можно судить об уровне непроходимости кишечника.
В случае тонкокишечной непроходимости чаши Клойбера имеют небольшие размеры, горизонтальные уровни жидкости ровные; на фоне газа хорошо видны круговые складки слизистой оболочки тонкой кишки (складки Керкринга), принимающие форму растянутой спирали. При непроходимости тощей кишки горизонтальные уровни жидкости локализуются в левом подреберье и эпигастральной области. При непроходимости терминального отдела подвздошной кишки уровни жидкости расположены в чревной области. При тонкокишечной непроходимости, кроме чаш Клойбера, на рентгенограммах определяют растянутые газом кишечные петли, принимающие форму аркад.
В случае толстокишечной непроходимости горизонтальные уровни жидкости расположены по периферии брюшной полости, в боковых отделах живота. Обычно их численность меньше, чем при тонкокишечной непроходимости. Вертикальные размеры чаш Клойбера преобладают над горизонтальными. На фоне газа видны циркулярные выпячивания стенки ободочной кишки (гаустры). Уровни жидкости из-за особенностей содержимого толстой кишки не имеют ровной поверхности («зеркала»).
При динамической паралитической непроходимости (в отличие от механической) горизонтальные уровни жидкости наблюдаются одновременно как в тонкой, так и в ободочной кишке.
В диагностически сложных случаях применяют исследование с контрастированием тонкой и ободочной кишок. При непроходимости тонкой кишки интестиноскопия позволяет выявить расширение кишки выше места препятствия, замедленный пассаж контрастного вещества по кишке (свыше 4 ч). В случае непроходимости толстой кишки ир-ригоскопия помогает установить уровень и причину непроходимости. На рентгенограммах можно обнаружить сужение и дефекты наполнения, обусловленные наличием опухоли в кишке, сужение дистального отдела сигмовидной ободочной кишки в виде клюва при ее заворотах; дефекты наполнения в виде полулуния, двузубца при идеоцекальной инвагинации.
У отдельных больных с целью ранней диагностики непроходимости ободочной кишки и выяснения ее причины следует применять ректо-и колоноскопию.
Дифференциальная диагностика. Важное значение имеет дифференциальный диагноз механической и динамической непроходимости кишечника. Точный дооперационный диагноз очень важен, так как тактика, методы предоперационной подготовки и лечение этих двух видов непроходимости различны.
В отличие от механической непроходимости кишечника при динамической паралитической непроходимости боли в животе носят, как правило, постоянный распирающий характер. Схваткообразные боли отсутствуют. Имеются симптомы основного заболевания, вызвавшего динамическую непроходимость кишечника. При паралитической непроходимости живот вздут равномерно; перистальтика с самого начала ослаблена или отсутствует, что является очень важным признаком. При спастической непроходимости боли схваткообразного характера, живот не вздут, а иногда бывает втянутым. Ошибки в диагностике непроходимости кишечника часто связаны с отсутствием динамического наблюдения за больным с неясной клинической картиной заболевания.
Лечение. Перед началом лечения необходимо четко знать вид непроходимости. При странгуляционной непроходимости или обоснованном подозрении на нее показана экстренная операция, ибо задержка хирургического вмешательства может привести к некрозу кишки и распространенному перитониту. Допустима лишь кратковременная предоперационная подготовка, направленная на коррекцию нарушенного гомеостаза.
При отдельных видах низкой обтурационной непроходимости кишечника на ранних стадиях можно попытаться использовать консервативное лечение. Для этого применяют: 1) постоянную аспирацию желудочного и кишечного содержимого, что способствует у ряда больных восстановлению моторной функции желудка и кишечника; 2) сифонную клизму, которая позволяет при толстокишечной обтурационной непроходимости кишечника вывести газы и кишечное содержимое, скопившиеся выше места препятствия, ликвидировать заворот сигмовидной ободочной кишки, устранить инвагинацию.
Консервативное лечение (промывание желудка, аспирация дуоденального и кишечного содержимого, сифонные клизмы, спазмолитические или антихолинэстеразные средства) в случае отсутствия выраженного эффекта должно проводиться не более 2 ч. Продолжение консервативного лечения свыше указанного срока опасно из-за возможности развития необратимых изменений в кишечнике, брюшной полости и жизненно важных органах. Определить эффективность консервативного лечения позволяет контрольное рентгенологическое исследование органов брюшной полости; сохранение тонкокишечных уровней обычно указывает на неэффективность консервативной терапии.
Абсолютными противопоказаниями к консервативному методу лечения как основному в лечении обтурационной непроходимости кишечника являются признаки нарастающей интоксикации и перитонита.
Хирургический метод лечения острой механической непроходимости кишечника является основным.
При операциях по поводу острой непроходимости кишечника применяют комбинированный эндотрахеальный наркоз. Этот вид обезболивания обеспечивает достаточную глубину наркоза и хорошую релаксацию мышц брюшной стенки.
Оперативный доступ при непроходимости кишечника зависит от характера и локализации препятствия в кишечнике. Наиболее часто используют широкую срединную лапаротомию, позволяющую с наименьшей травматичностью и более быстро выполнить полноценную ревизию и произвести весь необходимый объем операции.
После лапаротомии с целью блокады рефлексогенных зон производят анестезию брыжейки тонкой и толстой кишки, области чревного сплетения (100—150 мл 0,25% раствора новокаина). Это мероприятие предотвращает развитие шока во время операции и в ближайшие сроки после нее.
Место препятствия в кишке определяют по состоянию кишечных петель. Выше места непроходимости кишечные петли раздуты, ниже находятся в спавшемся состоянии. Нередко детальная ревизия и определение места непроходимости бывают затруднены из-за резкого вздутия кишечника. Вот почему еще до проведения ревизии производят декомпрессию раздутых кишечных петель. Опорожнение раздутых петель тонкой кишки во время операции осуществляют с помощью специального «окончатого» двухпросветного назоинтестинального зонда.
Для устранения непроходимости используют различные оперативные приемы. В зависимости от вида, характера механической непроходимости, ее уровня и степени макроскопических морфологических изменений в кишке применяют: 1) рассечение рубцовых тяжей, которые сдавили или ущемили кишку, 2) резекцию кишки при опухолевом ее поражении, 3) расправление заворота или узла при странгуляции, 4) энтеротомию при инородных телах в просвете кишки, 5) дезинва-гинацию, 6) колостомию или наложение противоестественного заднего прохода при иноперабельных опухолях, 7) обходные анастомозы между кишечными петлями.
Резекцию кишки обязательно проводят в пределах здоровых тканей. Для этого линия пересечения кишки в проксимальном направлении должна быть проведена на расстоянии не менее 40—60 см от места препятствия, а в дистальном — на расстоянии 10—15 см от него. После резекции тонкой кишки операцию заканчивают наложением межкишечного анастомоза. Это правило не относится к толстокишечной непроходимости, в хирургическом лечении которой одномоментное наложение межкишечного анастомоза часто приводит к недостаточности швов и развитию перитонита. Только при правосторонней локализации опухоли, обтурирующей восходящую и правую половину поперечной ободочной кишки, у молодых больных при незапущенной кишечной непроходимости допустима правосторонняя гемиколэктомия с наложением илеотрансверзоанастомоза. В остальных случаях более целесообразны двухмоментные и трехмо-ментные операции.
Двухмоментная операция — резекция кишки, несущей опухоль, с наложением противоестественного заднего прохода, вторым этапом которой является наложение анастомоза между приводящей и отводящей петлями.
Трехмоментная операция — разгрузочная цекостома или противоестественный задний проход проксимальнее места обтурации; резекция участка ободочной кишки с опухолью с наложением межкишечного анастомоза; закрытие цекостомы или противоестественного заднего прохода.
Основной задачей послеоперационного введения является ликвидация тяжелых патофизиологических нарушений, восстановление нормального водно-солевого, белкового и углеводного обменов. Особое значение приобретают мероприятия, направленные на раннюю активизацию кишечной перистальтики, дезинтоксикацию, профилактику тромбоэмболических и воспалительных осложнений.
С целью восстановления моторной функции желудка и кишечника в послеоперационном периоде проводят постоянную (на протяжении 3—4 сут) аспирацию желудочного и кишечного содержимого через назогастральный зонд, назначают антихолинэстеразные препараты, сеансы электростимуляции кишечника.
Дезинтоксикация достигается восстановлением нормального диуреза, для чего необходимо тщательное возмещение водных потерь. Хороший дезинтоксикационный эффект достигают форсированным диурезом. Синтетические плазмозамещающие растворы (реополиглюкин, гемодез) являются хорошими адсорбентами токсинов, способствуют их выведению почками.
В послеоперационном периоде большое значение приобретает профилактика тромбоэмболических осложнений. Она осуществляется комплексом мероприятий: эластической компрессией вен нижних конечностей, активным режимом, назначением дезагрегантов, антикоагулянтов прямого и непрямого действия.
Для борьбы с инфекцией и ее профилактики назначают антибиотики широкого спектра действия: внутривенно, внутримышечно и местно в брюшную полость через введенные в нее во время операции микроирригаторы.
Прогноз. Летальность после операций по поводу острой кишечной непроходимости остается высокой и составляет в среднем 13—18%. Для снижения послеоперационной летальности большое значение имеет организация оказания скорой медицинской помощи. Ранние госпитализация и хирургическое вмешательство имеют основное значение для благоприятного исхода лечения. Летальность среди больных с острой непроходимостью кишечника, оперированных в первые 6 ч, составляет 3,5%, а среди оперированных после 24 ч — 24,7% и более.
ОБТУРАЦИОННАЯ НЕПРОХОДИМОСТЬ
Обтурация кишечника опухолью составляет 9—10% всех форм острой непроходимости кишечника. Обтурацию чаще вызывают злокачественные опухоли, локализующиеся в толстой кишке (чаще в сигмовидной кишке), реже опухоли тонкой кишки.
Клиническая картина и диагностика. Симптомы непроходимости кишечника развиваются постепенно, подостро. Обычно они сочетаются с симптомами злокачественной опухоли (истощение, кровотечение и интоксикация и др.). Нередко непроходимость является первым проявлением опухоли ободочной кишки.
Заболевание может протекать по типу как высокой, так и низкой непроходимости. Резкое вздутие ободочной кишки при опухоли, об-турирующей сигмовидную ободочную кишку, приводит к резким нарушениям микроциркуляции в стенке кишечника, изъязвлению и перфорациям.
Лечение. Применяют только хирургическое лечение. При тонкокишечной обтурации производят резекцию кишки с первичным межкишечным анастомозом; при раке слепой и восходящей ободочной кишки — гемиколэктомию. В случае неоперабельной опухоли накладывают обходной анастомоз. При локализации опухоли в левых отделах ободочной кишки производят двух- и трехэтапные операции. В случае неоперабельной опухоли этих отделов кишки накладывают или формируют противоестественный задний проход. Послеоперационная летальность при этом составляет 20—30%.
Артериомезентериальная непроходимость кишечника обусловлена сдавлением нижней горизонтальной ветви двенадцатиперстной кишки верхней брыжеечной артерией, отходящей у таких больных от аорты под острым углом. Иногда этот вариант непроходимости кишечника возникает остро после обильного приема пищи (желудочное содержимое, поступающее в кишечник, оттягивает его книзу, передавливая натягивающейся при этом верхней брыжеечной артерией двенадцатиперстную кишку).
Клиническая картина и диагностика. В клинической картине преобладают резкие боли в верхней половине живота и обильная рвота с примесью желчи. Состояние больного довольно быстро улучшается при принятии коленно-локтевого положения. Рентгенологически выявляют значительное расширение желудка и двенадцатиперстной кишки, при контрастном исследовании отмечают задержку эвакуации контрастного вещества из двенадцатиперстной кишки в вертикальном положении и улучшение эвакуации — в коленно-локтевом. Возможны варианты хронического течения заболевания.
Лечение. Вначале применяют консервативное лечение: частое дробное питание, после еды отдых в горизонтальном положении, лучше на правом боку. При неэффективности консервативных мероприятий показано хирургическое вмешательство — наложение дуоденоеюноа-настомоза.
Прогноз. Благоприятный.
Обтурация желчными конкрементами составляет 0,5—2,0% всех случаев кишечной непроходимости.
Этиология и патогенез. При хроническом калькулезном холецистите вследствие деструктивных изменений в желчном пузыре происходит спаяние его стенки с двенадцатиперстной кишкой, затем образуется пролежень и возникает пузырно-дуоденальный свищ, по которому конкремент, находящийся в желчном пузыре, отходит в просвет кишечника. Обтурацию вызывают конкременты диаметром
3—4 см и более. Обтурации конкрементом просвета кишки и развитию острой непроходимости кишечника способствует вторичный спазм кишки. Наиболее часто обтурация желчными конкрементами происходит на уровне терминального отрезка подвздошной кишки, что объясняют сравнительной узостью просвета этого отдела кишечника.
Клиническая картина и диагностика. Явления непроходимости возникают, как правило, остро и протекают со схваткообразными болями, многократной рвотой. При обзорной рентгеноскопии живота обнаруживают раздутые газом петли тонкой кишки с характерным «спиралевидным» рисунком складок слизистой оболочки. Нередко выявляют газ в проекции желчевыводяших протоков.
Лечение. Применяют только хирургическое лечение. Производят энтеротомию дистальнее конкремента, удаление его и декомпрессию кишечника. В дальнейшем выполняют по показаниям холецистэкто-мию.
Закупорка каловыми конкрементами развивается преимущественно в толстой кишке. Этот вид непроходимости наблюдается у пожилых людей, страдающих хроническим колитом, упорным запором. Предрасполагающими факторами часто бывают аномалии развития (мега-колон, мегасигма, врожденные мембраны слизистой оболочки и др.).
Клиническая картина и диагностика. Каловые конкременты могут самостоятельно отходить со стулом. В ряде случаев они приводят к развитию пролежней стенки кишки и каловому перитониту. Конкременты могут вызывать острую непроходимость толстой кишки, симптомы и клиническое течение которой имеют все характерные признаки низкой непроходимости кишечника: схваткообразные боли, задержка стула и газов, усиленная, длительно сохраняющаяся перистальтика, резкое вздутие ободочной кишки, принимающей форму раздутой автомобильной шины, пустая, баллонообразно раздутая ампула прямой кишки.
Лечение. При обтурации каловыми конкрементами операция показана в тех редких случаях, когда консервативные методы лечения (сифонные и масляные клизмы, попытка пальцевого или инструментального удаления конкрементов через прямую кишку даже под наркозом) не дают эффекта.
Хирургическое лечение заключается в колотомии, удалении конкрементов и наложении колостомы или противоествественного заднего прохода.
СТРАНГУЛЯЦИОННАЯ НЕПРОХОДИМОСТЬ
Частота странгуляционных видов непроходимости кишечника составляет 40—50% всех наблюдений острой непроходимости.
Завороты (volvulus) представляют собой закручивание кишки с ее брыжейкой вокруг продольной оси (рис. 109) и составляют 4—5% всех видов непроходимости кишечника.
Различают завороты тонкой, сигмовидной ободочной и слепой кишок.
Этиология и патогенез. Среди причин заворотов кишки выделяют предрасполагающие и производящие.
К предрасполагающим причинам относят: а) чрезмерно длинную брыжейку кишки, незавершенный поворот кишечника; б) рубцо-вые тяжи, сращения, спайки между петлями кишечника как врожденного, так и приобретенного характера; в) резкое похудание.
К производящим причинам относят: а) внезапное повышение внутрибрюшного давления, приводящее к резкому перемещению кишечных петель, б) алиментарные фак-
торы: нерегулярное питание, длительное голодание с последующей перегрузкой кишки большим количеством грубой пищи.
В нормальных условиях петли кишечника совершают значительные по объему движения и нередко делают повороты до 180°, не вызывая каких-либо патологических нарушений. При повороте кишки более чем на 180° происходит перекрытие ее просвета и сдавление сосудов брыжейки.
Заворот слепой кишки возможен в тех случаях, когда она имеет собственную брыжейку или общую с брыжейкой тонкой кишки. Наиболее часто бывает заворот сигмовидной ободочной кишки. Помимо значительной длины брыжейки, завороту способствует рубцовое сморщивание корня брыжейки сигмовидной ободочной кишки при мезо-сигмоидите. Следствием этого является сближение приводящего и отводящего участков кишки, которые располагаются почти параллельно (по типу «двустволки»). При усилении перистальтических сокращений или переполнения плотным и газообразным содержимым кишка легко закручивается вокруг своей оси, что приводит к ее непроходимости.
Клиническая картина и диагностика. Завороты тонкой кишки начинаются остро. Заболевание протекает с тяжелыми общими и местными клиническими симптомами, характерными для острой высокой странгуляционной непроходимости.
В первые часы заболевания на фоне постоянной боли периодически возникают схваткообразные боли, интенсивность которых нарастает синхронно с перистальтикой, достигая характера нестерпимых. Часто больные становятся беспокойными, кричат от боли, принимают вынужденное положение с приведенными к животу ногами.
С самого начала заболевания возникает многократная рвота, не приносящая облегчения. Вначале развивается рвота неизмененным желудочным содержимым и желчью, а затем она принимает каловый характер. Задержка стула и газов является непостоянным симптомом заболевания: часто вначале бывает однократный стул за счет опорожнения нижних отделов кишечника, не приносящий облегчения.
Общее состояние больного крайне тяжелое. Быстро появляются и нарастают нарушения водно-солевого, белкового и углеводного обменов, микроциркуляторные и гемодинамические расстройства, интоксикация, снижение диуреза. Живот умеренно вздут, иногда вздутие проявляется лишь сглаженностью подреберных областей.
Нередко обнаруживают положительный симптом Валя, баллонооб-разно растянутую и фиксированную в животе петлю тощей кишки, над которой определяют высокий тимпанит и шум плеска.
При обзорной рентгеноскопии живота обнаруживают чаши Клойбера, которые появляются через 1—2 ч от начала заболевания и локализуются в левой половине эпигастральной области и в мезогаст-ральной области.
Прогноз при заворотах тонкой кишки неблагоприятный, летальность достигает 30%.
При завороте слепой кишки симптомы выражены так же остро, как и при заворотах тонкой кишки. Боли (как постоянные, так и схваткообразные) локализуются в правой половине живота и в околопупочной области. Обычно наблюдается рвота, однако она редко бывает каловой. У большинства больных имеется задержка стула и газов.
При осмотре выявляют асимметрию живота за счет вздутия в околопупочной области. Одновременно происходит западение правой подвздошной области. При пальпации живота часто обнаруживают положительный симптом Шиманса — Данса (ощущение пустоты в правой подвздошной области) и ригидность мышц брюшной стенки.
При аускультации живота отмечают характерные звонкие, с металлическим оттенком перистальтические шумы. В дальнейшем, по мере развития перитонита, перистальтические шумы ослабевают.
На обзорной рентгенограмме живота выявляют шаровидно раздутую слепую кишку, которая локализуется в правой половине живота или смещена кнутри и кверху. В зоне проекции кишки виден большой (длиной до 20 см) горизонтальный уровень жидкости.
Заворот сигмовидной ободочной кишки возникает чаще у пожилых людей, длительно страдающих запорами. Боли возникают внезапно, носят интенсивный характер, локализуются обычно в нижних отделах живота и в области крестца. Сопровождаются одно- и двукратной рвотой. Каловой рвоты, как правило, не бывает — она возникает лишь при развитии перитонита.
Ведущим симптомом заворота сигмовидной ободочной кишки является задержка стула и газов. Живот резко вздут. Отмечается его асимметрия — выбухание верхних отделов правой половины вследствие перемещения сигмовидной ободочной кишки вверх и вправо. При этом живот приобретает характерный «перекошенный» вид.
Вследствие сильного вздутия ободочной кишки все внутренние органы и диафрагма оттесняются кверху. Это ведет к затруднению дыхания и нарушению сердечной деятельности.
При рентгеноскопии выявляют резко раздутую газами сигмовидную ободочную кишку, которая занимает почти всю брюшную полость и дает характерный симптом «светлого» живота, на фоне которого видны 1—2 чаши Клойбера с длинными уровнями жидкости.
Лечение. При заворотах кишечника необходима экстренная операция, так как консервативные методы лечения неэффективны.
Рис
110.
Узлообразование.

Узлообразование кишок (nodulus intestini) протекает с тяжелыми нарушениями кровообращения в сосудах брыжейки и ранним некрозом
больших отрезков тонкой и толстой кишок. Наблюдается у 3—4% всех больных острой непроходимостью кишечника.
Этиология и п а т о г е н е з. В узлообразовании принимают участие не менее двух кишечных петель. Одна из них, сложенная в виде двустволки вместе со своей брыжейкой, образует ось, вокруг которой вторая петля кишки также вместе с ее брыжейкой закручивается на один или несколько оборотов, сдавливает первую петлю и сама подвергается странгуляции (рис. НО). В результате образования узла просвет кишечника оказывается перекрытым не менее чем на двух уровнях.
В узлообразовании обычно принимают участие тонкая кишка и подвижные, имеющие собственную брыжейку отделы толстой кишки. Наиболее частыми видами межкишечных узлов являются узлы между тонкой кишкой и сигмовидной ободочной или тонкой кишкой и слепой, которая в этих случаях имеет собственную брыжейку. Узлообразование между петлями тонкой кишки (тощей и подвздошной) наблюдается редко.
Кровоснабжение в сосудах брыжеек ущемляемой и ущемляющей кишок в начальных стадиях заболевания нарушается в различной степени (обычно в большей степени страдает кровоснабжение в ущемляемой петле). Затем быстро нарушается кровоснабжение обеих петель, в которых развивается некроз.
Клиническая картина и диагностика. Предполагать узлообразование кишок надо в тех случаях, когда клинические и рентгенологические признаки странгуляции тонкой кишки сочетаются с признаками непроходимости толстой кишки («баллонообразная» ампула прямой кишки при ректальном исследовании, горизонтальные

уровни жидкости в левых отделах толстой кишки наряду с уровнями жидкости в тонкой кишке).
Лечение. Применяют только хирургическое лечение. В ранней стадии заболевания производят развязывание узла. При невозможности расправить узел, что часто наблюдается в поздние сроки, прибегают к резекции больших отделов толстой и тонкой кишок.
Прогноз. Часто неблагоприятный. Летальность составляет около 25%.
Инвагинация кишок (invaginacio intestini) сопровождается формированием инвагината, в котором выделяют головку и тело, состоящие из внутреннего (входящего) и внешнего (выходящего) цилиндров кишки. Наружную кишку называют влагалищем инвагината, а место перехода наружного цилиндра в средний — воротником инвагината (рис. 111). Внедрение одной кишки в другую происходит на различную глубину. Закрытие просвета кишки инвагинатом ведет к обтурационной непроходимости. Вместе с кишкой внедряется и ее брыжейка, что приводит к сдавлению сосудов и расстройству кровообращения во внедрившейся кишке (странгуляция).
Инвагинацию кишечника наблюдают преимущественно у детей (у 75% всего числа больных). У взрослых острая инвагинация кишечника бывает редко и составляет 2—3% больных с непроходимостью кишечника. Наиболее часто бывает инвагинация подвздошной кишки в слепую (илеоцекальная инвагинация) или подвздошной и слепой кишки в восходящую ободочную (у 80% больных). Инвагинация тонкой кишки в тонкую или толстой в толстую бывает гораздо реже.
Этиология. Основное значение в развитии инвагинации имеют наличие в стенке внедряемой кишки тех или иных патологических изменений (опухоль на ножке, гематома, воспалительный инфильтрат и др.), которые в результате перистальтических сокращений продвигаются по просвету кишки в дистальном направлении, увлекая за собой стенку кишки; стойкий спазм стенки кишки, в результате которого спазмированный отрезок кишки перистальтическими сокращениями внедряется в другой, находящийся в состоянии пареза.
Клиническая картина и диагностика. У детей чаще бывают острые формы заболевания; у взрослых преобладают подострые и хронические формы.
При острой форме заболевание начинается внезапно, иногда на фоне энтерита или после приема слабительного средства. Ведущим симптомом являются резкие, схваткообразные боли, которые нарастают по своей интенсивности до нестерпимых, синхронно с усилением перистальтических сокращений кишечника и затем постепенно стихают. Со временем интервалы между схватками укорачиваются, боли становятся постоянными.
Боли сопровождаются неоднократной рвотой. Вместе с тем отхож-дсние кишечного содержимого из нижележащих отделов сохраняется. В испражнениях обнаруживают примесь крови и слизи. У ряда больных наблюдают кровавый стул и тенезмы. Кровянистые выделения нередко имеют вид малинового желе.
При осмотре живота выявляют видимую перистальтику. Живот при пальпации мягкий. При глубокой пальпации обычно удается определить болезненное, малоподвижное, изогнутое колбасовидное образование, располагающееся при илеоцекальной инвагинации в правой подвздошной области, правом подреберье или поперечно над пупком (при глубокой инвагинации). В последнем случае при пальпации живота выявляют положительный симптом Шиманса — Данса. При ректальном исследовании находят расширенную ампулу прямой кишки, а при глубокой инвагинации у детей иногда и головку спустившегося в прямую кишку инвагината. Как правило, в просвете прямой кишки обнаруживают кровянистые выделения.
Диагноз основывается на характерной триаде симптомов (схваткообразные боли, пальпируемое колбасовидное образование в правой половине живота, кровянистые выделения из прямой кишки). Важное значение имеет проведение дифференциального диагноза между инвагинацией и аппендикулярным инфильтратом. Правильному распознаванию способствуют большая интенсивность болей при инвагинации, их схваткообразный характер. В сомнительных случаях помогает выявляемое при обзорной рентгеноскопии живота наличие горизонтальных уровней жидкости в тонкой кишке, а при ирригоскопии — наличие в слепой или восходящей кишке дефекта наполнения с четкими контурами, имеющими форму полулуния или двузубца.
Лечение. Необходима экстренная возможно ранняя операция. Консервативные мероприятия (сифонные клизмы, введение газа в ободочную кишку, атропинизация) редко эффективны даже в первые часы заболевания.
На ранних стадиях заболевания во время операции путем осторожного и нежного выдавливания удается произвести дезинвагинацию. После этого для уменьшения излишней подвижности кишки и предупреждения рецидива заболевания производят цекопексию (фиксируют отдельными узловатыми швами терминальный отрезок подвздошной кишки к задней париетальной брюшине). Если расправить инва-гинат не удается или дезинвагинированная кишка оказывается нежизнеспособной, производят резекцию кишечных петель с соблюдением всех правил резекции кишечника в условиях острой непроходимости кишечника.
ДИНАМИЧЕСКАЯ НЕПРОХОДИМОСТЬ
Паралитическая непроходимость кишечника обусловлена полным прекращением перистальтики, ослаблением тонуса мышечного слоя кишечной стенки. Отсутствие пропульсивной перистальтической волны обусловливает застой содержимого в кишках.
Клиническая картина и диа гностика . Основными симптомами являются боли, рвота, стойкая задержка стула и отхождения газов, вздутие живота. Боли носят тупой, распирающий характер, не имеют четкой локализации и иррадиации. Они, как правило, постоянные, схваткообразный компонент уходит на второй план. Рвота обычно многократная, в рвотных массах нередко содержится примесь крови.
Живот равномерно вздут. При его пальпации определяют резистентность брюшной стенки. Перистальтика отсутствует.
Если паралитическая непроходимость не сочетается с развитием перитонита, то в первые часы заболевания общее состояние больных остается удовлетворительным. Спустя 3—4 ч начинают быстро нарастать гиповолемия, глубокие расстройства обмена веществ, нарушения сердечной деятельности.
Отдельную тяжелую группу паралитической непроходимости составляют те ее виды, которые возникают на почве острых нарушений кровообращения в мезентериальных сосудах (тромбозы и эмболии верхнебрыжеечной артерии) (см. «Заболевания периферических артерий»).
При обзорной рентгеноскопии живота для паралитической непроходимости кишечника характерны равномерное вздутие всех его отделов, преобладание в раздутых кишках газообразного содержимого над жидким, наличие горизонтальных уровней жидкости как в тонкой, так и в толстой кишках одновременно.
Лечение. В первую очередь необходимо устранить патологический процесс, приведший к развитию паралитической непроходимости кишечника. Для восстановления моторной функции кишечника и устранения его пареза применяют аминазин, снижающий угнетающее действие на перистальтику симпатической нервной системы, антихо-линэстеразные препараты (прозерин, убретид), активирующие перистальтику путем усиления влияния парасимпатической нервной системы, а также очистительную клизму.
Необходима определенная последовательность в использовании этих препаратов. Вначале вводят аминазин или аналогичные ему лекарственные средства, через 45—50 мин — прозерин, затем назначают очистительную клизму. Эффективна также электростимуляция кишечника.
Больным проводят постоянную декомпрессию желудка и кишечника путем назогастральной катетеризации двенадцатиперстной и тонкой кишок.
Нарушения гомеостаза корригируют по общим принципам лечения острой непроходимости кишечника. Хирургическое лечение при паралитической непроходимости кишечника показано в случаях возникновения ее на фоне перитонита, тромбоза или эмболии брыжеечных сосудов, а также при смешанном варианте непроходимости кишечника (сочетание механического и паралитического компонентов).
Спастическая непроходимость кишечника — сравнительно редкий вид динамической непроходимости кишечника. Прекращение продвижения кишечного содержимого обусловлено возникновением стойкого спазма мышечного слоя стенки кишки. Длительность спазма может быть различная: от нескольких минут до нескольких часов.
Клиническая картина и диагностика. Спастическая непроходимость кишечника может возникнуть в любом возрасте. Заболевание характеризуется внезапным началом. Ведущим симптомом являются сильные схваткообразные боли без определенной локализации. В период схваток больной мечется по кровати, кричит.
Диспепсические расстройства нехарактерны. Задержка стула и газов наблюдается не у всех больных, они редко бывают стойкими. Общее состояние больного нарушается незначительно. Живот имеет чаще обычную конфигурацию, если же брюшная стенка втянута, то он принимает ладьевидную форму.
При обзорной рентгеноскопии живота выявляют спастически-атоническое состояние кишечника. Иногда по ходу тонкой кишки видны мелкие чаши Клойбера, расположенные цепочкой по ходу брыжейки тонкой кишки. При контрастном исследовании пищеварительного тракта с барием определяют замедленный пассаж бариевой взвеси по тонкой кишке, четкообразные участки вздутия кишечника.
Лечение. Обычно применяют только консервативное лечение. Больным назначают спазмолитические средства, физиотерапевтические процедуры, тепло на живот; проводят лечение основного заболевания.
ПЕЧЕНЬ
Печень — придаточная железа пищеварительного тракта и самая крупная железа человека. Она является главной «лабораторией» расщепления и синтеза большого количества органических веществ, поступающих в гепатоциты из печеночной артерии и воротной вены.
Масса печени у взрослого человека составляет 1200—1500 г. Она покрыта брюшиной со всех сторон, за исключением небольшой площадки на задней поверхности, примыкающей к диафрагме. Выделяют правую и левую доли печени. Междолевая граница проходит через ложе желчного пузыря, ворота печени и оканчивается у места впадения правой печеночной вены в нижнюю полую вену. На основании общих принципов ветвления внутрипеченочных желчных протоков, печеночных артерий и портальных вен в печени выделяют 8 сегментов (рис. 112). Вся поверхность печени покрыта тонкой фиброзной оболочкой (глиссоновой капсулой), которая утолщается в области ворот печени и носит название «воротной пластинки».
Рис
112.
Сегментарное
строение
печени.
Цифрами
обозначены
номера
сегментов,
а
— вид спереди; б
—
вид
сзади.

Воротная вена образуется путем слияния верхней брыжеечной и селезеночной вен (после впадения в последнюю нижней брыжеечной вены). По ней происходит отток крови от всех отделов пищеварительного тракта, поджелудочной железы и селезенки. В области ворот печени воротная вена делится на правую и левую ветви.
Естественные портокавальные анастомозы располагаются в области кардиального отдела желудка и нижней трети пищевода, в нижнеампулярном отделе прямой кишки и в околопупочной области (в бассейне пупочной вены). Через них кровь поступает из портальной системы в кавалыгую при портальной гипертензии.
Внутрипеченочные желчные протоки начинаются с желчных канальцев, расположенных между гепатоцитами; постепенно увеличиваясь в диаметре и сливаясь между собой, они образуют междольковые, сегментарные и долевые протоки. Правый и левый печеночные протоки, сливаясь вместе в области ворот печени, образуют общий печеночный проток, который после впадения в него пузырного протока носит название общего желчного протока. Последний впадает в двенадцатиперстную кишку в области ее вертикальной ветви.
Венозный отток из печени осуществляется по печеночным венам. Они начинаются с центральных дольковых вен, при слиянии которых формируются сублобуляриые и сегментарные вены. Последние, сливаясь, образуют 2—3 крупных ствола, впадающих в нижнюю полую вену тотчас ниже диафрагмы.
Лимфоотток происходит по лимфатическим сосудам, расположенным по ходу внутрипеченочных желчных путей и печеночных вен. Из них лимфа поступает в лимфатические узлы печеночно-двенадцатиперстной связки, парааортальные узлы и оттуда — в грудной проток. От верхних отделов печенн лимфатические сосуды, прободая диафрагму, впадают также в грудной проток.
Иннервация печени осуществляется симпатическими нервами из правого чревного нерва и парасимпатическими из печеночной ветви левого блуждающего нерва.
Функции печени. Печень играет важную роль в обмене углеводов (накопление и метаболизм), жиров (утилизация экзогенных жиров, синтез фосфолипидов, холестерина, жирных кислот и т. п.), белков (альбуминов, белковых факторов свертывающей системы крови — фибриногена, протромбина и т. п,), пигментов (регуляция обмена билирубина), жирорастворимых витаминов (A, D, Е, К), витаминов группы В, многих гормонов и биологически активных веществ, а также в желчеобразовании. Ретикулоэндотелиоциты печени (клетки Купфера) выполняют защитную функцию — фиксируют иммунные комплексы, осуществляют фагоцитоз бактерий, разрушают старые эритроциты и т. п. Кроме того, они вырабатывают гамма-глобулин, участвующий в иммунной защите организма.
При многих болезнях печени и желчевыводящих путей одной из первых страдает ее пигментная функция, что клинически проявляется желтухой. Поэтому практическому врачу очень важно знать физиологический цикл обмена билирубина в организме.
В нормальных условиях «старые» эритроциты подвергаются разрушению в селезенке и в незначительном количестве в некоторых других органах ретикулоэндотелиальной системы (костный мозг, печень, лимфатические узлы). Из гемоглобина эритроцитов при их распаде образуется белок глобин, гемосидерин и гематоидин. Глобин распадается на аминокислоты, которые в дальнейшем участвуют в общем белковом обмене. Гемосидерин окисляется до ферритина, который далее участвует в обмене железа, вновь утилизируясь организмом. Гематоидин через стадию биливердина превращается в непрямой (свободный) билирубин (нерастворимый в воде), который в свою очередь вступает в непрочную связь с белками крови. С током крови по системе воротной вены непрямой билирубин поступает в печень, где под влиянием печеночных ферментов связывается с глюкуроновой кислотой, образуя водорастворимый прямой билирубин (билирубин-глюкуроннд), который в последующем выделяется желчью в кишечник. Здесь из прямого (связанного) билирубина образуется стеркобилин, придающий калу коричневую окраску, а также уробилииоген и уробилин, частично выделяющиеся с калом, частично всасывающиеся через кишечную стенку в кровь через систему воротной вены. Большая часть уробилиногена и уробилина попадает в печень, где вновь превращается в билирубин, и лишь в небольшом количестве выделяется с мочой. Непрямой билирубин не фильтруется почками и не выделяется с мочой, в то время как прямой водорастворимый билирубин обладает этой способностью.
Ткань нормальной печени хорошо регенерирует. В экспериментальных и клинических наблюдениях было показано, что печень способна восстановить свою исходную массу после обширных (60—75%) резекций этого органа. Механизм высокой проли-феративной способности гепатоцитов полностью не исследован, хотя существует предположение о важной роли в нем некоторых гормонов (инсулин, глюкагон, эпидермальный фактор роста).
Специальные методы исследования
Среди лабораторных методов исследования при различных хирургических заболеваниях печени важная роль отводится биохимическому анализу крови, определению уровня транса мин аз, щелочной фосфа-тазы, факторов свертывающей системы крови, которые отражают функциональное состояние печени. Вместе с тем следует подчеркнуть, что грубые изменения указанных параметров наблюдаются лишь при очень выраженных морфологических изменениях органа, так как компенсаторные возможности печени весьма велики.
Ультразвуковое исследование позволяет выявить объемные образования в печени (солидные или кистозные), определить их форму и размеры, диаметр внутрипеченочных желчных путей, расширение которых является кардинальным симптомом механической желтухи.
Компьютерная томография является наиболее информативным методом диагностики очаговых заболеваний печени. Ее разрешающая способность, чувствительность и специфичность значительно выше, чем ультразвукового исследования.
Чрескожная пункция очаговых поражений печени под контролем ультразвукового исследования или компьютерной томографии с последующим цитологическим и бактериологическим исследованием пунк-тата позволяет получить морфологическую верификацию диагноза.
Ангиография (целиакография, спленопортография, чреспеченочная портография, каваграфия) используется при злокачественных новообразованиях печени для определения распространенности опухоли и ее взаимоотношений с сосудисто-секреторными элементами органа, что принципиально важно при выполнении радикальной операции. Эти же методы исследования являются обязательными при обследовании больных с портальной гипертензией для определения уровня блока для оттока крови из воротной вены.
Лапароскопия позволяет получать дополнительную информацию об очаговых поражениях печени в случаях расположения их на поверхности органа, ориентировочно оценить форму цирроза печени при портальной гипертензии, определить признаки неоперабельности при злокачественных новообразованиях. Кроме того, под контролем данного метода можно выполнить прицельную биопсию.
ПОРОКИ РАЗВИТИЯ
Пороки развития печени встречаются редко.
Аномалии положения органа наблюдаются при обратном расположении внутренних органов, дефектах развития связочного аппарата (гепатоптоз).
Аномалии формы печени проявляются в виде изменения размеров различных ее отделов, глубины борозд, добавочных долей. Все эти аномалии не имеют характерной клинической симптоматики. Редко выявляют гипоплазию или агенезию печени. Ряд доброкачественных новообразований и кист печени также являются пороками развития.
ТРАВМЫ ПЕЧЕНИ
Выделяют открытые и закрытые повреждения.
Открытые повреждения (колотые, резаные, огнестрельные) часто сочетаются с повреждениями других органов грудной или брюшной полостей.
Клиническая картина и диагностика. В клинической картине на первое место выступают симптомы шока (особенно при сочетанных повреждениях), внутреннего кровотечения, а также пери-тонеальные симптомы, свидетельствующие о катастрофе в брюшной полости. Направление хода раневого канала в сочетании с клиническими симптомами в большинстве случаев позволяют до операции поставить диагноз повреждения печени.
Лечение. При колотых и резаных ранах применяют ушивание раны, с помощью одного из специальных швов (П-образные швы, шов Кузнецова — Пенского, швы на синтетических прокладках и т. п.). При невозможности ушить глубокую рваную рану производят ее тампонаду прядью сальника на ножке с подшиванием его к глиссоновой капсуле вокруг дефекта. При обширных ранах, сопровождающихся повреждением крупных сосудов, желчных протоков или размозжением большой массы печеночной ткани, применяют резекцию доли или сегмента печени. Чаще используют атипичные резекции, при которых стремятся удалить все нежизнеспособные ткани, по возможности учитывая сегментарное строение печени, чтобы избежать повреждения важнейших сосудисто-секреторных элементов органа.
Закрытые повреждения — разрывы, размозжения ткани печени и ее отрывы (полные и неполные) — возникают при прямом ударе в область печени или при сильном ударе в другую область живота, при падении с высоты. При этом часто наблюдают повреждение и других органов брюшной и грудной полостей, забрюшинного пространства.
Клиническая картина и диагностика. В клинической картине, так же как и при открытых повреждениях печени, преобладают симптомы шока, кровотечения, перитонита. Наряду с тахикардией у больных наблюдается снижение гемоглобина и гема-токрита, нарастает лейкоцитоз. В сомнительных случаях для обнаружения крови в брюшной полости прибегают к лапароцентезу, ультразвуковому исследованию, компьютерной томографии и даже к диагностической лапаротомии.
Лечение. Применяют такие же операции, как и при открытых повреждениях.
АБСЦЕССЫ ПЕЧЕНИ
Абсцесс печени — ограниченное скопление гноя вследствие внедрения в печеночную паренхиму микроорганизмов или паразитов. Выделяют бактериальные (микробные) и паразитарные абсцессы, а также абсцессы, сформировавшиеся в результате нагноения эхинококковой кисты.
Бактериальные абсцессы. Этиология и патогенез. Проникновение микрофлоры в ткань печени осуществляется следующими путями: по билиарному пути (по ходу желчных протоков) — при механической желтухе и холангите (30—40%); по венозному (по воротной вене) — при деструктивном аппендиците, холецистите, неспецифическом язвенном колите и т. п. (20%); по артериальному (по печеночной артерии) — при различных заболеваниях, сопровождающихся сепсисом и бактериемией; по контактному — при прорыве в ткань печени эмпиемы желчного пузыря, при пенетрирующей язве желудка, поддиафрагмальном абсцессе; по травматическому — при закрытых и открытых повреждениях печени. Кроме того, выделяют так называемые криптогенные абсцессы печени (20%), при которых причину их возникновения определить не удается. Около 30% абсцессов возникает после операций на органах брюшной полости.
Абсцессы могут быть одиночными и множественными. Они локализуются чаще в правой доле печени. Возбудителями могут быть все виды бактерий. Наиболее часто обнаруживают кишечную палочку, энтеробактер, клебснеллу, стрептококки. Почти в 50% высевается неклостридиальная флора (бактероиды, пептострептококки).
Клиническая картина и диагностика. На ранних стадиях болезни клинические проявления весьма скудны. Основными симптомами являются интермиттирующая лихорадка с амплитудой колебаний температуры до 3 °С и проливными потами; постоянные тупые боли в правом подреберье, иногда усиливающиеся при движении, дыхании; снижение аппетита; общая слабость; при длительном течении — похудание. Кроме того, выявляют симптомы основного заболевания, явившегося причиной развития абсцесса. При крупных и множественных гнойниках часто отмечают гепатомегалию. Для хо-лангиогенных множественных абсцессов характерна желтуха.
Диагностика абсцессов печени, особенно единичных, некрупных, представляет существенные трудности. Постановке правильного диагноза помогают анамнез (наличие у больного в прошлом какого-либо септического заболевания: остеомиелита, фурункулеза, эндокардита или воспалительных заболеваний органов брюшной полости), а также данные объективного обследования с учетом общих и местных проявлений болезни.
При физикальном исследовании можно определить зону максимальной перкуторной или пальпаторной болезненности, соответствующей проекции абсцесса. В клиническом анализе крови выявляют лейкоцитоз со сдвигом формулы влево, анемию. При обзорном рентгенологическом исследовании определяют высокое стояние и ограничение подвижности правого купола диафрагмы, выпот (сочувственный) в правой плевральной полости при локализации гнойников на диаф-рагмальной поверхности. Иногда выявляют в проекции ткани печени уровень жидкости с газом над ним, что является прямым признаком абсцесса. Наиболее информативные способы исследования — ультразвуковое исследование и компьютерная томография. Эти способы позволяют наиболее точно определить локализацию и размеры абсцесса и других патологических образований в печени. Под контролем ультразвукового исследования или компьютерной томографии производят пункцию абсцесса для уточнения диагноза и определения чувствительности микрофлоры к антибиотикам. Прочие инструментальные способы исследования (радиоизотопное исследование, целиакография) менее информативны и поэтому применяются редко.
Осложнения наблюдаются в 30% случаев. Наиболее частыми из них является перфорация в свободную брюшную полость, в плевральную полость, реже в просвет желудка или ободочной кишки. Первые два осложнения (перитонит, эмпиема плевры) существенно утяжеляют состояние больных и омрачают прогноз болезни. Иногда перфорация абсцесса сопровождается кровотечением из аррозирован-ных сосудов печени.
Лечение. В настоящее время наиболее часто используют чрес-кожное наружное дренирование абсцессов печени под контролем ультразвукового исследования или компьютерной томографии. В последующем производят промывание полости гнойника растворами антисептических средств и антибиотиков. При невозможности тфименения или безуспешности данного способа лечения вынужденно прибегают к хирургическому вмешательству — вскрытию и дренированию полости абсцесса. При холангиогенных (множественных) абсцессах производят вскрытие наиболее крупных гнойников и наружное дренирование общего желчного протока с целью санации и ликвидации холангита. Обязательным компонентом указанных методов лечения является массивная антибиотикотерапия, а также лечение основных заболеваний, явившихся причиной развития абсцесса. Для лечения абсцессов, вызванных неклостридиальной анаэробой микрофлорой, применяют препараты метронидазола. В прогностическом отношении наиболее неблагоприятны холангиогенные множественные абсцессы, летальность при которых достигает 50—90%.
Паразитарные абсцессы печени встречаются в 4—5 раз реже, чем бактериальные.
Этиология и патогенез. Обычно развитие паразитарных абсцессов бывает обусловлено различными видами амеб (Entamoeba hystolytica, Entamoeba disenteriae). Паразитарные абсцессы печени встречаются в республиках Закавказья, Средней Азии, Казахстане. Наиболее часто они локализуются в верхних и задних отделах правой доли печени. У 10—15% больных из содержимого паразитарных абсцессов высевают также микробную флору. Заражение происходит алиментарным путем. Из просвета кишечника амебы с током крови попадают в воротную вену и далее в паренхиму печени, вызывая расплавление и абсцедирование большего или меньшего объема ее ткани (от нескольких миллилитров до 1—3 л). Содержимое амебного абсцесса в отличие от бактериального имеет характерную шоколадную или темно-красную окраску типа томатной пасты.
Клиническая картина и диагностика. Начало заболевания характеризуется высокой гипертермией, сопровождающейся потрясающими ознобами, тупыми разлитыми болями в правом подреберье. В последующем присоединяются анорексия, общая слабость, гепатомегалия, болезненность при пальпации печени. Состояние больных, особенно при крупных абсцессах, тяжелое, хотя и несколько лучше, чем при микробных гнойниках печени. Почти у половины больных клиническую картину амебного абсцесса маскируют типичные проявления паразитарной дизентерии.
В диагностике ведущее значение имеют серологические пробы, указывающие на амебиаз (реакции гемагглютинации и преципитации, латекс-тест). Локализацию и размеры абсцесса позволяют уточнить ультразвуковое исследование и компьютерная томография. При невозможности выполнения указанных методик применяют радиоизотопное исследование и целиакографию.
Осложнения. Паразитарные абсцессы осложняются несколько чаще, чем бактериальные. У ряда больных абсцесс прорывается в брюшную или плевральную полость, реже — в прилежащий полый орган брюшной полости, бронх, перикард. Развитие осложнений существенно увеличивает летальность.
Лечение. Основным способом лечения амебных абсцессов является химиотерапевтический. Наиболее эффективны производные метронидазола (трихопол). Применяют также эметина гидрохлорид, хингамин. При сочетании паразитов с микробной флорой необходимо введение антибиотиков широкого спектра действия. В случае безуспешности интенсивного консервативного лечения, ухудшения общего состояния пациентов, при больших размерах абсцесса прибегают к чрескожному дренированию его полости под контролем ультразвукового исследования или компьютерной томографии.
При лечении неосложненных абсцессов летальность обычно не превышает 5%, при наличии осложнений — свыше 40%.
ЭХИНОКОККОЗ ПЕЧЕНИ
Выделяют две формы эхинококкоза: кистозную (гидатидную) и альвеолярную. В настоящее время принято считать, что эхинококкоз и альвеококкоз являются самостоятельными заболеваниями, так как вызываются различными паразитами.
Эхинококкоз (гидатидный, однокамерный эхинококкоз) — гельминтоз, характеризующийся развитием эхинококковых кист в различных органах.
Этиология и патогенез. Заболевание вызывается личинкой — кистозной стадией развития ленточного глиста Echinococcus granulosus. Основным хозяином глиста является собака, промежуточным — человек, овцы, крупный рогатый скот. Наиболее часто эхинококкоз наблюдается в Австралии, Южной Европе и Северной Африке, Южной Америке, Исландии. Эндемичными районами по данному заболеванию также являются Крым, Южное Поволжье, республики Закавказья и Средней Азии. Попадая в организм человека с водой, овощами, яйца глистов внедряются в стенку тонкой кишки и далее по кровеносным и лимфатическим путям достигают печени или легких (наиболее частые места поражения).
В начале развития паразита в организме человека он представляет собой заполненный бесцветной жидкостью пузырек диаметром около 1 мм, который увеличивается на 2—3 см в год. Стенка гидатиды состоит из внутренней (герминативной) и наружной (хитиновой или кутикулярной) оболочек. Снаружи к ней предлежит плотная фиброзная оболочка, состоящая из соединительной ткани, образующаяся в результате реакции ткани печени на присутствие паразита. Эта оболочка очень плотная, практически неотделима от здоровой паренхимы печени и от хитиновой оболочки. Единственно функционально активной является внутренняя герминативная оболочка гидатиды, которая образует новые зародышевые сколексы. По мере их созревания в жидкости эхинококковой кисты образуются так называемые дочерние (а позже внутри них и внучатые) пузыри. Герминативная оболочка секретирует в просвет кисты гидатидную прозрачную жидкость и участвует в образовании наружной хитиновой оболочки паразита.
Клиническая картина и диагностика. Длительное время, иногда в течение многих лет, какие-либо клинические признаки заболевания отсутствуют. Лишь при достижении паразитарной кистой довольно больших размеров появляются клинические симптомы болезни: тупые, ноющие, постоянные боли в правом подреберье, эпигастральной области, нижних отделах правой половины грудной клетки. При осмотре можно обнаружить выбухание передней брюшной стенки в области правого подреберья. Перкуторно выявляют расширение верхней и нижней границ печени (гепатомегалия). При пальпации печени определяют округлое опухолевидное образование эластической консистенции (при локализации больших эхинококковых кист в передне-нижних отделах печени).
Ухудшение состояния связано с аллергической реакцией организма на присутствие живого паразита, что проявляется в виде крапивницы, диареи и т. п. При сдавлении крупными кистами двенадцатиперстной или толстой кишки возникают симптомы высокой или низкой непроходимости кишечника. При сдавлении воротной вены или ее магистральных ветвей у ряда больных развивается синдром портальной гипертензии.
Диагностике эхинококкоза помогают сведения о проживании больного в местности, являющейся эндемичной по данному заболеванию; обнаружение в клиническом анализе крови эозинофилии (до 20% и выше); положительная внутрикожная реакция Касони в ответ на введение стерильной жидкости эхинококкового пузыря. Механизм этой пробы аналогичен реакции на туберкулин при туберкулезе. Проба Касони бывает положительной у 75—85% больных. Для уточнения диагноза проводят серологические исследования: реакцию агглютинации с латексом, реакцию непрямой гемагглютинации, реакцию связывания комплемента, непрямой иммунофлуоресцентный тест.

Рис 113. Эхинококкоз печени и селезенки. в правой доле печени (1) и селезенке (2) — полостные образования округлой формы больших размеров. Компьютерная томограмма.
При обзорной рентгенографии отмечают высокое стояние купола диафрагмы или его выпячивание, иногда петрификацию оболочек кисты. О локализации и размерах эхинококковой кисты можно судить по данным радиоизотопного исследования (в месте проекции кисты виден дефект накопления изотопа). Наиболее достоверные данные могут быть получены при ультразвуковой эхолокации и компьютерной томографии (рис. 113). Из числа инвазивных способов исследования применяют лапароскопию, реже — ангиографию. При целиакографии обнаруживают дугообразное оттеснение сосудов печени, характерное для объемного образования.
Осложнения. Наиболее частыми осложнениями эхинококкоза являются желтуха, разрыв, нагноение кисты.
Желтуха (обтурационная) связана со сдавлением кистой магистральных желчевыводящих путей или с прорывом мелких кист в просвет желчных протоков и последующей их обтурацией при частичном разрыве хитиновой оболочки и фиброзной капсулы.
Разрыв гидатидной кисты может происходить с излиянием ее содержимого в свободную брюшную полость, в просвет пищеварительного тракта, в желчные протоки, в плевральную полость или бронх.
Наиболее серьезным осложнением является перфорация кисты в свободную брюшную полость. При этом возникают симптомы шока и распространенного перитонита, весьма часты различные проявления аллергии. Перфорация кисты в брюшную полость приводит к диссе-минации паразита с развитием в ней множественных кист.
Нагноение эхинококковой кисты связано с образованием трещины в капсуле гидатиды, особенно при наличии сообщения с желчными путями. Находящиеся в желчи бактерии служат источником инфицирования. При нагноении эхинококковой кисты возникают сильные боли в области печени, гипертермия и другие симптомы тяжелой гнойной интоксикации.
Лечение. Очень редко происходит самоизлечение, связанное с гибелью паразита и последующим обызвествлением его стенок. В настоящее время еще не найдены лекарственные препараты, оказывающие терапевтическое воздействие на кистозную форму эхинококкоза. Высокая частота развития серьезных осложнений диктует необходимость хирургического лечения независимо от размеров кисты.
Оптимальным способом лечения является эхинококкэктомия. Идеальную эхинококкэктомию, при которой удаляют всю кисту с ее хитиновой и фиброзной оболочками без вскрытия просвета, применяют редко — при небольших размерах кисты, ее краевом расположении. При крупных кистах, расположенных в толще ткани печени, такой способ чреват повреждением крупных сосудов и желчных протоков. Чаще удаляют кисту с ее герминативной и хитиновой оболочками после предварительной пункции полости кисты и отсасывания ее содержимого. Этот прием позволяет избежать разрыва кисты при ее выделении и диссеминации зародышей паразита. После удаления кисты фиброзную оболочку изнутри обрабатывают 20% раствором хлорида натрия и ушивают отдельными швами изнутри (капитонаж). При невозможности ушить полость прибегают к тампонаде ее сальником. В стенках плотной и толстой фиброзной капсулы иногда остаются дочерние мелкие пузыри. Поэтому при благоприятных анатомических условиях рекомендуют производить перицистэктомию, т. е. иссечение фиброзной капсулы, что делает операцию более радикальной, а оставшуюся в печени полость — более легко поддающейся закрытию путем капитонажа. При нагноении содержимого кисты после завершения основного этапа операции оставшуюся полость дренируют. При больших размерах кисты, а также в случае обызвествления ее стенок в качестве вынужденной меры прибегают к марсупиализации (вшиванию стенки кисты в переднюю брюшную стенку).
Альвеококкоз (альвеолярный, многокамерный эхинококкоз) — гельминтоз из группы тениидозов.
Этиология и патогенез. Альвеококкоз вызывается ленточным глистом (Alveococcus multilocularis). В нашей стране это заболевание встречается в Сибири и на Дальнем Востоке. Ленточный глист паразитирует чаще всего в организме лисиц и песцов, значительно реже — собак. Пути заражения человека и миграции паразита в организме аналогичны таковым при гидатидном эхинококкозе.
Макроскопически альвеококк представляет собой плотный опухо-леобразный узел, состоящий из фиброзной соединительной ткани и множества тесно прилегающих друг к другу мелких (до 5 мм в диаметре) пузырьков, содержащих бесцветную жидкость. Между паразитом и тканью печени фиброзная капсула, как при гидатидной форме эхинококка, не образуется. Поэтому вновь возникающие пузырьки паразита инфильтрируют и разрушают ткань печени, в результате чего в центре образуется полость распада. Паразит способен прорастать в соседние органы (легкие, селезенка и др.).
Клиническая картина и диагностика. Симптоматика альвеококкоза очень похожа на симптоматику злокачественной опухоли печени. Больных беспокоят тупые ноющие боли в правом подреберье, эпигастральной области, слабость; гепатомегалия, желтуха. При достижении паразитом больших размеров в центре образования вследствие распада формируется полость. В дальнейшем может произойти прорыв содержимого в брюшную или плевральную полость, а также полые органы. Наиболее частым осложнением альвеококкоза является обтурационная желтуха, обусловленная (давлением магистральных желчевыводящих путей.
Диагностика альвеококкоза представляет значительные трудности. При расспросе больного обращают внимание на его проживание в местности, где встречается альвеококкоз. Применяют те же лабораторные и инструментальные методы исследования, что и при диагностике опухолей и гидатидных форм эхинококкоза. Дифференцируют альвеококкоз от первичного рака печени или метастазов опухоли в печень.
Лечение. Радикальным методом лечения является резекция печени (атипичная или анатомическая с учетом долевого или сегментарного строения органа). При невозможности проведения радикальной операции применяют операции: удаление основной массы узла с оставлением его фрагментов в области ворот печени, наружное или внутреннее дренирование желчных путей при обтурационной желтухе, дренирование полости распада, введение в толщу ткани узла проти-вопаразитарных препаратов, криодеструкция остатков неудаленного паразита жидким азотом. Паллиативные операции продлевают жизнь больного, улучшают его состояние.
В последние годы рекомендуют химиотерапию мебендазолом, с помощью которого удается добиться существенного продления жизни больных, даже при невозможности удаления пораженного участка печени хирургическим путем.
Прогноз. При альвеолярной форме эхинококкоза прогноз заболевания гораздо менее благоприятный, чем при гидатидной. Высок процент рецидивов, летальность составляет 10%.
НЕПАРАЗИТАРНЫЕ КИСТЫ ПЕЧЕНИ
Встречаются относительно редко, чаще болеют женщины. Выделяют врожденные (истинные) и приобретенные (ложные) кисты печени. Они могут быть солитарными и множественными. Врожденные кисты изнутри выстланы кубическим или цилиндрическим эпителием; приобретенные — слоем волокнистой соединительной ткани.
К истинным кистам относят поликистоз печени, дермоиды, ре-тенционные кисты и цистаденомы. Поликистоз печени является врожденным, генетически детерминированным заболеванием. Более чем у половины больных поликистоз печени сочетается с кистозными изменениями в почках, поджелудочной железе, легких.
Ложные кисты образуются после ранее перенесенной травмы печени и являются следствием организации подкапсульных или интра-муральных гематом.
Клиническая картина и диагностика. Наличие в печени непаразитарных кист не вызывает клинических проявлений. По достижении больших размеров кисты могут вызывать умеренные боли в правом подреберье и определяться при пальпации. Клинические симптомы поражения печени проявляются в основном при развитии осложнений. К наиболее частым осложнениям относят разрыв кисты, нагноение, кровоизлияние в ее просвет, малигнизацию, перекрут кисты, располагающейся на ножке. Редко возникает обтурационная желтуха вследствие (давления кистой магистральных желчных протоков. В поздних стадиях развития поликистоза печени при замещении большей части паренхимы органа кистами нарастают симптомы печеночной недостаточности, а при наличии сопутствующего поликистоза почек — и почечной недостаточности. В этом случае прогноз заболевания неблагоприятный.
Диагноз ставят на основании комплекса инструментальных исследований. Применяют те же способы, что и при других очаговых поражениях печени.
Лечение. Основные способы лечения небольших солитарных кист — пункция или их дренирование под контролем ультразвукового исследования или компьютерной томографии с последующим введением в просвет склерозирующего раствора (95% этилового спирта) для облитерации полости кисты. При больших и гигантских кистах, вызывающих компрессию внутренних органов, выполняют резекцию печени вместе с кистой или энуклеацию кисты, формирование внутреннего анастомоза (цистоеюностомия). При поликистозе печени и реальной угрозе развития печеночной недостаточности применяют операцию фенестрации кист — иссечение части стенки кист с последующей деструкцией их внутренних оболочек электроножом или расфокусированным лучом лазера. Операцию проводят для уменьшения (давления печеночной паренхимы кистами и предупреждения ее дальнейшей атрофии.
ХРОНИЧЕСКИЕ СПЕЦИФИЧЕСКИЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ ПЕЧЕНИ
Туберкулез печени. Почти у половины больных, умерших от туберкулеза, во время вскрытия обнаруживают милиарные очаги в печени. Узловая форма поражения печени не имеет характерной симптоматики и чаще является случайной находкой во время операции или аутопсии.
Лечение. При общем хорошем состоянии больного целесообразно удаление узла в пределах здоровых тканей после гистологической верификации диагноза.
Если удалить туберкулому технически сложно и состояние больного не позволяет выполнить операцию, то назначают специфическое противотуберкулезное лечение.
Сифилис печени. В настоящее время данную патологию наблюдают редко. Гуммозное поражение печени может быть одиночным и множественным. При больших размерах гуммы могут возникать ее некроз и нагноение. Правильный диагноз позволяют поставить тщательный расспрос пациента и результаты реакции Вассермана.
Лечение. Показано специфическое противосифилитическое лечение. Хирургического вмешательства не требуется.
Актиномикоз печени. Поражение печени возникает вторично вследствие заноса возбудителя по системе воротной вены при локализации первичного очага в органах брюшной полости (аппендикс, толстая кишка) или по артериальной системе из отдаленного очага (чаще при локализации в челюстно-лицевой области). Реже наблюдают контактный путь заражения (с пораженного правого легкого, при пенетрации язвы желудка в печень). Характерно образование наружных или внутренних свищей, довольно резистентных к проводимому лечению. Постепенно все большая часть печени поражается множественными специфическими абсцессами. Правильный диагноз позволяют поставить результаты гистологического исследования, серологической пробы с актинолизатом.
Лечение. Применяют консервативное (иммунотерапию, анти-биотикотерапию), в том числе симптоматическое лечение.
ОПУХОЛИ ПЕЧЕНИ
Доброкачественные опухоли
К данной группе заболеваний относят опухоли эпителиального (гепатомы и холангиогепатомы), мезенхиального (гемангиомы, лимфангиомы, фибромы и т. п.) происхождения и смешанные опухоли (гамартомы). Из них наиболее часто встречаются гемангиомы.
Гемангиомы могут быть одиночными и множественными (10%), сочетаться с гемангиомами других органов, чаще имеют кавернозную структуру. По происхождению их относят к врожденным заболеваниям. Описаны семейные случаи болезни. Женщины страдают в 5—7 раз чаще мужчин. При микроскопическом исследовании обнаруживают богатую сеть сосудистых лакун с тонкими соединительнотканными перегородками. В редких случаях гемангиомы могут достигать значительных размеров, занимая правую или левую долю печени.
Клиническая картина и диагностика. Заболевание обычно проявляется на четвертом-пятом десятилетии жизни при достижении опухолью значительных размеров. Для всех доброкачественных опухолей типичны тупые ноющие боли в правом подреберье, реже — симптомы (давления внутренних органов (желудка, двенадцатиперстной кишки). У ряда больных появляется обтурационная желтуха и признаки портальной гипертензии за счет (давления увеличивающейся в объеме опухолью магистральных желчных протоков и внутрипеченочных ветвей воротной вены. Небольшие опухоли протекают бессимптомно.
При объективном исследовании больных с крупными гемангиомами и другими опухолями выявляют гепатомегалию; значительно реже можно пропальпировать и опухоль, спадающуюся при пальпации. У некоторых больных над зоной проекции гемангиомы выслушивают систолический шум. Среди инструментальных способов исследования наиболее информативны компьютерная томография, при которой обнаруживается богатая жидкостью многокамерная опухоль; целиакогра-фия; ультразвуковое исследование; лапароскопия.
Возможно развитие таких осложнении, как разрыв гемангиомы с профузным (зачастую смертельным) внутрибрюшным кровотечением; тромбоз сосудов, питающих опухоль, с последующим некрозом (реже абсцедированием) опухоли; редко — малигнизация.
Лечение. При небольших (менее 5 см) гемангиомах хирургическое лечение не показано. Необходимо динамическое наблюдение. Крупные гемангиомы, угрожающие развитием осложнений, целесообразно удалять. Для этого применяют резекцию печени, объем которой определяется величиной гемангиомы.
Гепатома (развивающаяся из гепатоцитов) и холангиогепатома (развивающаяся из эпителия желчных протоков) встречаются редко, протекают, как правило, бессимптомно. Клинические проявления бо- лезни возникают лишь при достижении опухолью больших размеров, при кровотечении или при перекруте опухоли, расположенной на ножке, в связи с некрозом узла. Гепатомы иногда малигнизируются, поэтому целесообразно их удаление (энуклеация, клиновидная резек- ция печени). Холангиогепатомы не склонны к малигнизации, поэтому при небольших размерах опухоли и отсутствии клинических прояв- лений их удаление не обязательно. ^
Другие доброкачественные опухоли печени мезенхимального и смешанного происхождения встречаются исключительно редко.
Злокачественные опухоли
Первичный рак печени является относительно редким заболеванием в странах Европы и Северной Америки, в то время как в странах Юго-Восточной Азии, Центральной и Южной Африки он встречается в десятки и сотни раз чаще, занимая в некоторых странах первое место в структуре всех онкологических заболеваний. В нашей стране первичный рак печени наиболее часто наблюдается в некоторых областях Западной Сибири (Тюменская, Омская) и Дальнего Востока (Приморский край). По данным ВОЗ, ежегодно от рака печени погибает около 750 ООО человек. В последние десятилетия отмечена отчетливая тенденция к увеличению заболеваемости.
В абсолютном большинстве случаев рак развивается на фоне предшествующих хронических заболеваний печени (цирроз, гемо-хроматоз, амебиаз, шистозоматоз, описторхоз). Наиболее частой причиной развития рака является цирроз печени. Он выявляется у 60—70% больных с первичным раком печени. В нашей стране, кроме цирроза печени, важную роль в патогенезе этого заболевания имеют паразитарные заболевания печени (описторхоз) в эндемичных районах.
Патологоанатомическая картина. Макроскопически рак имеет вид плотного белесоватого узла, при этом более чем у 75% больных выявляют дополнительные раковые узлы больших или меньших размеров в прилежащих отделах печени и даже в другой доле (метастазированне рака в паренхиму печени). При милиарной форме определяют множественные мелкие раковые узлы, поражающие правую и левую доли печени.
Гистологически различают гепатоцеллюлярный рак, развивающийся из гепатоцитов, и холангиоцеллюлярный рак, развивающийся из эпителия внутрипеченочных желчных протоков. Гепатоцеллюлярный рак наблюдается в 4 раза чаще, чем холангиоцеллюлярный.
Клиническая картина и диагностика. На ранних стадиях клинические проявления заболевания отсутствуют или весьма скудны. При этом преобладают общие симптомы онкологического заболевания: слабость, похудание, снижение работоспособности, утомляемость, анорексия, психическая депрессия. В более поздних стадиях больные отмечают тупые боли в правом подреберье, гипертермию. У 30% из них выявляют гепатомегалию, реже — опухолевый узел или плотный бугристый нижний край печени. К поздним симптомам относят асцит и обтурационную желтуху, возникающие за счет сдавления опухолью внутрипеченочных ветвей воротной вены и магистральных желчных протоков.
Быстрое прогрессирование симптомов болезни, ухудшение общего состояния пациентов с циррозом печени указывают на развитие цирроза-рака печени. Большинство инструментальных методов исследования выявляют косвенные признаки ракового процесса, характерные для объемного образования. Морфологическое подтверждение диагноза можно получить при лапароскопии с прицельной биопсией опухолевого узла, а также при пункции опухоли под контролем ультразвукового исследования или компьютерной томографии. У больных гепатоцеллюлярным раком, кроме того, в крови определяют фетопротеин (эмбриональный белок) в довольно высокой концентрации.
Осложнения. Наиболее часто возникают разрыв опухолевого узла с кровотечением в брюшную полость, распад опухоли с ее ин-фицироваием и абсцедированием, механическая желтуха, гнойный холангит. Желтуха и асцит, выявляемые почти у половины больных, свидетельствуют о поздней стадии заболевания, когда шансы на успех от лечения минимальны.
Лечение. Радикальная операция выполнима лишь у 15—20% больных. В зависимости от размеров опухоли и ее локализации выполняют сегментэктомию, лобэктомию или гемигепатэктомию. Летальность при этом составяет 10—20%. Целесообразно сочетание резекции печени с последующей химиотерапией. Наилучшего эффекта достигают при введении химиотерапевтических препаратов в печеночную артерию или пупочную вену. Пятилетняя выживаемость составляет 10—20%. В последние годы в хирургическом лечении рака печени используют гепатэктомию с последующей трансплантацией печени.
Прогноз. Обычно прогноз заболевания неблагоприятный. Лишь у незначительной части больных удается достичь излечения или сколько-нибудь значительного продления жизни.
Саркома, меланома встречаются исключительно редко и не имеют специфической клинической картины. Способы инструментальной диагностики такие же, как и при первичном раке печени.
Вторичные опухоли печени являются метастазами злокачественных опухолей из других органов: желудка, поджелудочной железы, толстой кишки, легких и т. п. Более чем у половины больных с раком органов пищеварительного тракта на вскрытии обнаруживают метастазы в печени.
Среди клинических проявлений заболевания ведущее место занимают симптомы первичного ракового процесса в том или ином органе грудной или брюшной полости. Данные физикального обследования и инструментальных методов исследования такие же, как и при первичном раке печени. При множественных метастазах в печени выполнение радикального оперативного вмешательства по поводу первичной опухоли нецелесообразно. Тем не менее при солитарных метастазах рекомендуется удаление первичной опухоли в сочетании с резекцией печени. Это позволяет продлить жизнь пациентам, особенно при метастазировании опухолей толстой кишки. В этих случаях пятилетняя выживаемость после комбинированных операций достигает 20-25%.
СИНДРОМ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ
Портальная гипертензия является синдромом, характеризующимся рядом специфических проявлений и возникающим при некоторых врожденных и приобретенных заболеваниях внутренних органов, приводящих к нарушению оттока крови из воротной вены и ее ветвей.
Этиология и патогенез. В зависимости от уровня, на котором образуется препятствие (блок) для оттока крови по системе воротной вены, различают четыре основные формы синдрома: пред-печеночную (допеченочную), внутрипеченочную, надпеченочную и смешанную.
Предпеченочную (допеченочную) форму портальной гипертензии принято разделять на первичную, связанную с автономной (наиболее часто врожденной или постнатальной) патологией сосудов портальной системы, и вторичную, вызванную сдавлением этих сосудов извне. Среди врожденных причин синдрома наиболее частыми являются аплазия, гипоплазия, кавернозная трансформация и атрезия воротной вены. Обычно атрезия обусловлена распространением физиологического процесса постнатальной облитерации пупочной вены и венозного (аранциевого) протока на воротную вену. Приобретенный тромбоз воротной вены чаще всего возникает при острых воспалительных заболеваниях органов брюшной полости — остром деструктивном аппендиците, холецистите, гнойном холангите, панкреатите и т. п. Сдавление и вторичный тромбоз воротной и селезеночной вен могут вызывать кисты, крупные доброкачественные и злокачественные опухоли поджелудочной железы.
Внутрипеченочная аЪорма (до 80—90% всех случаев портальной гипертензии) наиболее часто обусловлена циррозом печени той или иной этиологии. Значительно реже причинами развития внутрипече-ночной портальной гипертензии являются злокачественные новообразования печени, пгастозоматоз, эхинококкоз и врожденный фиброз печени.
Надпеченочная аюрма встречается редко. Она может быть обусловлена болезнью Киари или синдромом Балда — Киари. Болезнь Ки-ари — эндофлебит печеночных вен с последующим их тромбозом, синдром Балда — Киари — сдавление или окклюзия нижней полой вены на уровне или выше впадения в нее печеночных вен. Данный синдром может быть обусловлен наличием соединительнотканных мембран в просвете полой вены или ее сдавлением извне опухолями, кистами, рубцами и т. п. Значительно реже выраженное повышение давления в печеночных венах развивается при констриктивном перикардите, недостаточности правого предсердно-желудочкового клапана с декомпенсацией кровообращения. В этих случаях при длительном течении заболевания развивается так называемый сердечный цирроз печени с последующим присоединением внутрипеченочного блока портального кровообращения.
Смешанная аюрма портальной гипертензии обычно развивается при сочетании внутрипеченочного и допеченочного блоков портального кровообращения (тромбоз воротной вены на фоне цирроза печени), что существенно ограничивает возможности ее оперативной коррекции и ухудшает прогноз болезни.
Особый вид портальной гипертензии без наличия препятствия для оттока крови из воротной вены возникает при увеличении гепатопе-тальной циркуляции крови вследствие артериовенозного свища на любом уровне воротной вены или ее притоков. Чаще всего свищ локализуется на уровне селезеночных сосудов и формируется в результате деструкции стенки аневризмы селезеночной артерии и прилежащей к ней селезеночной вены.
Патогенез портальной гипертензии весьма сложен и до конца еще не изучен, причем при разных формах синдрома он имеет свои особенности.
При внутрипеченочной форме выраженное изменение морфологического строения печени вызывает значительную перестройку ее ан-гиоархитектоники, что приводит к повышению сопротивления оттоку крови из воротной вены. При этом формируются прямые портопече-ночные анастомозы, обеспечивающие частичный сброс крови из воротной вены и печеночной артерии в систему печеночных вен. Это приводит к ишемии печеночной паренхимы и нарушению метаболизма в гепатоцитах, нарушению дез интоксикационной функции печени. Клинически это может проявляться энцефалопатией. За счет повышения давления в системе воротной вены начинают функционировать естественные портокавальные анастомозы. Клинически значимыми являются анастомозы в области проксимального отдела желудка и дис-тального отдела пищевода, где возникает варикозное расширение вен и откуда наиболее часто наблюдается кровотечение при их разрыве.
Значительно реже наблюдается расширение геморроидальных и подкожных вен в области передней брюшной стенки.
В связи со спазмом и значительным сопротивлением кровотоку по системе печеночной артерии возникает перераспределение его в системе чревного ствола, что приводит к увеличению объемного кровотока по селезеночной артерии. В сочетании с затруднением оттока крови по селезеночной вене это влечет за собой развитие спленомегалии, а при гиперплазии ретикулоэндотелиальной ткани — гиперспленизму (уменьшение числа эритроцитов, лейкоцитов и тромбоцитов в анализе крови). В развитии асцита при внутрипечеиочной форме синдрома принимает участие ряд факторов: повышение лимфообразования в печени (вследствие внутрипеченочного венозного стаза), снижение онкотического давления крови за счет гипоальбуминемии, нарушения водно-электролитного баланса, замедление инактивации альдостерона и антидиуретического гормона в функционально неполноценной печени.
При предпеченочной (допеченочной) форме синдрома отмечают уменьшение портального кровоснабжения печени, расширение селезеночной артерии, значительное повышение давления в селезеночной вене и селезенке, что и является причиной развития спленомегалии, а у некоторых больных и гиперспленизма. Указанные гемодинамиче-ские сдвиги приводят к формированию порто-портальных анастомозов. При этом кровоток из портальной системы в печень осуществляется по истинным добавочным воротным венам или сосудам печеночно-двенадцатиперстной связки и малого сальника. Давление во внутрипеченочных ветвях воротной вены не повышается, грубые нарушения функции печени не возникают, в связи с чем асцит наблюдается исключительно редко.
Патогенез надпеченочной формы портальной гипертензии определяется повышением давления в печеночных венах, что и является основной причиной застоя крови в печени и повышения давления в воротной вене и ее притоках. В результате развивается цирроз печени с присоединением гемодинамических сдвигов, характерных для внутрипечеиочной формы синдрома.
В патогенезе смешанной формы портальной гипертензии принимают участие те же факторы, что и при внутрипечеиочной и надпеченочной формах, причем ведущая роль принадлежит факторам, обусловленным циррозом печени.
Клиническая картина и диагностика. Клинические проявления различных форм портальной гипертензии связаны прежде всего с тем заболеванием, которое послужило причиной повышения давления в воротной вене.
При предпеченочной форме синдрома заболевание возникает чаще в детском возрасте, протекает относительно благоприятно. Наиболее частыми его проявлениями бывают кровотечения из расширенных вен пищевода, спленомегалия, гиперспленизм.
В случае внутрипечеиочной формы портальной гипертензии ведущими признаками заболевания являются симптомы цирроза (постнекротический, алкогольный и т.п.), активность процесса, степень компенсации нарушенных функций печени. Характерны диспепсические явления (боли в эпигастральной области, отсутствие аппетита, тошнота, метеоризм), внепеченочные знаки («сосудистые звездочки», «печеночные ладони» и т. п.). Портальная гипертензия проявляется у этих пациентов спленомегалией, реже — гиперспленизмом, расширением вен пищевода, кардии желудка, передней брюшной стенки в виде «головы медузы», асцитом. Грозным осложнением является кровотечение из варикозно-расширенных вен пищевода и желудка. При этом возникает срыгивание или рвота неизмененной кровью без каких-либо предшествующих болевых ощущений. При массивном кровотечении, затекании крови в желудок могут возникать рвота «кофейной гущей», мелена; развивается тахикардия, падает артериальное давление. Летальность при впервые возникшем кровотечении из варикозно-расширенных вен пищевода при циррозе печени высока — 30-50% и более. Повторные кровотечения, асцит, желтуха (за счет поражения паренхимы печени) являются признаками запущенной стадии цирроза печени и оставляют мало шансов на успех лекарственного или хирургического лечения.
Надпеченочная аЪорма синдрома портальной гипертензии чаще обусловлена болезнью Киари или синдромом Бадда — Киари. При острой форме развития болезни Киари внезапно возникают довольно сильные боли в эпигастрии, правом подреберье, быстро нарастают гепатомега-лия, гипертермия, асцит. Смерть больных наступает в результате профузных кровотечений из варикозно-расширенных вен пищевода или от печеночно-почечной недостаточности.
При хронической форме течения болезни постепенно нарастают гепатомегалия и спленомегалия, развивается коллатеральная венозная сосудистая сеть на передней брюшной и грудной стенках, нарастают асцит, истощение, нарушается белковый обмен (гипоальбуминемия).
Анамнез и объективные данные клинического исследования с учетом преобладающей частоты внутрипечеиочной формы блока позволяют поставить в большинстве случаев правильный предварительный диагноз. Среди инструментальных исследований в первую очередь применяют рентгенологическое исследование пищевода и желудка для выявления варикозного расширения вен в дистальной части пищевода. О наличии его свидетельствуют множественые округлые или овальные дефекты наполнения при контрастировании пищевода (рис. 114). Более полную информацию о состоянии вен пищевода дает эндоскопическое исследование. Важное значение в определении уровня препятствия для оттока крови из воротной вены имеют инструментальные методы исследования (целиакография — артериальная и венозная фазы, ка-вография, спленопортография и др.). При внутрипеченочном блоке ценная информация об активности процесса может быть получена при оценке функционального состояния печени по данным лабораторных исследований.
Спленопортографию и спленоманометрию выполняют в рентгеновском кабинете под контролем рентгенотелевизионного экрана. Под местной анестезией пунктируют селезенку, ориентируясь на ее пер-куторно определяемые границы и тень на рентгеновском экране. К иг-
ле, введенной в ее ткань, присоединяют аппарат Вальдмана и измеряют кровяное давление в сосудах селезенки. При портальной гипертензии давление обычно превышает 250 мм вод. ст., иногда достигая 500—600 мм вод. ст. и более (норма НО—120 мм). После измерения давления через иглу вводят контрастное вещество: триомбраст для инъекций (верографин и т. п.) и производят серию рентгенограмм. Характерными симптомами портальной гипертензии при спле-нопортографии (рис. 115) являются значительное расширение воротной вены и ее притоков, бедность внутрипеченочного сосудистого рисунка (при внутрипечеиочной форме синдрома) или участок тромботической окклюзии воротной или селезеночной вены (при предпеченочной форме синдрома). Для диагностики надпеченочной формы синдрома портальной гипертензии применяют кавографию (введение контраста в нижнюю полую вену через вены бедра по Сельдингеру).
Кавография позволяет определить уровень препятствия для оттока крови из печеночных вен, место сужения или окклюзии нижней полой вены. Возможна также селективная катетеризация печеночных вен и их контрастирование с выполнением серии рентгеновских снимков.
При целиакографии удается отдифференцировать внутри- и пред-печеночную формы синдрома. Обычно при первой форме отмечаются расширение и извитость селезеночной артерии, сужение печеночной артерии, обеднение внутрипеченочного сосудистого рисунка (рис. 116). В венозную фазу видны селезеночная и воротная вены.
Лечение. Необходимо проведение комплекса мероприятий как в отношении заболевания, вызвавшего портальную гипертензию, так и в отношении самого синдрома портальной гипертензии.
При предпеченочной форме больные подлежат оперативному лечению, особенно при рецидивирующих кровотечениях из вен пищевода. Для снижения давления в воротной вене применяют один из вариантов
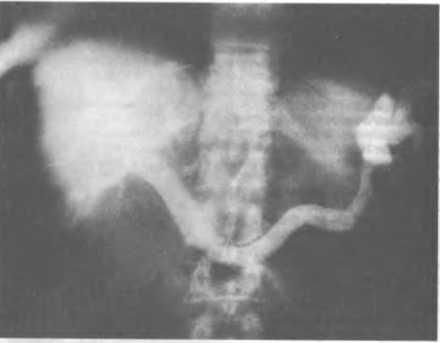
Рис 115. Портальная гипертензня. Спленопортограмма.

Рис 116. Портальная гипертензня, внутрипеченочная форма. Расширение селезеночной артерии н значительное сужение печеночной артернн н ее ветвей (артериальная фаза). Целиакограмма.
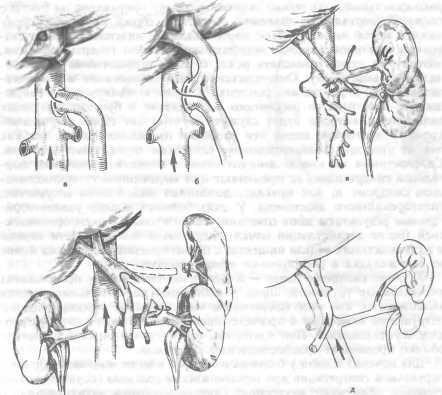
Рис 117. Виды портокавольных сосудистых анастомозов.
в — прямой портокавальный по типу конец в бок; б — прямой портокавальный по типу бок я бок; в — мсэентерико-кавальный; г — спленоренальный (центральный); д — сплено-нальный (дистальный).
прямого портокавального, мезентерико-кавального или спленореналь-ного анастомоза (рис. 117). Если наложение сосудистого анастомоза невозможно, то применяют оменторенопексию — подшивание большого сальника к почке после предварительной ее декапсуляции. Операция рассчитана на формирование в последующем межорганных анастомозов между сосудами портальной (сальник) и кавальной (почка) систем. При выраженной спленомегалии, особенно при гиперспленизме, производят спленэктомию.
При внутрипеченочном блоке и циррозе печени, осложненном портальной гипертензией, хирургическое лечение возможно лишь при отсутствии активного процесса в печени и симптомов печеночной недостаточности. При выборе метода операции учитывают возраст, общее состояние пациента, наличие сопутствующих заболеваний, степень компенсации нарушенных функций печени, высоту портального давления, выраженность гиперспленизма и т. п. Создание прямых
портокавальных сосудистых анастомозов (спленоренальный, мезенте-рико-кавальный, собственно портокавальный) направлено на быстрое снижение портального давления вследствие сброса крови в систему нижней полой вены. Прямые портокавальные анастомозы часто становятся причиной тяжелой энцефалопатии за счет гипераммониемии, поэтому их стали применять реже, отдавая предпочтение спленоре-нальному анастомозу. Оментопексия (оменторенопексия и оментоге-патопексия), перемещение селезенки в грудную полость или в забрю-шинное пространство рассчитаны на создание в будущем органных анастомозов, которые будут служить шунтом для сброса портальной крови. В настоящее время эти операции применяют редко, так как они не приводят к значительному снижению портального давления. Спленэктомия не имеет самостоятельного значения в лечении портальной гипертензии, ее применяют при выраженном гиперсплениче-ском синдроме и, как правило, дополняют наложением сосудистого спленоренального анастомоза. У ряда больных вполне удовлетворительные результаты дают сочетание спленэктомии с оментореноплек-сией (после декапсуляции почки), перевязкой вен в области кардии и абдоминального отдела пищевода с целью прекращения оттока крови из вен желудка в расширенные вены пищевода.
Лечение синдрома Бадда — Киари и болезни Киари представляет значительные трудности. Лишь у небольшой части больных удается выполнить то или иное оперативное вмешательство (чреспредсердное разрушение мембраны в просвете полой вены, обходное кавопредсер-дное шунтирование). При повторных кровотечениях из вен пищевода обычно производят спленоренальный анастомоз.
Для лечения асцита у больных с внутри- и надпеченочной формами портальной гипертензии при невозможности создания сосудистых анастомозов применяют внутреннее перитонеовенозное шунтирование с помощью специального зонда с клапаном, обеспечивающим одностороннее перекачивание асцитической жидкости из брюшной полости в яремную вену или повторные инфузий асцитической жидкости в промежуточную вену локтя. В ряде случаев хорошие результаты дает операция наложения лимфовенозного анастомоза на шее. При этом грудной (лимфатический) проток соединяют с яремной веной. У некоторых больных с внутрипечеиочной или надпеченочной формами синдрома портальной гипертензии возможно выполнение трансплантации печени — единственной радикальной операции, позволяющей излечить их от данного страдания.
Лечение кровотечения из варикозно-расширенных вен пищевода начинают с консервативных мероприятий: тампонады пищевода зондом Блэкмора, гемостатической терапии, трансфузии крови и кровезаме-щающих жидкостей, для снижения портального давления внутривенно вводят питуитрин. Зонд Блэкмора (рис. 118) состоит из трехпросветной резиновой трубки с двумя баллонами. Два канала зонда служат для раздувания баллонов, третий (открывающийся в дистальной части зонда) — для аспирации желудочного содержимого и контроля за эффективностью гемостаза. Зонд вводят через нос в желудок, раздувают дистальный (желудочный) баллон, нагнетая 60—70 мл воздуха. Затем
Р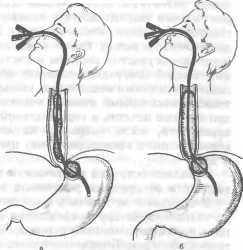 ис.
118.
Положение
зонда
Блэкмора
в
пищеводе.
ис.
118.
Положение
зонда
Блэкмора
в
пищеводе.
а — раздута желудочная манжетка; б — раздута манжетка а пищеводе.
зонд подтягивают до ощущения сопротивления, возникающего при локализации баллона в области кардии. После этого в пищеводный баллон нагнетают 100—150 мл воздуха. В таком состоянии стенки эластичного баллона оказывают равномерное давление по всей окружности пищевода, сдавливая кровоточащие вены его дистального отдела и кардиального отдела желудка. Через несколько часов ослабляют давление в баллонах, контролируя путем аспирации содержимого желудка через зонд эффект гемостаза. Зонд в пищеводе не должен находиться более 2 сут в связи с опасностью развития пролежней.
Флебосклерозирующие препараты (варикоцид, тромбовар и т. п.), применяемые для остановки кровотечения из варикозно-расширенных вен пищевода, вводят через эзофагоскоп специальной иглой в просвет вены или паравенозно. С целью создания благоприятных условий для слипания стенок варикозно-расширенных вен на сутки вводят зонд Блэкмора.
При неэффективности консервативного лечения кровотечения из варикозно-расширенных вен пищевода в качестве вынужденной меры применяют различные типы хирургических вмешательств. Они направлены на остановку кровотечения и разобщение портокавальных анастомозов гастроэзофагеальной зоны. В связи с тяжелым состоянием больного наиболее часто используют чрезжелудочную перевязку расширенных вен пищевода и кардии. Значительно реже выполняют проксимальную резекцию желудка и абдоминального отдела пищевода, наложение сосудистого прямого портокавального анастомоза. Прогноз неблагоприятный, летальность после этих операций (особенно у лиц с внутрипечеиочной формой синдрома) достигает 50—75%.
ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ
Термин «печеночная недостаточность» является собирательным понятием, включающим в себя не только нарушение одной или нескольких функций печени, но и нарушение функционального состояния других жизненно важных органов и прежде всего головного мозга.
Этиология и патогенез. Наиболее частыми причинами, ведущими к развитию печеночной недостаточности, являются острый и хронический гепатиты, цирроз печени, заболевания, сопровождающиеся развитием механической желтухи (желчнокаменная болезнь, рак головки поджелудочной железы или большого сосочка двенадцатиперстной кишки, внепеченочных желчных путей). Печеночная недостаточность может быть также вызвана тяжелыми заболеваниями сердечно-сосудистой системы и системы мочевыделения, коллагеноза-ми, тяжелой сочетанной травмой, обширными ожогами, отравлениями гепатотоксичными веществами (четыреххлористым углеродом, дихлорэтаном, некоторыми видами инсектицидов). Она наблюдается также при циррозе печени, в терминальной стадии развития общего гнойного перитонита, после операций на «открытом» сердце с применением искусственного кровообращения, при неадекватной перфузии органов и др.
Выделяют острую и хроническую печеночную недостаточность. В зависимости от причины различают эндо- и экзогенную формы.
В патогенезе печеночной недостаточности важная роль принадлежит не только характеру повреждения гепатоцитов (дистрофия, некроз), но и поражению головного мозга, что во многом определяет тяжесть течения болезни. Поражение головного мозга связывают с накоплением в крови различных церебротоксических веществ: аммиака, ароматических и серосодержащих аминокислот, пировиноградной, молочной кислот и т. п.
Клиническая картина и диагностика. Клинические проявления печеночной недостаточности разнообразны и определяются вызвавшей ее причиной. Они также зависят от того, какие функции печени пострадали более всего (белково-синтетическая, пигментооб-разования, дезинтоксикационная и т. д.). Симптомами печеночной недостаточности являются иктеричность кожных покровов и слизистых оболочек, «сосудистые звездочки» на коже туловища (при хронической форме недостаточности), подкожные или подслизистые кровоизлияния, кровотечения в просвет пищеварительного тракта. При физикальном исследовании выявляют увеличение или, наоборот, уменьшение размеров печени, болезненность ее при пальпации, асцит, спленомегалию.
В анализах крови отмечают гипопротеинемию, нарушение соотношения белковых фракций с преобладанием грубодисперсных компонентов (глобулины), гипербилирубинемию, снижение уровня фибриногена, протромбина, холестерина. Содержание трансаминаз повышено. Тимоловая проба, как правило, повышена, сулемовая значительно снижена. Довольно рано выявляют нарушения водно-электролитного обмена (снижение уровня калия и натрия в плазме крови).
Тяжесть печеночной недостаточности тесно взаимосвязана с интенсивностью желтухи, гипераммониемии. Источниками гипераммоние-мии являются пищевые белки, кровь, изливающаяся в просвет пищеварительного тракта (чаще при кровотечении из варикозно-расширенных вен пищевода). Под влиянием пищеварительных соков и ферментов из белков образуется аммиак. В условиях нарушения дезинтоксика-ционной функции печени аммиак не подвергается разрушению и попадает в общий кровоток, оказывая токсическое действие на головной мозг. Степень тяжести печеночной недостаточности определяет выраженность нервно-психических расстройств. На ранних стадиях выявляют психическую депрессию или, наоборот, эйфорию, которые часто сменяют друг друга. Позднее происходят изменения неврологического статуса: нарушение координации движения, речи, заторможенность сознания. В финальной стадии болезни развивается коматозное состояние.
Диагноз печеночной недостаточности ставят на основании данных анамнеза, клинического обследования, лабораторных анализов, отражающих состояние различных функций печени, а также электроэнцефалографии.
Лечение. Все лечебные мероприятия начинают с лечения основного заболевания, послужившего причиной ее развития. При обтурационной желтухе показано оперативное лечение, направленное на восстановление оттока желчи и снижение уровня билирубина в крови. В зависимости от уровня препятствия в желчных путях используют наружное отведение желчи (холангиостомию) или наложение внутренних билиодигестивных анастомозов (с тощей или двенадцатиперстной кишками). При отравлении гепатотоксичными ядами проводят массивную инфузионную антитоксическую терапию. Питание должно быть высококалорийным с резким ограничением вводимого в организм белка. При портальном циррозе печени, осложненном кровотечением из варикозно-расширенных вен пищевода, необходимо эвакуировать излившуюся кровь путем аспирации из желудка, постановки, очистительных клизм. Назначают антибиотики, не всасывающиеся из просвета пищеварительного тракта, для подавления микрофлоры, ведущей к разложению крови и образованию аммиака.
Перспективным направлением в лечении печеночной недостаточности можно считать плазмо- и гемосорбцию, плазмаферез, наружное дренирование грудного протока, а при печеночной гипоксии — гипербарическую оксигенацию.
Прогноз. Причины и стадия развития печеночной недостаточности определяют прогноз заболевания. На ранних стадиях при интенсивной терапии удается добиться излечения больных, если причина печеночной недостаточности устранена. У больных с печеночной недостаточностью в финальной стадии с развитием печеночной комы прогноз неблагоприятный.
ЖЕЛЧНЫЙ ПУЗЫРЬ И ЖЕЛЧНЫЕ ПРОТОКИ
Правый и левый печеночные протоки, выходя из одноименных долей печени, образуют общий печеночный проток. Ширина его варьирует от 0,4 до 1 см (в среднем около 0,5 см). Длина протока около 2,5—3,5 см. Общий печеночный проток и пузырный проток, соединяясь, образуют общий желчный проток. Длина общего желчного протока 6—8 см, ширина 0,5—1,0 см. В общем желчном протоке выделяют четыре отдела: супрадуоденальный, расположенный над двенадцатиперстной кишкой, ретродуоденаль-ный, проходящий позади верхнегоризонтальной ветви двенадцатиперстной кишки, ре-тропанкреатический, расположенный позади головки поджелудочной железы, и интра-муральный, находящийся в стенке вертикальной ветви двенадцатиперстной кишки (рис. 119). Дистальный отдел общего желчного протока образует большой сосочек двенадцатиперстной кишки (фатеров сосок), расположенный в ее подслизистой основе. Он обладает автономной мышечной системой, состоящей из продольных, циркулярных

Рис 119. Строение желче выводящих путей. 1— левый печеночный проток; 2 — правый печеночный проток; 3 — общий печеночный проток; 5 — пузырный проток; б — общий желчный проток; 7 — двенадцати псрстая кишка; 8 — добавочный проток поджелудочной железы (санториннсв проток); 9 — большой сосочек двенадцатиперстной кишки (фатеров сосок); 10 — проток поджелудочной железы (вирсунгов проток).
и косых волокон (сфинктер Одди), не зависящей от мышц двенадцатиперстной кишки. К нему подходит проток поджелудочной железы, образуя вместе с терминальным отделом общего желчного протока ампулу большого сосочка двенадцатиперстной кишки. В более редких случаях общий желчный проток и проток поджелудочной железы открываются на вершине большого сосочка двенадцатиперстной кишки отдельными отверстиями, а иногда впадают в двенадцатилерстную кишку на расстоянии 1—2 см один от другого. Различные варианты взаимоотношений желчного протока и протока поджелудочной железы всегда должны быть учтены при выполнении оперативного вмешательства на большом сосочке двенадцатиперстной кишки.
Желчный пузырь расположен на нижней поверхности печени в небольшом углублении. Большая часть его поверхности покрыта брюшиной за исключением области, прилежащей к печени. Емкость пузыря — 50—70 мл. Его форма и размеры могут претерпевать изменения при воспалительных и Рубцовых процессах в пузыре. Выделяют дно, тело и шейку желчного пузыря, которая переходит в пузырный проток. Часто в шейке желчного пузыря образуется бухтообразное выпячивание — карман Гартмана. Пузырный проток чаще впадает в правую полуокружность общего желчного протока под острым утлом. Имеются и другие варианты впадения пузырного протока: в правый печеночный проток; в левую полуокружность общего печеночного протока; высокое и низкое впадение протока, когда пузырный проток на большом протяжении сопровождает общий печеночный проток.
Стенка желчного пузыря состоит из трех оболочек: слизистой, мышечной и фиброзной. Слизистая оболочка пузыря образует многочисленные складки. В области шейки пузыря и начальной части пузырного протока слизистая оболочка формирует спиральную складку (клапаны Гейстера). В более дистальных отделах пузырного протока вместе с пучками гладкомышечных волокон складки слизистой оболочки образуют сфинктер Люткенса. Слизистая оболочка образует множественные выпячивания, расположенные между мышечными пучками — синусы Рокитаиского — Ашоффа. В фиброзной оболочке (чаще в области ложа пузыря) расположены аберрантные печеночные канальцы, не сообщающиеся с просветом желчного пузыря. Крипты и аберрантные канальцы могут быть местом задержки микрофлоры, что обусловливает воспаление всей толщи стенки желчного пузыря.
Кровоснабжение желчного пузыря осуществляет пузырная артерия, идущая к нему со стороны шейки одним или двумя стволами от собственной печеночной артерии или ее правой ветви. Известно много других вариантов отхождения пузырной артерии, которые необходимо знать хирургу.
Лимфоотток происходит в лимфатические узлы ворот печени и лимфатическую систему самой печени.
Иннервация желчного пузыря осуществляется из печеночного сплетения, образованного ветвями чревного сплетения, левого блуждающего нерва и правого диафрагмального нерва.
Желчь, продуцируемая в печени и поступающая во вне печеночные желчные протоки, состоит из воды (97%), желчных солей (1—2%), пигментов, холестерина и жирных кислот (около 1%). Средний дебит выделения желчи печенью — 40 мл/мин. В межпищеварительный период сфинктер Одди находится в состоянии сокращения. При достижении определенного уровня давления в общем желчном протоке раскрывается сфинктер Люткенса и желчь из печеночных протоков попадает в желчный пузырь. Здесь происходит концентрация желчи за счет всасывания воды и электролитов. При этом содержание основных компонентов желчи (желчных кислот, пигментов холестерина, кальция) повышается в 5—10 раз от их исходного уровня в печеночной желчи. Пища, кислый желудочный сок, жиры, попадая на слизистую оболочку двенадцатиперстной кишки, вызывают выделение в кровь интестинальных гормонов — холецистокинина, секретина, которые вызывают сокращение желчного пузыря и одновременное расслабление сфинктера Одди. Когда химус покидает двенадцатиперстную кишку и содержимое ее вновь становится щелочным, выделение в кровь гормонов прекращается и сфинктер Одди сокращается, препятствуя дальнейшему поступлению желчи в кишечник. В сутки в кишечник поступает около 1 л желчи.
Специальные методы исследования
Ультразвуковое исследование является основным способом диагностики заболеваний желчного пузыря и желчных протоков. Данный метод позволяет определить даже мелкие (размером 1—2 мм) конкременты в просвете желчного пузыря (реже в желчных протоках), определить толщину стенки желчного пузыря, размеры поджелудочной железы, дилатацию желчных путей, УЗ И может быть выполнено при остром воспалительном процессе и обтурационной желтухе.
Холецистохолангиография (пероральная, внутривенная, инфузи-онная) является менее информативным методом исследования. Этот способ неприменим при обтурационной желтухе и при непереносимости йод содержащих препаратов. Холецистохолангиография показана при невозможности выполнения УЗИ.
Ретроградная панкреатохолангиорентгенография (контрастирование желчных протоков с помощью эндоскопической канюляции большого сосочка двенадцатиперстной кишки и введение контрастного вещества в общий желчный проток) — ценный метод диагностики поражения магистральных желчных путей. Особенно важную информацию он может дать при механической желтухе различного генеза.
Чрескожную чреспеченочную холангиографию применяют у больных с обтурационной желтухой при невозможности выполнения ретроградной панкреатохолангиографии. При этом под контролем УЗИ и рентгенотелевидения пунктируют расширенный проток правой или левой доли печени. После эвакуации желчи в просвет желчного хода вводят 100—120 мл контрастного вещества (верографин и др.) и затем выполняют серию снимков. Это позволяет получить четкое изображение желчных путей, определить причину механической желтухи и уровень препятствия. Вследствие возможности желчеистечения из места пункции печени данный способ исследования обычно выполняют непосредственно перед операцией.
Рентгеноконтрастное исследование желчного пузыря и желчных путей может быть также выполнено с помощью пункции желчного пузыря под контролем УЗИ или во время лапароскопии.
Компьютерная томография печени обычно используется при злокачественных новообразованиях желчных путей и желчного пузыря для уточнения операбельное™ (наличие метастазов). Кроме того, под контролем компьютерной томографии может быть выполнена пункция желчного пузыря или внутрипеченочных желчных протоков с последующим введением в их просвет контрастного вещества для рентгенографии.
ВРОЖДЕННЫЕ АНОМАЛИИ РАЗВИТИЯ ЖЕЛЧЕВЫВОДЯЩИХ ПРОТОКОВ
Атрезия внутри- или внепеченочных протоков и желчного пузыря. Основным проявлением атрезий протоков бывает обтурационная желтуха, которая появляется у ребенка при рождении и прогрессивно нарастает. Быстро развивается билиарный цирроз печени с портальной гипертензией за счет внутрипеченочного блока. Появляются нарушения белкового, углеводного, жирового обменов, а также свертывающей системы крови в сторону гипокоакуляции.
Лечение. Атрезий желчных протоков подлежат оперативному лечению — наложению билиодигестивных анастомозов между вне-или внутрипеченочными желчными протоками и кишкой (тощей или двенадцатиперстной) или желудком. При атрезий внутрипеченочных желчных протоков оперативное вмешательство невозможно. В этих случаях единственным шансом на спасение жизни больного является пересадка печени.
Киста общего желчного протока. Характерно расширение зоны общего печеночного и общего желчного протоков («гепатикохоледоха») шаровидной или овальной формы размером от 3—4 до 15—20 см. Болезнь проявляется тупыми болями в эпигастрии и правом подреберье, обтурационной желтухой за счет застоя густой желчи в полости ки-стозно-расширенного общего желчного протока. Диагностика сложна, требует применения современных инструментальных способов исследования: холангиографии, ультразвукового исследования, компьютерной томографии, лапароскопии.
Лечение. Накладывают билиодигестивные анастомозы между кистой и двенадцатиперстной или тощей кишкой (с иссечением большей части стенок кисты или без иссечения).
ПОВРЕЖДЕНИЯ ЖЕЛЧНЫХ ПУТЕЙ
Открытые повреждения желчных путей возникают при ранениях огнестрельным или холодным оружием, во время выполнения оперативного вмешательства, закрытые — при тупой травме живота. За исключением интраоперационных травм, все другие повреждения вне-печеночных желчных путей сочетаются с повреждениями печени, желудка, кишечника и т. п. Лечение оперативное. Выбор метода операции зависит от характера повреждения желчных путей, их протяженности, общего состояния больного.
Интраоперационные повреждения внепеченочных желчных протоков встречаются при холецистэктомии, когда затруднена ориентировка в анатомических образованиях вследствие выраженных воспалитель-но-рубцовых изменений пузыря и печеночно-двенадцатиперстной связки, аномалий строения желчных протоков или анатомических вариантов желчных протоков, а также в результате технических ошибок хирурга. Чаще происходит ранение стенки правого печеночного или общего желчного протока, реже — их полное пересечение или лиги-рование, когда эти анатомические образования принимают за пузырный проток. Повреждения- внепеченочных желчных путей встречаются при резекции желудка, особенно по поводу низких постбульбарных язв двенадцатиперстной кишки. Возможно пристеночное ранение общего желчного протока или его полное пересечение.
В большинстве случаев повреждение магистральных желчных протоков выявляют в ходе операции, реже — в послеоперационном периоде, при развитии наружных желчных свищей или обтурационной желтухи.
Оперативная коррекция повреждений внепеченочных желчных путей требует в каждом наблюдении индивидуального выбора, восстановительно-реконструктивных операций.
ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ
Желчнокаменная болезнь является распространенным заболеванием, развивающимся у людей в возрасте старше 40 лет. Особенно часто это заболевание наблюдают среди городского населения индустриально развитых стран Европы и Северной Америки. По данным большинства исследователей, около 10% мужчин и до 25% женщин стран Европы страдают желчнокаменной болезнью. У лиц старше 70 лет этот показатель возрастает до 30—40%. Значительно чаще болеют женщины.
Этиология и п а т о г е н е з. Морфологическим субстратом желчнокаменной болезни являются конкременты желчного пузыря и жел-чевыводящих путей. Желчные конкременты состоят из обычных компонентов желчи — билирубина, холестерина, кальция. Чаще всего встречаются смешанные камни, содержащие в большей или меньшей пропорции указанные ингредиенты. При значительном преобладании одного из компонентов говорят о холестериновых (около 90%), пигментных или известковых конкрементах. Их размеры широко варьируют от 1—2 мм до 3—5 см; форма может быть округлой, овальной, в виде многогранника и т. д.
Основным местом образования желчных конкрементов является желчный пузырь, в очень редких случаях — желчные пути. Выделяют три основные причины их образования: нарушение обмена веществ, воспалительные изменения эпителия желчного пузыря и застой желчи. При нарушении обмена веществ основное значение имеет не столько величина гиперхолестеринемии, сколько изменение соотношения в желчи концентрации холестерина, фосфолипидов (лецитина) и желчных кислот. Желчь становится литогенной, т. е. пресыщенной холестерином, который легко выпадает из нарушенного коллоида желчи в виде кристаллов, при увеличении в ней концентрации холестерина и уменьшении концентрации фосфолипидов и желчных кислот (рис. 120). Известно, что желчнокаменная болезнь часто развивается у больных с такими заболеваниями обмена веществ., как диабет, ожирение, гемолитическая анемия.
Рис 120. Треугольная система координат Лдмиранда и Смаяла.
Если показатель соотношения холестерина, желчных кислот и лецитина (фосфолипидов) находится в зоне, очерченной кривой линией, то такая желчь иелитогенна, т.е. холестерин в ней находится а растворенном состоянии. При прочих соотношениях компонентов желчи холестерин выпадает в виде кристаллов.
Повреждения стенки желчного пузыря также имеют немаловажное значение в генезе желчнокаменной болезни. У подавляющего большинства больных желчь является инфицированной. Инфекция приводит к повреждению стенки желчного пузыря, слушиванию ее эпителия. При этом возникают так называемые первичные ядра преципитации (бактерии, комочки слизи, клетки эпителия), служащие основой для выпадения в виде кристаллов основных составных частей желчи, находившихся до этого в коллоидном состоянии. Кроме того, повреждение стенки желчного пузыря нарушает процесс всасывания некоторых компонентов желчи, изменяет их физико-химическое соотношение, что способствует камнеобразованию. Длительный застой желчи играет определенную роль в литогенезе, облегчая выпадение в кристаллы составных частей будущего конкремента, их длительное нахождение в просвете пузыря. Кроме того, при холестазе может повышаться и концентрация холестерина, билирубина, кальция, что увеличивает литогенность желчи. Этому способствуют прием богатой холестерином пищи, ожирение, прием оральных контрацептивов.
Клиническая картина и диагностика. Желчнокаменная болезнь может протекать бессимптомно, и конкременты в желчном пузыре обнаруживают как случайную находку при обследовании пациентов по поводу другого заболевания, при операциях на органах брюшной полости или во время вскрытия. Наиболее часто желчнокаменная болезнь проявляется печеночной (желчной) коликой. Боли возникают чаще всего после погрешности в диете (жирная, острая пища), при физической нагрузке, психоэмоциональном напряжении, тряской езде. Боли носят интенсивный режущий, колющий, раздирающий, реже приступообразный характер. Причинами возникновения болевого приступа являются ущемление конкремента в шейке желчного пузыря или пузырном протоке, повышение давления вследствие нарушения оттока желчи. Боли локализуются в правом подреберье и эпигастральной области за счет иррадиации в чревное сплетение, отдают в поясничную область, правую лопатку, правое предплечье (раздражение ветвей правого диафрагмального нерва), реже возникает
иррадиация болей в область сердца, симулирующая приступ стенокардии — симптом Боткина (холецистокоронарный симптом). Часто приступ печеночной колики сопровождается тошнотой и многократной рвотой с примесью желчи, не приносящей больному облегчения. Колика может длиться от нескольких минут до нескольких часов. Больные при этом беспокойны, часто меняют позу, стараясь найти удобное положение, при котором уменьшается интенсивность боли. Температура тела во время приступа остается нормальной, отмечается умеренная тахикардия — до 100 ударов в 1 мин. Язык влажный, обложен беловатым налетом. При осмотре обращает на себя внимание некоторое вздутие живота, правая половина брюшной стенки отстает в акте дыхания. При пальпации живота возникает резкая болезненность в правом подреберье, особенно в месте проекции желчного пузыря. Защитное напряжение мышц отсутствует или выражено незначительно, выявляют положительные симптомы Ортнера, Георгиевского—Мюсси (болезненность при надавливании между ножками грудино-ключич-но-сосцевидной мышцы). Симптомов раздражения брюшины нет. Количество лейкоцитов в крови нормальное. Приступ болей проходит самостоятельно или после введения спазмолитических средств, способствующих восстановлению оттока желчи.
ХРОНИЧЕСКИЙ КАЛЬКУЛЕЗНЫЙ ХОЛЕЦИСТИТ
Клиническая картина и диагностика. После прекращения приступа печеночной колики пациенты могут чувствовать себя здоровыми (бессимптомная стадия хронического холецистита). Однако нередко у них сохраняются тяжесть и тупые боли в правом подреберье, усиливающиеся после еды, особенно при погрешности в диете, метеоризм, понос после жирной пищи, чувство горечи во рту и изжога, связанные с дуоденогастральным и гастроэзофагальным рефлюксами. Первично-хронический калькулезный холецистит протекает с указанными симптомами без приступов печеночной колики.
Осложнения. Осложнениями калькулезного холецистита являются холедохолитиаз, холантит, рубцовые стриктуры терминального отдела общего желчного протока, внутренние билиодигестивные свищи, водянка желчного пузыря.
Холедохолитиаз — наличие при желчнокаменной болезни конкрементов в общем желчном протоке — одно из наиболее частых осложнений желчнокаменной болезни. У лиц пожилого и старческого возраста холедохолитиаз наблюдают в 2—3 раза чаще. Конкременты в общий желчный проток попадают в подавляющем большинстве случаев из желчного пузыря. Миграция их возможна при коротком широком пузырном протоке, пролежне в области шейки желчного пузыря или кармана Гартмана с образованием широкого свища между желчным пузырем и общим желчным протоком. У некоторых больных (1—4%) возможно первичное образование конкрементов в желчевыводящих путях.
Холедохолитиаз может длительное время протекать бессимптомно. Даже при множественных конкрементах в общем печеночном и общем желчном протоках нарушения пассажа желчи возникают далеко не всегда. Желчь как бы обтекает конкременты, находящиеся в терминальном отделе общего желчного протока, она свободно поступает в двенадцатиперстную кишку. При миграции конкрементов в наиболее узкие отделы зоны общего печеночного и общего желчного протоков — его терминальный отдел и в ампулу большого сосочка двенадцатиперстной кишки возникает препятствие оттоку желчи в кишечник, что клинически проявляется обтурационной желтухой.
Желтуха является основным клиническим признаком холедохоли-тваза. Иногда она носит ремиттирующий характер при наличии так называемого вентильного камня терминального отдела общего желчного протока или большого сосочка двенадцатиперстной кишки. При окклюзии камнем терминального отдела общего желчного протока возникает желчная гипертензня, что клинически выражается тупыми болями в правом подреберье и желтухой. При дальнейшем повышении давления во внепеченочных желчных протоках просвет последних расширяется и конкремент как бы всплывает в проксимальные отделы зоны общего печеночного и общего желчного протоков, желтуха уменьшается и может вовсе исчезнуть.
Холангит — острое или хроническое бактериальное воспаление внутри- и внепеченочных желчных путей. Возникает чаще всего при холедохолитиазе, а также при других заболеваниях, сопровождающихся механической желтухой, за счет холестаза и имеющейся в желчи инфекции. По характеру морфологических изменений в стенках желчных протоков выделяют катаральный и гнойный холангит, по клиническому течению — острый и хронический.
Клинически острый холангит характеризуется внезапным повышением температуры тела до фебрильных цифр, потрясающим ознобом, тяжестью и тупыми болями в правом подреберье, тошнотой и рвотой. При остром гнрйном холангите боли имеют интенсивный характер, рано появляется желтуха, которая связана с поражением печеночной паренхимы, а также с холестазом. Желтуха, потрясающие ознобы, высокая температура тела — грозные предвестники септического состояния с последующей централизацией кровообращения, развитием септического шока и печеночно-почечной недостаточности. При фи-зикальном исследовании больных отмечают болезненность в правом подреберье, умеренно выраженную мышечную защиту (при гнойном холангите). Симптомы раздражения брюшины при этом отрицательны. У большинства больных можно прощупать нижний край увеличенной болезненной печени. При прогрессирующем бурном течении гнойного холангита образуются мелкие гнойники в стенках желчных протоков, в толще паренхимы печени и на ее поверхности, что приводит к образованию множественных холангиогенных абсцессов печени, абсцессов в поддиафрагмальном или в подпеченочном пространстве. Прогноз в таких случаях неблагоприятный.
Хронический склерозирующий холангит — хроническое воспаление желчных путей, сопровождающееся утолщением и склерозом их стенок, которое приводит к обструкции протоков. В большинстве случаев это генерализованный процесс, захватывающий все желчные пути. Различают вторичный склерозирующий холангит, возникающий на фоне желчнокаменной болезни, после хирургических манипуляций и цирроза печени, и первичный, этиология которого неизвестна. Дискутируется возможность аутоиммунного генеза его, связи с язвенным неспецифическим колитом, струмой Рид ел я.
Клинически заболевание проявляется безболевой обтурационной желтухой. Диагноз нередко становится ясным после исключения рака желчных путей. Результаты как оперативного, так и консервативного лечения неудовлетворительные. При консервативном лечении применяют стероидные гормоны, иммунодепрессанты, антибиотики. При оперативном лечении, когда позволяют анатомические условия, накладывают билиодигестивные анастомозы, в отдельных случаях производят трансплантацию печени.
При ущемлении конкремента в ампуле большого сосочка двенадцатиперстной кишки наряду с нарушением оттока желчи и обтурационной желтухой происходит нарушение оттока панкреатического сока, часто развивается острый или хронический панкреатит.
Рубцовые стриктуры большого сосочка двенадцатиперстной кишки и терминального отдела общего желчного протока возникают при повреждении слизистой оболочки сосочка конкрементами, воспалительным процессом. Стриктуры могут быть ограниченными по протяженности от нескольких миллиметров до 1,0—1,5 см и тубулярными, при которых концентрическое сужение терминального отдела общего желчного протока возникает на протяжении 2,0—2,5 см и более. Такое условное подразделение стриктур удобно в плане выбора оптимального способа коррекции этого осложнения во время операции.
Рубцовые стриктуры, как правило, не имеют патогномоничных клинических симптомов. При выраженном стенозе терминального отдела общего желчного протока с нарушением пассажа желчи и панкреатического сока появляются симптомы холецистопанкреатита, острого или хронического панкреатита, обтурационной желтухи, холан-гита. Нередко стриктуры сочетаются с холедохолитиазом.
Внутренние билиодигестивные свищи. Возникают при длительном нахождении камней (особенно крупных) в желчном пузыре и образовании вследствие этого пролежня его стенки и близлежащего полого органа, тесно спаянного с пузырем за счет перихолецистита. Наиболее часто формирование свищей происходит между желчным пузырем и двенадцатиперстной кишкой или печеночным изгибом толстой кишки. Значительно реже формируются свищи между желчным пузырем и желудком или между желчным пузырем и зоной общего печеночного и общего желчного протоков.
Клинические проявления внутренних билиодигестивных свищей скудные, поэтому поставить диагноз до операции удается далеко не у всех больных. Известны случаи развития острой обтурационной непроходимости кишечника, вызванной крупным конкрементом, мигрировавшим в просвет кишечника. Конкременты меньших размеров свободно проходят по кишке и выходят вместе с калом, что может быть обнаружено самим пациентом. При забросе инфицированного кишечного содержимого в просвет желчного пузыря и желчных протоков возникают симптомы холангита. При холецисто-холедохеальном свище происходит миграция конкрементов из желчного пузыря в просвет общего желчного протока с развитием симптомов холедохолитиаза. При формировании свища из краев соустья возникает кровотечение, проявляющееся меленой.
Обзорная рентгенография органов брюшной полости у больных с пузырно-дуоденальным или пузырно-толстокишечными свищами позволяет выявить аэрохолию (наличие газа в желчном пузыре или желчных протоках).
В связи с тесной морфофункциональной взаимосвязью между желчным пузырем, желчными протоками и поджелудочной железой, а также различными патологическими состояниями, затрудняющими отток панкреатического сока (холедохолитиаз, стриктура большого сосочка двенадцатиперстной кишки, холангит и т. п.), к изменениям в желчных путях присоединяются изменения в поджелудочной железе, что клинически проявляется холецистопанкреатитом. При этом наряду с симптомами, характерными для холецистита и его осложнений, появляются клинические признаки хронического, реже острого панкреатита. Этим симптомам следует уделять пристальное внимание, чтобы в дооперационном периоде обследования больного или во время операции выявить причину, вызвавшую развитие панкреатита, и ее устранить.
Водянка желчного пузыря развивается при небольшой вирулентности микробной флоры желчи и окклюзии шейки желчного пузыря или пузырного протока конкрементом. В желчном пузыре происходит всасывание составных частей желчи, бактерии погибают, содержимое желчного пузыря становится бесцветным, приобретает слизистый характер. При физикальном исследовании больных можно пропальпи-ровать дно увеличенного, растянутого, безболезненного желчного пузыря. При наличии вирулентной инфекции стенки желчного пузыря утолщаются, а в просвете его формируется гной. В таких случаях поражение желчного пузыря расценивается как хроническая эмпиема его.
Основным способом диагностики желчнокаменной болезни и ее осложнений является ультразвуковое исследование. При этом в просвете желчного пузыря определяют плотные эхоструктуры, перемещающиеся при изменении положения тела (рис. 121). Достоверность данного метода исследования достигает 96—98%. Информативность ультразвукового исследования в диагностике холедохолитиаза значительно ниже. -
Информативность холецистохолангиографии в диагностике холели-тиаза составляет 70—85%, при этом наиболее полная информация может быть получена при инфузионной методике внутривенного введения контрастного вещества. Прямым признаком холедохолитиаза является наличие дефектов наполнения на фоне контрастированного желчного пузыря (рис. 122). Холедохолитиаз с помощью указанных методов исследования диагностируется не более чем у половины больных с этим осложнением желчнокаменной болезни. При повышении уровня билирубина в крови свыше 0,02—0,03 г/л резко нарушается
функциональное состояние гепа-тоцитов, поэтому указанные методы холецистохолангиографии неприменимы.
Наиболее информативными способами диагностики холедохолитиаза и стриктур терминального отдела общего желчного протока являются ретроградная панкреатохолангиорентге-нография (рис. 123), чрескожная чреспеченочная холангиогра-фия, а также контрастное исследование желчных путей под контролем ультразвукового исследования или лапароскопии.
Единственно возможным способом излечения больного при хроническом калькулезном холецистите является хирургическое лечение. До сих пор не существует лекарственных препаратов, способных вызывать растворение конкрементов в желчном пузыре и желчных протоках. В последнее время в научной литературе появились сведения об успешном растворении мелких холестериновых конкрементов препаратами, синтезированными на основе солей желчных кислот. Недавно появились два новых способа лечения калькулезного холецистита: экстракорпоральная ударно-волновая ли-тотрипсия и лапароскопическая холецистэктомия. Преимущества первого метода заключаются в неоперативном разрушении желчных конкрементов, что особенно важно у лиц пожилого и старческого возраста, и возможности повторного выполнения этой процедуры. Однако далеко не все конкременты поддаются дроблению, а у 10—25% больных приходится выполнять эндоскопическую папиллотомию для удаления их из желчных протоков, куда фрагменты конкрементов попадают из желчного пузыря. Кроме того, повышенная литогенность желчи и измененная стенка желчного пузыря создают условия для повторного образования конкрементов.
Опыт лапароскопической холецистэктомии пока еще невелик, хотя первые результаты ее вполне обнадеживающие. Эта манипуляция неприменима при выраженном спаечном процессе в области желчного пузыря и крупных конкрементах в его просвете.
Показанием к хирургическому лечению калькулезного холецистита, кроме безуспешности и бесперспективности консервативного лечения, является реальная возможность развития осложнений, в том числе рака желчного пузыря, который развивается почти у 5% больных, страдающих калькулезным холециститом.

Рис. 122. Множественные холестериновые камни желчного пузыря. На фоне контрастированного желчного пузыря видны множественные «плавающие» дефекты наполнения. Холецистограмма.

Рис. 123. Холедохолитиаз, стриктура терминального отдела общего желчного протока. Отмечается значительное расширение общего желчного протока, в терминальном его отделе — два дефекта наполнения (камни), контрастное вещество не поступает в двенадцатиперстную кишку, дистальный отдел общего желчного протока резко сужен. Ретроградная панкреатохолангиорентгенограмма.
Основным типом операции при хроническом калькулезном холецистите является холецистэктомия. Желчный пузырь после ориентировки в патологических изменениях выделяют чаще «от шейки» с раздельной перевязкой пузырной артерии и пузырного протока. При выраженных воспалительных и Рубцовых процессах в области шейки желчного пузыря и печеночно-двенадцатиперстной связки, когда трудно дифференцировать ее элементы, прибегают к удалению желчного пузыря «от дна». Во всех случаях необходимо субсерозное удаление желчного пузыря с последующей перитонизацией остатками его брюшинного покрова ложа желчного пузыря. Эта мера необходима в качестве профилактики кровотечения и желчеистечения из добавочных желчных ходов в области ложа желчного пузыря.
Во время холецистэктомии, несмотря на предоперационное исследование, должна быть проведена тщательная ревизия внепеченочных желчных протоков в связи с возможностью наличия холедохолитиаза, стриктуры большого сосочка двенадцатиперстной кишки и т.д. Наиболее простым и информативным способом интраоперационного исследования является холангиография. Для этого через культю пузырного протока в общий желчный проток вводят специальную канюлю или полиэтиленовый катетер, через которые вводят контрастное вещество (верографин и т. п.). До операции под туловище больного подкладывают специальный плоский ящик с рентгеновской кассетой. После введения в просвет желчных путей контрастного вещества выполняют снимок с помощью передвижного рентгеновского аппарата (рис. 124). На снимке можно определить диаметр желчного протока (в норме до 8—10 мм), дефекты наполнения, прохождения контрастного вещества в двенадцатиперстную кишку. При холедохолитиазе обнаруживают расширение просвета общего желчного протока, округлые или полигональные дефекты наполнения контрастного вещества в его просвете. При вклинении камня в области ампулы большого сосочка двенадцатиперстной кишки или его рубцовой стриктуре поступление контрастного вещества в двенадцатиперстную кишку затруднено или вовсе отсутствует. Желчные протоки обычно расширены. В этих случаях нельзя ограничиться только холецистэктомией, необходимо вмешательство на внепеченочных желчных путях. При подозрении на нарушение пассажа желчи, симптомами которого являются расширение просвета общего желчного протока, желтуха к моменту операции или в анамнезе, применяют другие интраоперационные способы исследования, например интраоперационную холангиоскопию, при которой прохождение контрастного вещества по желчным путям контролируют на экране рентгеновского аппарата. Этот метод исследования позволяет изучить все фазы прохождения контрастного вещества и четко определить даже мелкие конкременты.
Простым способом диагностики холедохолитиаза является трансиллюминация. Для этого под печеночно-двенадцатиперстную связку помещают источник света и определяют на общем красноватом фоне тканей темные пятна конкрементов. Трансиллюминация не всегда информативна при мелких конкрементах, особенно при локализации их в области терминального отдела общего желчного протока и боль-

итого сосочка двенадцатиперстной кишки. В настоящее время имеются приспособления для интраоперационного ультразвукового сканирования печени, желчных протоков, поджелудочной железы. Этот метод проще и безопаснее, чем рентгенологическое исследование, а по достоверности и полноте информации рн превосходит их, так как позволяет визуалировать не только желчные ходы и конкременты, но и рядом расположенные сосуды, кисты, опухоли и т. п.
При серьезных подозрениях на холедохолитиаз выполняют диагностическую супрадуоденальную холедохотомию на протяжении 1—1,5 см. Иногда не определяемые пальпаторно до холедохо-томии конкременты общего желчного протока хорошо ощущаются на зонде, введенном в его просвет. С помощью специального набора зондов Дольотти различного диаметра можно установить проходимость терминального отдела общего- желчного протока и большого сосочка двенадцатиперстной кишки. Свободное прохождение зонда №4—5 (номер зонда соответствует диаметру его сливы в миллиметрах) подтверждает отсутствие стриктуры терминального отдела общего желчного протока.
Наибольшая степень достоверности выявления конкрементов зоны общего печеночного и общего желчного протоков может быть достигнута при фиброхоледохоскопии. Для этого через холедохотомическое отверстие вводят специальный гибкий оптический прибор — фибро-холедохоскоп и осматривают просвет желчевыводящих путей на фоне введения в их просвет стерильного изотонического раствора хлорида натрия. С помощью этого прибора можно осмотреть правый и левый печеночный протоки, общий печеночный и общий желчный протоки, включая и большой сосочек двенадцатиперстной кишки. Кроме конкрементов и стриктур общего желчного протока, можно выявить макроскопические признаки холангита: гиперемию, отечность, фибринозные налеты или изъязвления слизистой оболочки протоков в зависи-
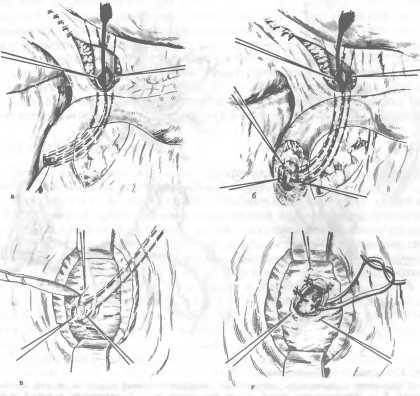
Рис. 125. Папиллосфинктеропластика
а
— холедохотомия, введение зонда в
просеет общего желчного протока; б —
рассечение передней стенки вертикальной
ветви двенадцатиперстной кишки над
большим сосочком двенадцатиперстной
кишки; в — рассечение верхней стенки
большого сосочка двенадцатиперстной
кишки; г — сшивание слизистых оболочек
общего желчного протока
и двенадцатиперстной кишки.
мости от характера воспалительных изменений (катаральный, гнойный холангит).
При холедохолитиазе производят супрадуоденальную холедохото-мию, удаление конкрементов специальными щипчиками, окончатыми зажимами или зондом Фогарти. После их удаления производят хо-лангиографию, холангиоскопию или холедохоскопию для выявления неудаленных конкрементов. Если хирург уверен, что все конкременты удалены, проходимость желчных путей сохранена и отсутствует холангит, то оперативное пособие можно завершить «глухим» швом общего желчного протока. Однако при этом сохраняется возможность подтекания желчи между швами. Поэтому более целесообразно операцию закончить временным дренированием общего желчного протока через культю пузырного протока или через холедохотомическое от-
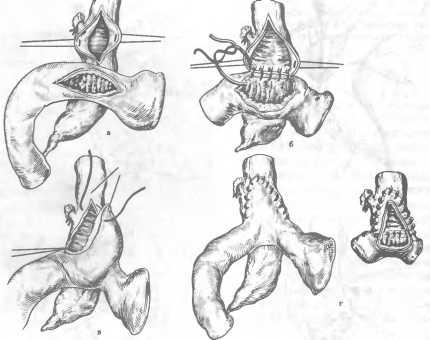
Рис 126. Холедоходуоденостомия
а — рассечение в продельном направлении двенадцатиперстной кишки и общего желчного протока; б — формирование задней «губы* анастомоза, в — формирование передней «губы» анастомоза; г — завершенный вид операции передняя стенка анастомоза частично удалена)'.
верстие Т-образным дренажем. Этот дренаж обеспечивает надежную декомпрессию желчных путей, хорошо фиксируется в просвете общего желчного протока.
Если в просвет большого сосочка двенадцатиперстной кишки вклинен конкремент, то удаление его через холедохотомическое отверстие, как правило, невозможно. В этом случае прибегают к дуоденотомии и рассечению большого сосочка двенадцатиперстной кишки, что позволяет извлечь конкремент. Вклинение его часто сочетается со стриктурой сосочка и терминального отдела общего желчного протока. При небольших ограниченных стриктурах оптимальной операцией является папиллосфинктеротомия с папиллосфинктеропластикой. Для этого большой сосочек двенадцатиперстной кишки рассекают по его верхнему контуру (во избежание повреждения протока поджелудочной железы) на протяжении 0,8—1,5 см. Затем отдельными швами сшивают слизистую оболочку передней стенки общего желчного протока со слизистой оболочкой задней стенки двенадцатиперстной кишки (рис. 125). При протяженных тубулярных стриктурах терминального отдела общего желчного протока папиллосфинктеротомия невыполнима, поэтому
для обеспечения адекватного оттока желчи накладывают супрадуоде-нальный холедоходуоденоанастомоз (рис. 126). Эта операция менее физиологична, чем папиллосфинктеропластика, так как ниже анастомоза образуется «слепой мешок», в котором застаиваются желчь, пища, слизь, что может привести к развитию камней и холангита. Вследствие неустраненного препятствия оттоку панкреатического сока сохраняются или появляются симптомы хронического панкреатита. В этих случаях сочетание холедоходуоденостомии и папиллосфинктеропластики позволяет значительно улучшить функциональные результаты операции.
ОСТРЫЙ ХОЛЕЦИСТИТ
Острое воспаление желчного пузыря является одним из наиболее частых осложнений желчнокаменной болезни.
Этиология и патогенез. Заболевание возникает примерно у 25% больных хроническим калькулезным холециститом. Однако у 5—10% больных острым холециститом конкременты в желчном пузыре не определяются. Основными причинами развития острого холецистита служат микрофлора в просвете пузыря, нарушение оттока желчи (чаще всего за счет блокады шейки или пузырного протока конкрементом), растяжение стенок пузыря и связанная с этим ишемия его стенки. В желчный пузырь микрофлора попадает восходящим путем из двенадцатиперстной кишки, нисходящим путем с током желчи из печени, куда инфекция попадает с током крови, реже — лимфогенным и гематогенным путями.
У подавляющего большинства больных хроническим калькулезным холециститом желчь содержит микрофлору. Однако острый воспалительный процесс возникает лишь при нарушении оттока желчи. Второстепенное значение имеют ишемия стенки пузыря и повреждающее действие панкреатического сока, поджелудочной железы на слизистую оболочку пузыря при панкреатобилиарном рефлюксе.
Клиническая картина и диагностика. Различают следующие клинико-морфологические формы острого холецистита: катаральный, флегмонозный и гангренозный (с перфорацией желчного пузыря или без нее) холецистит.
Катаральный холецистит характеризуют интенсивные постоянные боли в правом подреберье, эпигастральной области с иррадиацией в поясничную область, правую лопатку, плечо, правую половину шеи. В начале заболевания боли могут носить приступообразный характер за счет усиленного сокращения стенки желчного пузыря, направленного на ликвидацию окклюзии шейки пузыря или пузырного протока. Часто возникает рвота желудочным, а затем дуоденальным содержимым, не приносящая пациенту облегчения. Температура тела повышается до субфебрильных цифр. Развивается умеренная тахикардия до 100 ударов в 1 мин, иногда некоторое повышение артериального давления. Язык влажный, может быть обложен беловатым налетом. Живот участвует в акте дыхания, отмечается некоторое отставание верхних отделов правой половины брюшной стенки в акте дыхания. При пальпации живота возникает резкая болезненность в правом подреберье, особенно в области проекции желчного пузыря. Напряжение мышц брюшной стенки отсутствует или выражено незначительно. Положительные симптомы Ортнера, Мерфи, Георгиевского—Мюсси. У 20% больных можно прощупать увеличенный, умеренно болезненный желчный пузырь. В анализе крови отмечают умеренный лейкоцитоз (10—12X10 /л).
Катаральный холецистит, как и печеночную колику, у большинства больных провоцируют погрешности в диете. В отличие от колики приступ острого катарального холецистита более продолжителен (до нескольких суток) и сопровождается неспецифическими симптомами воспалительного процесса (гипертермия, лейкоцитоз, увеличение СОЭ).
Флегмонозн ый холецистит имеет более выраженную клиническую симптоматику. Боли значительно интенсивнее, чем при катаральной форме воспаления. Они усиливаются при дыхании, кашле, перемене положения тела. Чаще возникают тошнота и многократная рвота, ухудшается общее состояние больного, температура тела достигает фебрильных цифр, тахикардия возрастает до 110—120 ударов в 1 мин. Живот несколько вздут за счет пареза кишечника, при дыхании больной щадит правую половину брюшной стенки, кишечные шумы ослаблены. При пальпации возникает резкая болезненность в правом подреберье, выражена мышечная зашита; нередко можно определить воспалительный инфильтрат или увеличенный болезненный желчный пузырь. Определяют положительный симптом Щеткина—Блюмберга в правом верхнем квадранте живота. Симптомы Ортнера, Мерфи, Георгиевского—Мюсси также положительные. В анализе крови выявляют лейкоцитоз до 18—22X10 /л со сдвигом формулы влево, увеличение СОЭ.
Отличительным признаком флегмонозного процесса является переход воспаления на париетальную брюшину. Желчный пузырь при этом увеличен в размерах, стенка его утолщена, багрово-синюшного цвета; на покрывающей его брюшине имеется фибринозный налет, в просвете — гнойный экссудат. Если при катаральной форме острого холецистита при микроскопическом исследовании отмечают лишь начальные признаки воспаления (отек стенки пузыря, гиперемия), то при флегмонозном холецистите выявляют выраженную инфильтрацию стенки пузыря лейкоцитами, пропитывание гнойным экссудатом, иногда с образованием гнойников.
Гангренозный холецистит характеризуется бурным клиническим течением, обычно является продолжением флегмонозной стадии воспаления, когда защитные силы организма не в состоянии справиться с вирулентной микрофлорой. На первый план выступают симптомы выраженной интоксикации с явлениями местного или общего гнойного перитонита, что особенно выражено при перфорации стенки желчного пузыря. Гангренозную форму воспаления наблюдают чаще у людей пожилого и старческого возраста со сниженными регенеративными способностями тканей, снижением реактивности организма и нарушением кровоснабжения стенки желчного пузыря за счет атеросклеро-тического поражения абдоминальной части аорты и ее ветвей. При переходе воспалительного процесса в гангренозную форму может быть некоторое уменьшение болевых ощущении и кажущееся улучшение общего состояния больного, что связано с гибелью чувствительных нервных волокон в желчном пузыре. Однако довольно быстро этот период мнимого благополучия сменяют нарастающая интоксикация и симптомы распространенного перитонита. Состояние больных тяжелое, они вялы, заторможены. Температура тела фебрильная, развивается выраженная тахикардия (до 120 ударов в 1 мин и более). Дыхание становится учащенным и поверхностным. Язык сухой; живот вздут за счет пареза кишечника, правые его отделы не участвуют в акте дыхания, перистальтика резко угнетена, а при общем перитоните отсутствует. Выражено защитное напряжение мышц передней брюшной стенки, выявляются симптомы раздражения брюшины. Перкуторно иногда определяют притупление звука над правым латеральным каналом живота. В анализах крови и мочи высокий лейкоцитоз с резким сдвигом лейкоцитарной формулы влево, ускорение СОЭ, нарушение электролитного состава крови и кислотно-основного состояния, проте-инурия, цилиндрурия (признаки деструктивного воспаления и тяжелой интоксикации).
Острый холецистит у лиц пожилого и особенно старческого возраста со снижением общей реактивности организма и наличием сопутствующих заболеваний имеет стертое течение. Гангренозный холецистит чаще всего развивается именно у этой категории лиц. У стариков нередко отсутствуют интенсивные болевые ощущения, защитное напряжение мышц передней брюшной стенки стерто, нет высокого лейкоцитоза. В связи с этим у больных старческого возраста могут возникать довольно серьезные затруднения в диагностике острого холецистита, оценке состояния и выборе метода лечения.
В типичных случаях диагностика острого холецистита не представляет серьезных проблем. Вместе с тем сходная клиническая картина может возникать при остром аппендиците, остром панкреатите, перфоративной язве желудка и двенадцатиперстной кишки, почечной колике и некоторых других заболеваниях органов брюшной полости.
Среди инструментальных способов диагностики острого холецистита ведущая роль принадлежит ультразвуковому исследованию. При этом можно определить утолщение стенки желчного пузыря, конкременты в его просвете, экссудат в подпеченочном пространстве. Из инвазивных методов исследования большое распространение получила лапароскопия, позволяющая визуально оценить характер морфологических изменений в желчном пузыре. Оба эти способа могут быть использованы и в качестве лечебных процедур в сочетании с пункцией желчного пузыря и его наружным дренированием.
Лечение. Все больные острым холециститом должны находиться в стационаре под постоянным наблюдением хирурга. При наличии симптомов местного или распространенного перитонита показана экстренная операция. В остальных случаях проводят консервативное лечение. Ограничивают прием пищи, разрешая лишь щелочное питье (кислое желудочное содержимое, белки и жиры стимулируют выделение кишечных гормонов, усиливающих моторную деятельность желчного пузыря и секреторную активность поджелудочной железы). Для уменьшения болей применяют ненаркотические анальгетики. Наркотические анальгетики применять не целесообразно, так как за счет выраженного аналгезирующего действия они могут значительно уменьшить болевые ощущения и объективные признаки воспаления (пери-тонеальные симптомы), затруднить диагностику.
Наркотические анальгетики, вызывая спазм сфинктера Одди, способствуют развитию желчной гипертензии и нарушению оттока панкреатического сока, что крайне нежелательно при остром холецистите. Болевые ощущения могут быть уменьшены благодаря применению холинолитических спазмолитических (атропин, платифиллин, барал-гин, но-шпа и т. п.) средств. На область правого подреберья кладут пузырь со льдом для уменьшения кровенаполнения воспалительно измененного органа. Применение теплой грелки абсолютно недопустимо, так как при этом значительно увеличивается кровенаполнение желчного пузыря, что ведет к дальнейшему прогрессированню воспалительного процесса с развитием деструктивных изменений. Для подавления активности микрофлоры назначают антибиотики широкого спектра действия, за исключением препаратов тетради клинового ряда, обладающих гепатотоксическими свойствами. Для дезинтоксикации и парентерального питания назначают инфузионную терапию в общем объеме не менее 2,0—2,5 л растворов в сутки. На фоне лечения за больным проводят постоянное наблюдение. Учитывают субъективные ощущения, объективные симптомы болезни. Целесообразно вести индивидуальную карту наблюдения, в которой отмечают через каждые 4—6 ч частоту пульса, величину артериального давления, температуру тела, количество лейкоцитов в крови. Это существенно облегчает наблюдение за больным, позволяет оценить эффективность проводимого лечения, судить о течении воспалительного процесса.
При остром холецистопанкреатите комплекс лекарственной терапии должен включать также препараты, применяемые для лечения острого панкреатита.
У большинства пациентов возможно купирование приступа острого холецистита. В процессе наблюдения и лечения необходимо обследовать больного. Для выявления конкрементов в желчном пузыре целесообразно произвести УЗИ. При их обнаружении и отсутствии противопоказаний (тяжелые заболевания жизненно важных органов) больного целесообразно оперировать в плановом порядке через 24—72 ч или через 2—3 нед после стихания острого приступа.
Если на фоне проводимого лечения острого холецистита в течение 48—72 ч состояние больного не улучшается, сохраняются или усиливаются боли в животе и защитное напряжение брюшной стенки, учащается пульс, сохраняется на высоком уровне или поднимается температура, увеличивается лейкоцитоз, то показано срочное хирургическое вмешательство для предупреждения перитонита и других тяжелых осложнений.
В последние годы успешно применяют пункции и наружное дренирование желчного пузыря для лечения острого холецистита у больных с повышенным операционным риском. Под контролем лапароскопа или ультразвукового исследования пунктируют желчный пузырь, через ткань печени эвакуируют его инфицированное содержимое (желчь, гной), после чего в просвете пузыря устанавливают гибкий пластмассовый катетер для аспирации содержимого и местного введения антибиотиков. Это позволяет остановить прогрессирование воспалительного процесса, в том числе развитие деструктивных изменений в стенке желчного пузыря, быстро достичь положительного клинического эффекта, избежать вынужденных, рискованных для больного оперативных вмешательств на высоте острого холецистита и без надлежащей предоперационной подготовки. Данная методика целесообразна у лиц пожилого и старческого возраста с чрезвычайно высоким операционным риском.
Ситуация значительно усложняется при развитии обтурационной желтухи на фоне острого холецистита. Это осложнение грозит больному холангитом, повреждением гепатоцитов, дальнейшим усугублением интоксикации с возможным развитием печеночно-почечной недостаточности. Обтурационная желтуха развивается нередко у лиц пожилого и старческого возраста, компенсаторные возможности организма которых весьма ограничены. Оперативное вмешательство на фоне острого холецистита у таких больных представляет довольно большой риск. В этой ситуации довольно перспективным направлением является срочная эндоскопическая папиллотомия. Через био-псийиый канал дуоденоскопа вводят тонкую канюлю в большой сосочек двенадцатиперстной кишки, после чего с помощью специального папиллотома рассекают его верхнюю стенку. При этом конкременты из протоков либо отходят самостоятельно, либо их удаляют специальными щипчиками, с помощью петли (корзинки) Дормиа или зонда Фогартн. Такая манипуляция позволяет ликвидировать желчную и панкреатическую гипертензию, уменьшить желтуху и интоксикацию. В последующем выполняют операцию на желчном пузыре в плановом порядке.
Холецистэктомия — основное оперативное вмешательство, выполняемое при остром холецистите. Удаление желчного пузыря может представлять значительные трудности в связи с выраженными воспалительными изменениями в нем и окружающих его тканях. Поэтому рекомендуют удалять пузырь «от дна». Холецистэктомия должна быть дополнена интраоперационным исследованием внепеченочных желчных протоков (холангиографией). При обнаружении холедохолитиаза или стеноза терминального отдела общего желчного протока производят те же манипуляции, которые принято делать в аналогичных случаях при плановых операциях у больных хроническим калькулезным холециститом (холедохотомия, Т-образный дренаж и др.). В брюшной полости оставляют дренаж для контроля за крово-и желчеистечением.
Холецистостомия с удалением конкрементов и инфицированного содержимого желчного пузыря показана в редких случаях в качестве вынужденной меры при общем тяжелом состоянии пациента и массивном воспалительном инфильтрате вокруг желчного пузыря, особенно у лиц пожилого и старческого возраста. Эта операция позволяет лишь ликвидировать острые воспалительные изменения в стенке желчного пузыря. В отдаленные сроки после операции, как правило, в желчном пузыре вновь образуются конкременты и больных приходится оперировать повторно.
Летальность после холецистэктомии, выполненной по поводу острого холецистита, составляет 6—8%, достигая у лиц пожилого и старческого возраста 15—20%.
БЕСКАМЕННЫЙ ХОЛЕЦИСТИТ
Выделяют острый и хронический бескаменный холецистит.
Острый бес каменный холецистит. Этиология его связана с бактериальной инфекцией, повреждающим действием панкреатического сока на слизистую оболочку желчного пузыря при рефлюксе его из протока поджелудочной железы в желчные протоки и желчный пузырь, с различными препятствиями оттоку желчи из желчного пузыря (длинный извитой пузырный проток, спазм сфинктера Люткенса и т. п.). Клинические проявления острого бескаменного холецистита аналогичны таковым при остром калькулезном холецистите, так же как и степень морфологических изменений в стенке желчного пузыря (катаральный, флегмонозный, гангренозный холецистит). В диагностике и выборе способа лечения больного решающее значение принадлежит данным объективного обследования пациента, динамике клинической картины болезни на фоне проводимого лечения. При деструктивных формах холецистита выполняют срочное оперативное лечение — хо-лецистэктомию с интраоперационным исследованием проходимости желчных протоков (холангиография). Необходимость интраопераци-онной холангиографии диктуется тем, что при бескаменном холецистите иногда можно обнаружить мелкие конкременты в желчных протоках, рубцовый стеноз большого сосочка двенадцатиперстной кишки. Довольно часто острый бескаменный холецистит сочетается с воспалительными изменениями в поджелудочной железе (холецистопанк-реатит). Увеличенная головка поджелудочной железы может сдавливать терминальный отдел общего желчного протока, вызывая желчную гипертензию. В этих случаях во время операции необходимо дренировать желчные пути.
Хронический бескаменный холецистит. Клиническая картина бескаменного хронического холецистита сходна с таковой при хроническом калькулезном холецистите. Однако боли в правом подреберье не столь интенсивны, но отличаются длительностью, почти постоянным характером, усилением после погрешности в диете. Для диагностики наиболее информативными являются ультразвуковое исследование и холецистохолангиография. Сходную клиническую картину могут давать многие заболевания других органов пищеварительной системы — гастрит, язвенная болезнь, грыжи пищеводного отверстия диафрагмы, хронический колит и т. п. Поэтому при подозрении на хронический бескаменный холецистит необходимо тщательное разностороннее обследование больного. При длительном упорном течении хронического бескаменного холецистита, при неэффективности консервативного лечения показана холецистэктомия.
ПОСТХОЛЕЦИСТЭКТОМИЧЕСКИЙ СИНДРОМ
У большинства больных желчнокаменной болезнью оперативное лечение приводит к выздоровлению и полному восстановлению трудоспособности. Иногда у пациентов сохраняются некоторые симптомы болезни, бывшие у них до операции, или появляются новые жалобы. Причины этого весьма разнообразны, тем не менее данное состояние больных, перенесших холецистэктомию, объединяют собирательным понятием постхолецистэктомический синдром. Сам термин неудачен, так как далеко не всегда удаление желчного пузыря служит причиной развития болезненного состояния пациента. Основными условиями развития так называемого постхолецистэктомического синдрома служат: 1) болезни органов пищеварительного тракта (хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, грыжи пищеводного отверстия диафрагмы, хронический колит, рефлюкс-эзо-фагит). Эта группа болезней является наиболее частой причиной постхолецистэктомического синдрома; 2) органическое поражение желчных путей: оставленные при холецистэктомии конкременты в желчных протоках (так называемые забытые камни), стриктура большого сосочка двенадцатиперстной кишки или терминального отдела общего желчного протока, длинная культя пузырного протока или даже оставленная часть желчного пузыря, где вновь могут образовываться конкременты, ятрогенные повреждения общего печеночного и общего желчного протоков с последующим развитием рубцовой стриктуры. Эта группа причин связана как с дефектами оперативной техники, так и с недостаточным интраоперационным исследованием проходимости желчных протоков; 3) заболевания органов гепатопанкреатоду-оденальной зоны: хронический гепатит, панкреатит, дискинезия желчных протоков, перихоледохеальный лимфаденит. Лишь причины второй группы можно прямо или косвенно поставить в связи с выполненной ранее холецистэктомией, другие причины связаны с дефектами до-операционного обследования больных и своевременно не диагностированными заболеваниями системы органов пищеварения.
В выявлении причин, приведших к развитию постхолецистэктомического синдрома, помогают тщательно собранный анамнез заболевания, данные инструментальных методов исследования органов пищеварительной системы. При исследовании состояния внепеченочных желчных протоков наиболее информативны ретроградная панкреато-холангиография, чрескожная чреспеченочная холангиография (при обтурационной желтухе), ультразвуковое исследование и компьютерная томография.
При выявлении органических поражений желчных протоков больным показана повторная операция. Характер ее зависит от конкретной причины, вызвавшей постхолецистэктомический синдром. Как правило, повторные операции на желчных путях сложны и травматичны, требуют высокой квалификации хирурга. При длинной культе пузырного протока или оставлении части желчного пузыря производят их удаление, в случае холедохолитиаза и стеноза большого сосочка двенадцатиперстной кишки выполняют те же операции, что и при осложненном холецистите. Протяженные посттравматические стриктуры внепеченочных желчных путей требуют наложения билиодигестивных анастомозов с двенадцатиперстной кишкой или тощей кишкой.
В профилактике постхолецистэктомического синдрома ведущая роль принадлежит тщательному обследованию больных до операции, выявлению сопутствующих заболеваний органов пищеварительной системы и их лечению в до- и послеоперационном периодах с тщательным соблюдением техники оперативного вмешательства и одновременным исследованием состояния внепеченочных желчных путей.
ОПУХОЛИ ЖЕЛЧНОГО ПУЗЫРЯ И ЖЕЛЧНЫХ ПРОТОКОВ
Доброкачественные опухоли желчного пузыря (папилломы, па-пилломатоз, фибромы, миомы, аденомы) не имеют специфической клинической картины, их выявляют при холецистэктомии по поводу калькулезного холецистита или на вскрытии. Эти опухоли нередко сочетаются с желчнокаменной болезнью (особенно папилломы). До операции правильный диагноз можно поставить с помощью холеци-стографии и ультразвукового исследования. В отличие от конкремента опухоль желчного пузыря проявляется в виде дефекта наполнения (при холецистографии) или ультразвуковой структуры, не меняющей своего положения при изменении положения тела больного. Опухоль желчного пузыря является показанием к операции — холецистэктомии, так как нельзя исключить ее злокачественное перерождение.
Рак желчного пузыря занимает 5—6-е место в структуре всех злокачественных опухолей органов пищеварительного тракта. Заболеваемость раком желчного пузыря среди населения развитых стран увеличивается так же, как и заболеваемость желчнокаменной болезнью. Чаще болеют женщины старше 50 лет. В развитии рака желчного пузыря существенная роль принадлежит холелитиазу. Рак желчного пузыря в 80—100% случаев сочетается с желчнокаменной болезнью. По-видимому, частая травматизация и хроническое воспаление слизистой оболочки желчного пузыря являются пусковыми моментами в дисплазии эпителия пузыря. Рак желчного пузыря начинается обычно в области его дна и быстро распространяется на прилежащие органы (печень, поперечная ободочная кишка). Опухоль растет в виде полипов в просвет желчного пузыря (экзофитный рост) или интрамурально (фиброзный, или скирр). В этом случае макроскопически опухоль трудно отличить от хронического фибропластического воспаления. По гистологической структуре наиболее часто встречаются аденокарцинома и фиброзный рак, реже — слизистый, солидный и низкодиффе-ренцированный рак.
Клиническая картина и диагностика. На ранних стадиях развития рак желчного пузыря протекает бессимптомно либо с признаками калькулезного холецистита, что связано с частым сочетанием рака желчного пузыря и желчнокаменной болезни. В более поздних стадиях также не удается выявить патогномоничных симптомов заболевания, и лишь в фазе генерализации ракового процесса наблюдают как общие его признаки (слабость, утомляемость, отсутствие аппетита, похудание, анемия и т. п.), так и местные симптомы (увеличенная бугристая печень, асцит и желтуха).
Холецистография не имеет большой информативности в диагностике рака желчного пузыря, так как и наличие дефекта наполнения, и «отключенный» желчный пузырь могут быть выявлены как при раке желчного пузыря, так и при калькулезном холецистите. Ценная информация может быть получена при использовании ультразвукового исследования, компьютерной томографии. Лапароскопия также позволяет определить размеры опухоли, границы ее распространения, наличие отдаленных метастазов, произвести прицельную биопсию новообразования.
Лечение. Радикальные операции (холецистэктомия) удается выполнить только при раннем раке у незначительного числа больных. К ним относят также холецистэктомию с резекцией прилежащего участка печени (реже объем удаляемой зоны печени расширяют до сегментэктомии или гемигепатэктомии). Во время радикальной операции необходимо удалить лимфатические узлы по ходу печеночно-двенадцатиперстной связки. Отдаленные результаты радикальных операций плохие, большинство оперированных умирают в течение 6 мес, пятилетняя выживаемость отмечается лишь у нескольких процентов больных.
Паллиативные операции выполняют при неоперабельном раке желчного пузыря в сочетании с обтурационной желтухой. Используют нар* <хное дренирование желчных протоков или внутренние билиоди-reci явные анастомозы, однако технически эти операции выполнимы в редких случаях.
Доброкачественные опухоли желчных протоков встречаются нечасто. По гистологическому строению выделяют аденомы, папилломы, миомы, липомы, аденофибромы и др. Характерной клинической картины эти опухоли не имеют. Они проявляются симптомами желчной гипертензии и обтурации желчевыводящих путей. Дооперационная диагностика доброкачественных опухолей чрезвычайно сложна, а дифференциальная диагностика со злокачественными новообразованиями может быть проведена только во время холедохотомии или холедохо-скопии с прицельной биопеней участка опухоли.
Лечение. Опухоль удаляют в пределах здоровых тканей и производят сшивание или пластику протока. Показанием к операции служит реальная возможность малигнизации опухоли, обтурационная желтуха.
Рак желчных протоков встречается редко (0,2—0,5% по данным патологоанатомического исследования). Опухоль может локализоваться в любом отделе внутри- и внепеченочных желчных протоков. Макроскопически выделяют экзофитную форму, когда опухоль растет в просвет протока и довольно быстро вызывает его обтурацию, и эндо-фитную, при которой проток равномерно суживается на протяжении, стенки его становятся плотными, ригидными. Наиболее частыми гистологическими типами рака внепеченочных желчных протоков являются аденокарцинома и фиброзный рак. У 30% больных отмечают сочетание рака желчных протоков с желчнокаменной болезнью. Из особенностей течения рака желчных путей следует отметить его относительно медленный рост и позднее метастазирование в регионарные лимфатические узлы и печень.
Клиническая картина и диагностика. Клинически рак желчных протоков проявляется желтухой (при обтурации просвета протока), ахоличным стулом (при нарушении оттока желчи в двенадцатиперстную кишку). Желтушность кожного покрова при раке желчных протоков появляется без предшествующего болевого приступа в отличие от обтурационной желтухи, вызванной холедохолитиазом. У некоторых больных желтуха носит интермиттирующий характер, что связано с распадом ткани опухоли и временным улучшением проходимости желчных протоков. В желтушной фазе заболевания присоединяются общие симптомы ракового процесса (слабость, апатия, отсутствие аппетита, похудание, анемия и т. п.), нередко развивается холангит, что существенно утяжеляет течение болезни. При локализации опухоли ниже впадения пузырного протока в общий печеночный проток можно пропальпировать увеличенный, напряженный, безболезненный желчный пузырь (симптом Курвуазье). Печень также несколько увеличена, доступна пальпации. При локализации рака в правом или левом печеночном протоке при сохраненной проходимости общего печеночного протока желтуха развивается не всегда, что затрудняет постановку правильного диагноза.
В диагностике рака желчных протоков наиболее информативны ультразвуковое исследование, чрескожная чреспеченочная холангио-графия, ретроградная панкреатохолангиорентгенография, лапароскопическая пункция желчного пузыря с последующей холангиографией. Морфологическое подтверждение диагноза возможно только во время операции после холедохотомии и (или) холедохоскопии с прицельной биопсией опухоли. Особые трудности возникают при инфильтрирующем росте опухоли, когда приходится иссекать часть стенки протока с последующим микроскопическим изучением нескольких срезов.
Лечение. Опухоль иссекают в пределах здоровых тканей и производят сшивание или пластику протока или накладывают билиоди-гестивный анастомоз (с тощей или двенадцатиперстной кишкой). При локализации опухоли в терминальном отделе общего желчного протока единственной радикальной операцией является панкреатодуоденальная резекция (см. «Рак поджелудочной железы»).
Паллиативные операции выполняют в запущенных стадиях заболевания. Они направлены на ликвидацию обтурационной желтухи. Применяют реканалнзацию опухоли на транспеченочном дренаже, наружную холангиостомию, билиодигестивные анастомозы.
Рак большого сосочка двенадцатиперстной кишки наблюдается в 40% случаев злокачественного поражения органов панкреатодуоде-нальной зоны. Опухоль может исходить из эпителия терминального отдела общего желчного протока, дистального отдела протока поджелудочной железы, из слизистой оболочки двенадцатиперстной кишки, покрывающей большой сосочек двенадцатиперстной кишки. Гистологически чаще всего выявляют аденокарциному и фиброзный рак. Рак большого сосочка двенадцатиперстной кишки растет относительно медленно и поздно метастазирует в регионарные лимфатические узлы и отдаленные органы.
Клиническая картина и диагностика. До развития обтурационной желтухи появляются тупые ноющие боли в эпигастральной области и правом подреберье. Позднее на первый план выступают симптомы обтурации желчных путей: желтуха, сопровождающаяся интенсивным кожным зудом, увеличение размеров печени, увеличенный безболезненный желчный пузырь, холангит. В стадии развития желтухи болевые ощущения у большинства больных отсутствуют или выражены незначительно, быстро прогрессируют общие симптомы ракового процесса, интоксикация, кахексия, что связано с нарушением поступления в просвет кишечника желчи и панкреатического сока, необходимых для гидролиза жиров и белков. В связи с нарушением белковосинтетической функции печени возникают холе-мические кровотечения. Нарушается всасывание жирорастворимых витаминов.
Среди инструментальных методов диагностики наибольшее значение имеют релаксационная дуоденография, гастродуоденоскопия, чрес-кожная чреспеченочная холангиография, компьютерная томография.
Лечение. На ранних стадиях болезни, когда размеры опухоли невелики (до 2—2,5 см) и она не прорастает все слои стенки двенадцатиперстной кишки, не инфильтрирует головку поджелудочной железы н не метастазирует в регионарные лимфатические узлы и отдаленные органы, производят папиллэктомию. При этом опухоль иссекают в пределах здоровых тканей вместе с терминальным отделом общего желчного протока, протока поджелудочной железы и прилежащим участком задней стенки двенадцатиперстной кишки. Затем вшивают общий желчный проток и проток поджелудочной железы в заднюю стенку двенадцатиперстной кишки. При инвазии опухоли в окружающие ткани выполняют панкреатодуоденальную резекцию. В запущенных стадиях болезни при общем тяжелом состоянии больных выполняют паллиативные операции — билиодигестивные анастомозы (холецистоеюностомию, холедохоеюностомию).
ЖЕЛТУХА
Желтухой называют окрашивание кожи, слизистых оболочек и склер в желтый цвет вследствие накопления в тканях билирубина. Уровень билирубина в крови при этом также повышен. Желтуха является клиническим синдромом, характерным для ряда заболеваний внутренних органов. В зависимости от причины повышения уровня билирубина в крови выделяют три основных типа желтух.
Гемолитическая (надпеченочная) желтуха возникает в результате интенсивного распада эритроцитов и чрезмерной продукции непрямого билирубина. Эти явления возникают при гиперфункции клеток рети-кулоэндотелиальной системы, прежде всего селезенки, при первичном и вторичном гиперспленическом синдроме. Типичным примером могут служить различные гемолитические анемии (см. «Селезенка»). При этом образование непрямого билирубина столь велико, что печень не успевает превратить его в связанный (прямой) билирубин. Гемолитическая желтуха может быть вызвана также различными веществами, способствующими развитию гемолиза: гемолитические яды, продукты распада обширных гематом, всасывающиеся в кровь.
Печеночная (паренхиматозная) желтуха развивается в результате повреждения гепатоцитов, способность которых связывать непрямой билирубин крови и переводить его в прямой (билирубинглюкуронид) уменьшается. При этом образовавшийся прямой билирубин лишь частично поступает в желчные капилляры, а большая его часть возвращается в кровяное русло. Наиболее частыми причинами печеночной желтухи являются вирусный гепатит, желтушный лептоспироз (болезнь Вейля), цирроз печени, холангит, отравление некоторыми видами ядов (четыреххлористый углерод, тетрахлорэтан, соединения мышьяка, фосфора и т. д.).
Обтурационная механическая, подпеченочная желтуха развивается в результате частичной или полной непроходимости желчновыводящих путей с нарушением пассажа желчи в кишечник. Обтурационная желтуха чаще обусловлена холедохолитиазом, стриктурой протоков, стенозом большого сосочка двенадцатиперстной кишки, опухолью головки поджелудочной железы и желчевыводящих путей.
Дифференциальная диагностика. На практике легче всего поставить диагноз гемолитической желтухи. При дифференциальной диагностике печеночной и обтурационной желтух возникают довольно значительные сложности.
При гемолитической желтухе кожный покров приобретает лимон-но-желтую умеренно выраженную окраску, кожного зуда нет. При анемии можно определить некоторую бледность кожных покровов и слизистых оболочек на фоне имеющейся желтухи. Печень нормальных размеров или несколько увеличена; селезенка умеренно увеличена. При некоторых видах вторичного гиперспленического синдрома (см. «Селезенка») иногда выявляют выраженную спленомегалию. Моча имеет темный цвет за счет повышенной концентрации уробилиногена и стеркобилиногена. Реакция мочи на билирубин отрицательная. Кал интенсивно окрашен в темно-бурый цвет, концентрация стеркобилина в нем резко повышена.
В анализах крови выявляют повышение уровня непрямого билирубина, при этом концентрация прямого билирубина не повышена; отмечают умеренно выраженную анемию, ретикулоцитоз, несколько увеличенную СОЭ. Печеночные пробы, холестерин крови в пределах нормы. Уровень сывороточного железа крови повышен.
При печеночной желтухе кожные покровы имеют шафраново-желтый с рубиновым оттенком цвет. Кожный зуд выражен незначительно. Такой характер желтухи отмечают только на ранних стадиях ее развития, а спустя 3—4 нед и более окраска кожных покровов приобретает желтовато-зеленый оттенок вследствие накопления в тканях биливер-дина. Печень увеличена и уплотнена, болезненна при пальпации (при вирусном гепатите, холангите), в некоторых случаях (при циррозе печени) она может быть уменьшенной и безболезненной при пальпа-
ции. Селезенка у большинства больных доступна пальпации. Обнаружение увеличенной селезенки почти наверняка позволяет исключить обтурационный характер желтухи. Нередко при печеночной желтухе, обусловленной циррозом печени, появляются симптомы портальной гипертензии (варикозное расширение вен пищевода, геморроидальные кровотечения, расширение подкожных вен передней брюшной стенки). Цвет кала несколько светлее, чем в норме. При желтухе, обусловленной холастатическим гепатитом, кал ахоличен; моча приобретает темно-бурую окраску.
В анализах крови определяют увеличение СОЭ, повышение уровня прямого и непрямого билирубина, нормальное содержание холестерина. Уровень железа сыворотки крови в норме или несколько повышен, концентрация протромбина снижена. Уровень трансаминаз крови повышен, особенно сильно — при печеночной желтухе, обусловленной вирусным гепатитом. Важной отличительной особенностью печеночной желтухи является значительное повышение уровня фруктозобисфос-фат-альдолазы крови (до 10—12 БД), в то время как при обтурационной желтухе этот показатель повышен незначительно. Щелочная фосфа-таза крови также повышена, особенно при вирусном гепатите.
В моче реакция на уробилин и уробилиноген резко повышена. Билирубинурия имеет перемежающийся характер. При тяжелом поражении печеночной паренхимы билирубинурии нет. Функциональные пробы печени имеют важное дифференциально-диагностическое значение только на ранних стадиях развития желтухи. При обтурационной желтухе длительностью более 4 нед за счет вторичного повреждения гепатоцитов функциональные пробы изменяются, так же как и при печеночной желтухе.
При обтурационной желтухе кожные покровы приобретают желтовато-зеленую окраску, а при обтурирующих желчевыводящие пути опухолях — характерный землистый оттенок. В случае длительного существования обтурационной желтухи кожные покровы приобретают черновато-бронзовую окраску.
При обтурационной желтухе, обусловленной желчнокаменной болезнью, в начале заболевания появляются характерные приступообразные боли по типу печеночной колики, иногда желтуха появляется на фоне острого холецистита. При опухолях панкреатодуоденальной зоны желтуха появляется без предшествующих болевых ощущений. Кожный зуд особенно выражен при желтухе, вызванной опухолью, при очень высоком уровне билирубинемии. Печень в большинстве случаев не увеличена или увеличена незначительно. У половины больных с опухолями панкреатодуоденальной зоны выявляют положительный симптом Курвуазье. Селезенка при обтурационной желтухе не увеличена, не пальпируется, периферические лимфатические узлы также не увеличены. Испражнения имеют светлую окраску, а при полной непроходимости желчных путей (чаще вызванной опухолью) — ахоличные. Моча приобретает темную окраску цвета пива.
В анализах крови отмечают увеличение СОЭ, лейкоцитоз (при остром холецистите в сочетании с холедохолитиазом). Концентрация прямого и непрямого билирубина в крови резко повышена, особенно при обтурирующих опухолях панкреатодуоденальной зоны. При хо-ледохолитиазе, особенно при так называемых вентильных конкрементах, билирубинемия носит ремиттирующий характер, билирубинурия и уробилинурия имеют перемежающийся характер. При опухолях, вызывающих полную непроходимость желчевыводящих путей, уробилинурия отсутствует при сохраненной билирубинурии. Уровень холестерина в крови повышен, концентрация сывороточного железа в норме или даже несколько снижена. Трансаминазы крови умеренно увеличены, а при длительной желтухе могут возрастать. Значительно повышается уровень щелочной фосфатазы, особенно выражено повышение этого фермента при желтухах опухолевой природы. Фруктозобис-фосфат-альдолаза повышена незначительно, концентрация протромбина в крови снижена.
Особенности клинического течения того или иного вида желтухи обусловлены характером заболевания, вызвавшего желтуху. Этот факт создает дополнительные трудности в дифференциальной диагностике желтух. Кроме перечисленных выше клинических и лабораторных методов, важную роль в диагностике желтух играют рентгенологические (в том числе и ангиографические), эндоскопические, радиологические, ультразвуковые методы исследования и компьютерная томография. Они позволяют получить ценную информацию, необходимую для дифференциальной диагностики различных видов желтух.
В клинической практике хирург чаще всего имеет дело с обтурационной желтухой, реже — с печеночной, вызванной холестатическим гепатитом, холангитом.
Лечение. В предоперационном периоде во время обследования больного необходимо проводить комплекс мероприятий, направленных на нормализацию нарушенных функций организма, ликвидацию хо-лангита, геморрагических расстройств, обусловленных нарушениями свертывающей и противосвертывающей систем крови. Тщательная предоперационная подготовка больных с желтухой позволяет выполнить оперативное вмешательство в более безопасных условиях, уменьшить частоту послеоперационных осложнений.
Обтурационная желтуха является абсолютным показанием к операции. Выжидание очень опасно, так как приводит к глубокому поражению паренхимы печени и нарушению ее функций, ухудшению прогноза после операции вследствие развития инфекции (гнойный холангит) и возможности появления кровотечения, обусловленного недостатком резорбции витамина К. Срочные показания к операции возникают при гнойном холангите. Даже при ранних хирургических вмешательствах летальность достигает 5—15% и более.
Операции, применяемые при обтурационной желтухе, разнообразны и зависят от причины и уровня препятствия для оттока желчи.
Холедохотомия с дренированием протока показана при желтухе, вызванной холедохолитиазом. При забытых конкрементах в холедохе чаще прибегают к их эндоскопическому ретроградному удалению. Используют также экстракцию конкрементов через Т-образный дренаж с помощью петли Дормиа, промывание протока через дренаж растворами желчных кислот, гепарина и др.
Трансдуоденальная папиллосфинктеротомия показана при стенози-рующем папиллите, ущемившихся конкрементах в терминальном отделе общего желчного протока. В настоящее время обычно производят эндоскопическую папиллосфинктеротомию для извлечения конкрементов и восстановления проходимости протока.
Билиодигестивные анастомозы формируют для отведения желчи из желчных протоков в тонкую кишку при доброкачественных заболеваниях (стриктуры, трубчатые протяженные стенозы, ранения протоков), при неоперабельных опухолях желчных протоков наложение анастомозов является паллиативным вмешательством.
Холецистоэнтеростомию производят в случае проходимости пузырного протока при неоперабельных опухолях, закрывающих просвет дистальной части общего желчного протока. Дно пузыря соединяют с выключенной по Ру петлей тощей кишки или с двенадцатиперстной кишкой.
Холедохо- или гепатикодуоденостомия показана при опухолях, закрывающих просвет дистального отдела общего желчного протока, Рубцовых стриктурах, трубчатых стенозах его терминального отдела при хроническом панкреатите. При этой операции общий желчный проток или зону общего печеночного и общего желчного протоков соединяют анастомозом с петлей тощей кишки, выключенной по Ру.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Поджелудочная железа и желчные протоки в процессе филогенеза развиваются вместе с двенадцатиперстной кишкой. Это проявляется в их анатомическом и функциональном единстве и взаимозависимости. Часто наблюдается одновременное заболевание этих органов.
Поджелудочная железа расположена забрюшинно на уровне I—II поясничных позвонков, занимая поперечное положение между двенадцатиперстной кишкой и воротами селезенки. Длина ее составляет 15—23 см, ширина 3—9 см, а толщина 2—3 см. Масса железы в среднем 70—90 г (рис. 127).
В поджелудочной железе различают головку, тело и хвост. Головка расположена в петле двенадцатиперстной кишки. Тело поджелудочной железы передней своей поверхностью прилежит к задней поверхности желудка. Эти органы отделены друг от друга узкой щелью — сальниковой сумкой (bursa omentalis). Задняя поверхность тела поджелудочной железы прилежит к полой вене, аорте, нижняя — соприкасается с нижней горизонтальной частью двенадцатиперстной кишки. Позади поджелудочной железы на уровне перехода ее головки в тело проходят верхние мезентериальные сосуды. На уровне верхнего края поджелудочной железы по направлению к ее хвосту проходит селезеночная артерия. Селезеночная вена расположена позади железы. В нее впадает нижнебрыжеечная вена. Соединяясь с верхнебрыжеечной веной, они образуют воротную вену, расположенную позади шейки поджелудочной железы.
Проток поджелудочной железы (вирсунгов проток) образуется из слияния мелких л ольховых протоков. Длина его 9—23 см. Диаметр колеблется от 0,5 до 2 мм в хвостовой части, до 2—8 мм — в области устья. В головке проток поджелудочной железы соединяется с добавочным протоком поджелудочной железы и затем впадает в общий желчный проток, который проходит через головку железы ближе к ее задней поверхности и открывается на вершине большого сосочка двенадцатиперстной кишки. В ряде случаев добавочный проток впадает в двенадцатиперстную кишку самостоятельно, открываясь на небольшом сосочке, расположенном на 2—3 см выше большого сосочка двенадцатиперстной кишки. В 10% случаев добавочный проток берет на себя основную дренажную функцию поджелудочной железы. Взаимоотношения конечных отделов общего желчного протока и протока поджелудочной железы различны. Наиболее часто оба протока впадают в кишку совместно, образуя общую ампулу, которая своей конечной частью
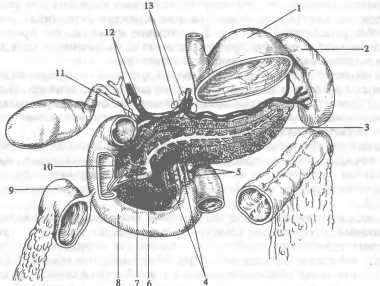
Рис 127. Поджелудочная железа.
I — желудок; 2 — селезенка; 3 — поджелудочная железа; 4 — верхние брыжеечные вена и артерия; 5 — брыжеечные лимфатические узлы; б — проток поджелудочной железы; 7 — добавочный проток поджелудочной железы; 8 — двенадцатиперстная кишка; 9 — толстая кишка; 10 — общий желчный проток; II — верхняя панкреатодуоденальная артерия; 12 — печеночные лимфатические узлы; 13 — парааортальные лимфатические узлы.
открывается на большом сосочке двенадцатиперстной кишки (67%). Иногда общая ампула отсутствует (30%). Общий желчный проток и проток поджелудочной железы могут впадать в двенадцатиперстную кишку раздельно или сливаться друг с другом в ткани поджелудочной железы на значительном расстоянии от большого сосочка двенадцатиперстной кишки (3%).
Кровоснабжение поджелудочной железы осуществляется ветвями панкреатодуоденальной артерии (a. pancreaticoduodenalis), которая снабжает кровью большую часть головки железы; верхняя брыжеечная артерия снабжает головку и тело поджелудочной железы, а селезеночная (a. lienalis) — тело и хвост поджелудочной железы. Вены поджелудочной железы идут совместно с артериями и впадают в верхнюю брыжеечную (v. mesenterlca superior) и селезеночную (a. lienalis) вены, по которым кровь оттекает в воротную вену (v. porta).
Лимфоотток осуществляется в лимфатические узлы, расположенные по верхнему краю поджелудочной железы, в воротах селезенки. Лимфатическая система поджелудочной железы имеет тесную связь с лимфатической системой желудка, кишечника, двенадцатиперстной кишки и желчевыводящих путей.
Иннервация поджелудочной железы осуществляется ветвями чревного, печеночного, селезеночного и верхнебрыжеечного сплетений. Иннервация панкреатических островков (Лангерганса) осуществляется отдельно от иннервации железистых клеток. Имеется тесная связь с иннервацией поджелудочной железы, двенадцатиперстной кишки, печени, желчевыводящих путей и желчного пузыря, что во многом определяет их функциональную взаимозависимость.
Паренхима поджелудочной железы состоит из множества долек, отделенных друг от друга прослойками соединительной ткани. Каждая долька состоит из эпителиальных клеток, образующих ацинусы. За сутки железа выделяет 1000—1500 мл панкреатического сока. Среди паренхиматозных клеток поджелудочной железы имеются особые клетки, которые образуют скопления величиной 0,1—1 мм, называющиеся панкреатическими
островками. Наиболее часто они имеют округлую или овальную форму. Панкреатические островки ие имеют выводных протоков и располагаются непосредственно в паренхиме долек. В и их выделяют четыре типа клеток: альфа-, бета-, гамма-, дельта-клетки, обладающие различными функциональными свойствами.
Поджелудочная железа — орган внешней и внутренней секреции. Она выделяет в двенадцатиперстную кишку панкреатический сок (рН 7,8—8,4).
Внешнесекреторная деятельность поджелудочной железы стимулируется блуждающими нервами, гормонами желудка и двенадцатиперстной кишки (секретин, панкре-озимин). Амилаза, расщепляющая углеводы, и липаза, расщепляющая жиры, выделяются поджелудочной железой в активной форме. Протеазы — трипсиноген и химотрипси-ноген — выделяются в неактивной форме. Они активируются только в двенадцатиперстной кишке, где трипсиноген под влиянием энтерокиназы превращается в трипсин, который в свою очередь активирует химотрипсиноген в химотрипсин. Активация про-теолитических ферментов в двенадцатиперстной кишке защищает поджелудочную железу от самопереваривания. Кроме того, клетки ацинусов выделяют ингибиторы протеаз. Клетки протоков поджелудочной железы также имеют механизмы защиты.
Эндокринная секреция панкреатических островков, на 60—70% состоящих из В-клеток, продуцирует и депонирует инсулин. Остальные гормонпроАудирующие клетки относятся к APlJD-системе клеток. Содержание инсулина в поджелудочной железе равно 6—7 мг, из которых около 2 мг идут на покрытие суточной потребности организма в инсулине.
Основным стимулятором выделения инсулина является пища, богатая белками и углеводами. Компенсаторные возможности поджелудочной железы настолько велики, что лишь при удалении около 80% ее паренхимы могут появиться клинические проявления недостаточности ее функций (сахарный диабет и др.).
АНОМАЛИИ И ПОРОКИ РАЗВИТИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Добавочная поджелудочная железа встречается очень редко, как правило, не связана с основной тканью железы и располагается в стенках желудка или двенадцатиперстной кишки, брыжейке, дивертикуле подвздошной кишки.
Наиболее часто добавочные поджелудочные железы проявляются клиническими симптомами, обусловленными давлением на тот или иной орган, сужением просвета полого органа, кишечным кровотечением, развитием эндокринных опухолей (синдром Золлингера — Эллисона) .
Лечение. Удаляют добавочную поджелудочную железу хирургическим путем.
Кольцевидная поджелудочная железа — редкий порок развития, при котором нисходящая часть двенадцатиперстной кишки оказывается частично или полностью окруженной тканью головки поджелудочной железы. Двенадцатиперстная кишка при этом сужена, что является причиной частичной хронической дуоденальной непроходимости. Стеноз двенадцатиперстной кишки может проявиться в детском возрасте, а иногда только у лиц зрелого возраста. Часто кольцевидная поджелудочная железа является случайной, интраоперационной находкой без клинических проявлений.
Диагноз устанавливают с помощью рентгенологического исследования: обнаруживают скопление газа в желудке и в луковице двенадцатиперстной кишки при обзорной рентгеноскопии и стеноз двенадцатиперстной кишки с расширением проксимальных отделов ее при проведении релаксационной дуоденографии.
Лечение. Хирургическое вмешательство показано при выраженном стенозе. Обычно с учетом местных изменений накладывают обходные анастомозы: латеро-латеральный дуоденоеюноанастомоз или латеро-латеральный антропилородуоденоеюноанастомоз.
ПОВРЕЖДЕНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Различают открытые и закрытые повреждения поджелудочной железы. Открытые повреждения возникают при огнестрельных и ножевых ранениях, закрытые — в результате тупой травмы живота. Повреждения поджелудочной железы могут быть изолированными или сочетаться с повреждениями соседних органов (двенадцатиперстная кишка, желудок, тонкая кишка). Последнее вследствие особенностей расположения поджелудочной железы наблюдается чаще. При закрытых травмах наиболее часто происходит повреждение тела поджелудочной железы, которое в момент ушиба и повышения внутрибрюшного давления оказывается более плотно прижатым к позвонкам, чем другие ее отделы.
Патологоанатомическая картина. Различают четыре степени тяжести травм поджелудочной железы: 1) локальный ушиб и кровоизлияние при интактной поджелудочной железе; 2) поверхностный разрыв капсулы и паренхимы поджелудочной железы; 3) глубокий разрыв паренхимы без повреждения протока поджелудочной железы; 4) разрыв поджелудочной железы с повреждением протока.
При повреждении головки поджелудочной железы, в которой располагаются крупные сосуды, превалируют признаки кровотечения, а при повреждении тела и хвоста — признаки ишемии.
Нередко возникают изменения, связанные с воздействием излившегося панкреатического сока: участки жировых некрозов, очаги расплавления и секвестрации ткани, абсцессы. Последние локализуются как в самой поджелудочной железе, так и в забрюшинной клетчатке. Впоследствии формируются ложные кисты и свищи поджелудочной железы.
Клиническая картина и диагностика. Первые часы после травмы характеризуются симптомами шока, внутреннего кровотечения и перитонита. В более поздние сроки появляются признаки травматического панкреатита: резкие боли в верхнем отделе живота, иррадиирующие в спину и нередко носящие характер опоясывающих; тошнота, рвота; симптомы интоксикации. Время появления этих симптомов с момента травмы различно и может варьировать от нескольких часов до нескольких суток.
Диагностика повреждений поджелудочной железы из-за отсутствия патогномоничных симптомов значительно затруднена. Для ранней диагностики повреждений органов брюшной полости и забрюшинного пространства широко применяют лапароскопию, исследование с помощью «шарящего» катетера. Наличие крови в брюшной полости является показанием к срочной лапаротомии. Иногда с помощью катетера и при промывании брюшной полости извлекают геморрагическую асцитическую жидкость с высоким содержанием амилазы и липазы, что указывает на повреждение поджелудочной железы или развившийся панкреатит. Компьютерная томография и селективная ангиография помогают определить степень тяжести и локализацию повреждения.
Лечение только хирургическое. Операция должна проводиться до развития воспалительных процессов в самой поджелудочной железе, в брюшной полости и в забрюшинной клетчатке.
При небольших разрывах поджелудочной железы удаляют образовавшуюся гематому, ушивают разрывы паренхимы отдельными узловатыми швами и дренируют сальниковую сумку через контрапертуру в поясничной области.
При повреждении левой половины поджелудочной железы с повреждением протоков производят резекцию ее тела и хвоста. Если при резекции предстоит удалить более 80% всей паренхимы, то целесообразно после освежения концов поврежденной железы наложить анастомоз дистальной части железы с выключенной по Ру петлей тощей кишки.
При размозжении головки поджелудочной железы с разрывом ее протока возникает необходимость в дуоденопанкреатэктомии.
При поздних осложнениях в виде ложных кист поступают по правилам лечения кист поджелудочной железы.
ОСТРЫЙ ПАНКРЕАТИТ
Острый панкреатит — острое заболевание поджелудочной железы, возникающее в результате аутолиза ткани ее липолитическими и активированными протеолитическими ферментами. Воспалительные изменения в поджелудочной железе возникают в ответ на некробиоз и некроз ее ткани.
Среди неотложных хирургических заболеваний органов брюшной полости острый панкреатит занимает 3-е место, уступая лишь острому аппендициту и острому холециститу. Наиболее часто заболевают лица зрелого возраста (30—60 лет), женщины — в 3 раза чаще, чем мужчины.
Этиология и патогенез. Согласно существующим общепринятым взглядам, все формы острого панкреатита развиваются в результате местных и общих реакций организма в ответ на патологическое воздействие активированных протеолитических и липолитиче-ских ферментов поджелудочной железы.
Среди причин, способствующих развитию острого панкреатита, выделяют механические, нейрогуморальные и токсико-аллергические факторы. К механическим факторам относят нарушение оттока панкреатического сока вследствие блокады ампулы, в которую открываются общий желчный проток и проток поджелудочной железы. Причинами блокады могут быть стойкий спазм сфинктера Одди вследствие рецидивирующей желчной колики при желчнокаменной болезни, острого холецистита, дискинезии двенадцатиперстной кишки (дуодено-стаз) и дуоденопанкреатический рефлюкс, отек и воспаление большого сосочка двенадцатиперстной кишки, травма (в том числе интраопера-ционная) поджелудочной железы и двенадцатиперстной кишки. Среди нейрогуморальных факторов наибольшее значение имеют нарушение жирового обмена и системные заболевания сосудов; среди токсико-аллергических — неумеренное потребление алкоголя. Лекарственная и пищевая аллергия занимает среди этих причин весьма скромное место. Указанные факторы реализуются часто после приема алкоголя, жирной и острой пищи.
Вследствие остро развивающейся внутрипротоковой гипертензии повреждаются мелкие протоки, отводящие панкреатический сок из ацинусов. В результате секрет поджелудочной железы попадает в интерстициальную ткань. Под влиянием липолитических ферментов (фосфолипазы А и липазы) может наступить некроз экзокринных панкреоцитов и жировой клетчатки, окружающей дольки поджелудочной железы. Липаза способна разрушать только поврежденные клетки. Мембраны клеток повреждаются под действием фосфолипазы А при разрыве мелких протоков. В этих условиях липаза проникает внутрь клетки, гидролизует внутриклеточные триглицериды с образованием жирных кислот. Освобождение тканевой липазы усиливает повреждающее действие липолитических ферментов. В результате появляются очаги некробиоза и некроза паренхимы поджелудочной железы. По периферии очагов некроза развивается воспалительная реакция с участием медиаторов воспаления — гистамина, серотонина, калликреин-кининовой системы. В зоне воспаления резко нарушается микроциркуляция, возникает отек вследствие резкого повышения проницаемости сосудов. На этом этапе развития панкреатита процесс может принять абортивное течение, что обычно приводит к развитию отечной формы острого панкреатита.
При менее благоприятном течении процесса в поврежденных ли-политическими ферментами клетках поджелудочной железы продолжается накопление жирных клеток, развивается внутриклеточный ацидоз со сдвигом рН до 3,5—4,5. В условиях ацидоза в результате аутокаталитических процессов внутриклеточный неактивный трипсиноген трансформируется в активный трипсин. Повреждая клетки, трипсин высвобождает и активирует лизосомальные ферменты (эластазу, коллагеназу, химотрипсин и др.). Трипсин в микроциркуляторном русле поджелудочной железы активирует калликреин-кининовую систему. Активный трипсин и другие протеазы вызывают некроз и аутолиз тканей поджелудочной железы. Эластаза подвергает лизису стенки венул и междольковые соединительнотканные перегородки. В результате этого возникают обширные кровоизлияния, способствующие быстрому распространению аутолиза ткани поджелудочной железы за пределами начальных очагов некроза, углубляются нарушения микроциркуляции, возникают диссеминированные микротромбозы. В этих условиях протеолитический некроз клеток поджелудочной железы, деструкция микрососудов и дальнейшее нарушение микроциркуляции прогрессируют катастрофически быстро. При геморрагическом некрозе ткани поджелудочной железы освобождаются и липолнтиче-ские ферменты. Таким образом, протеолитическая и липолитическая
(разы развития острого деструктивного панкреатита взаимодействуют друг с другом. Это взаимодействие способствует трансформации жирового панкреонекроза в геморрагический.
Попадание в общий ток крови токсичных продуктов аутолиза ткани поджелудочной железы (токсичные полипептиды), панкреатических ферментов, биогенных аминов, продуктов нарушенного метаболизма, активация калликреин-кининовой системы вызывают резко выраженную интоксикацию организма. В процессе развития острого панкреонекроза значительная часть жидкости организма подвергается секвестрации вследствие обширного отека парапанкреатической клетчатки, брыжейки ободочной кишки, забрюшинной клетчатки и развития паралитической непроходимости кишечника в связи с развивающимся перитонитом. Организм больного обезвоживается, наступают водно-электролитные нарушения и нарушение кислотно-основного состояния. Интоксикация в сочетании с гиповолемией быстро приводит к развитию шока. Токсичные продукты, циркулирующие в крови, оказывают в свою очередь прямое токсическое действие на сердце, почки, печень, ЦНС, вызывая нарушение центральной и периферической гемодинамики, недостаточность функции паренхиматозных органов, диссеми-нированное внутрисосудистое свертывание (ДВС-синдром).
При геморрагическом диффузно-очаговом панкреонекрозе обычно наступает субтотальное или тотальное омертвение поджелудочной железы. В случае выживания больного в последующем происходит секвестрация омертвевших участков, а при инфицировании — нагноение их с образованием парапанкреатических и забрюшинных абсцессов. В позднем периоде образуются ложные кисты поджелудочной железы.
Таким образом, абортивную форму очагового панкреонекроза можно назвать отечным, или интерстициальным, панкреатитом. При прогрессирующем панкреатите в случае аутолиза поджелудочной железы преимущественно липолитическими ферментами развивается жировой панкреонекроз. При воздействии преимущественно протеолитических ферментов развивается быстро прогрессирующий геморрагический панкреонекроз с образованием обширного отека в забрюшинной клетчатке и появлением геморрагического выпота в брюшной полости (панкре-атогенный асептический перитонит). В ряде случаев наблюдаются смешанные формы панкреатита: геморрагический панкреатит с очагами жирового некроза и жировой панкреонекроз с кровоизлияниями.
Различные формы острого панкреатита классифицируют по кли-нико-морфологическим признакам. Клинико-анатомические формы: 1) отечный панкреатит, 2) жировой панкреонекроз, 3) геморрагический панкреонекроз, 4) смешанный панкреонекроз.
В зависимости от распространенности процесса различают локальный (очаговый), субтотальный и тотальный панкреатит.
По клиническому течению бывает абортивный и прогрессирующий.
В зависимости от периода болезни — период гемодинамических нарушений и панкреатогенного шока, период функциональной недостаточности внутренних органов, период гнойных осложнений.
Патологоанатомическая картина. Изменения в поджелудочной железе рассматривают как реакцию на первичный некроз и некробиоз клеток ацинусов под влиянием собственных липолитических и протеолитических ферментов. Вокруг очажков некроза развивается демаркационное воспаление с аллергической (гиперергической) сосудистой реакцией, отеком поджелудочной железы, увеличением ее объема, что рассматривают как отечную форму панкреатита [Савельев В. С. и др., 1983 ]. У большинства больных развитие патологического процесса останавливается на этой стадии острого панкреатита. Реже под влиянием недостаточно изученных неблагоприятных факторов процесс прогрессирует: развивается морфологическая картина жирового панкреонекроза. Поджелудочная железа в этих случаях становится плотной, на разрезе имеет пестрый вид за счет множественных мелких очагов жирового некроза. Клеточные элементы в этих очагах не дифференцируются, находятся в состоянии глубокой дистрофии или некроза. Зона жирового некроза отделена от окружающей ткани пери-фокальным воспалением. Очаги этого некроза могут появляться на париетальной и висцеральной брюшине, в предбрюшинной и подкожной жировой клетчатке, на плевре, перикарде. Они имеют беловато-мутный цвет (стеариновые бляшки). Среди детрита очагов некроза видны глыбки кальциевых мыл, кристаллы жирных кислот. Вокруг поджелудочной железы развивается плотный опухолевидный инфильтрат, в который вовлечены желудок и поперечная ободочная кишка. В брюшной полости появляется серозный мутный экссудат.
При геморрагическом панкреонекрозе поджелудочная железа умеренно увеличена, плотная. Цвет ее в связи с обилием кровоизлияний в паренхиму железы и в окружающие ткани становится багрово-черным. На разрезе выявляют чередование очагов темно-красного цвета с участками неизмененной паренхимы (рис. 128). Ткань поджелудочной железы полнокровная, с очагами кровоизлияний вокруг мелких сосудов. В брюшной полости обнаруживают в значительном количестве геморрагический экссудат. Висцеральная и париетальная брюшины покрыты тусклым налетом в связи с развитием асептического перитонита. В дальнейшем по мере прегрессирования заболевания поджелудочная железа подвергается некрозу на обширных участках.

Рис 128. Острый смешанный — жировой и геморрагический — панкреатит.
тошноту, многократную рвоту. Боли чаще локализуются в левой половине эпигастрия, в спине, правом подреберье. Четкой связи болей с локализацией процесса в поджелудочной железе нет. Опоясывающий характер болей встречается наиболее часто. Интенсивность болей обычно зависит от тяжести изменений в поджелудочной железе. Чаще наблюдаются сильные и очень сильные боли. Иногда они сопровождаются коллаптоидным состоянием. Пульс обычно учащен. Артериальное давление нормальное или несколько повышено в течение короткого периода.
При исследовании живота отмечают болезненность в эпигастральной области и левом подреберье. Напряжения мышц живота нет. Лишь иногда отмечают резистентность их и болезненность в области проекции поджелудочной железы на передней брюшной стенке (симптом Керте). Пальпация в левом реберно-позвоночном углу (проекция хвоста поджелудочной железы) часто бывает болезненной (симптом Мейо — Робсона). Уже на ранних этапах выявляют ослабление перистальтических шумов. При жировом некрозе поджелудочной железы рано образуется постнекротический инфильтрат, который можно определить в эпигастральной области при пальпации. В связи с этим у больных не удается четко прощупать пульсацию аорты (симптом Воскресенского). Этому способствуют также парез и вздутие поперечной ободочной кишки.
При осмотре живота отмечают некоторое его вздутие. Перкуторно определяют высокий тимпанит. Однако с появлением выпота в брюшной полости возникает притупление перкуторного звука в отлогих частях живота, которое легче выявляется в положении больного на боку. Кожа живота при тяжелом панкреатите имеет иногда мраморный оттенок. В области пупка, на левой боковой стенке живота появляются синюшные, иногда с желтоватым оттенком пятна, свидетельствующие о рассасывании кровоизлияний в области поджелудочной железы. Эти пятна могут наблюдаться также при кровотечении в брюшную полость при внематочной беременности, при гангрене тонкой кишки.
При тяжелой форме панкреатита перкуторно и аускультативно можно выявить реактивный плеврит, который появляется сравнительно рано. Одновременно с этим у ряда бальных развиваются серозно-ге-моррагический перитонит и явления шока, более свойственные геморрагическому панкреатиту. В период гемодинамических нарушений появляются тахикардия, тахипноэ, снижается артериальное давление. В этом периоде для определения тяжести процесса необходимо иметь показания шокового индекса. В норме он равен 0,5. При потере жидкости со рвотой, секвестрацией ее в отечных тканях брюшины, забрюшиной клетчатке, в корне брыжейки кишечника и других тканях он возрастает до 1,0—1,5 (см. «Желудочно-кишечные кровотечения»). Клинически шок проявляется бледностью кожных покровов и слизистых оболочек, повышенным потоотделением, акроцианозом, частым нитевидным пульсом, спавшимися венами, уменьшением ОЦК, ЦВД, минутного и ударного объемов сердца. На ЭКГ выявляют признаки ишемии миокарда. У большинства больных наблюдают расстройство психики: возбуждение, спутанное сознание, прострация. Параллельно этому снижается диурез, олигурия может смениться анурией и острой почечной недостаточностью.
Функциональные нарушения печени проявляются желтушной окраской кожных покровов, увеличением печени; в анализах крови выявляют повышение уровня билирубина, снижение содержания белка, а также увеличение числа лейкоцитов и СОЭ; отмечают ацидоз, гиперкалиемию, снижение содержания Са , свидетельствующее о про-грессировании жирового некроза. Содержание Са ниже 2 моль/л является прогностически неблагоприятным фактором, так как отражает нарастающее связывание его стеариновыми бляшками жирового некроза в различных тканях организма.
При остром панкреатите резко возрастает содержание амилазы и липазы в сыворотке крови, повышается уровень амилазы в моче, особенно резко их концентрация возрастает в экссудате брюшной и плевральной полости.
Строгого соответствия между уровнями амилазы и липазы в сыворотке крови и тяжестью панкреатита нет. Следует иметь в виду, что повышение активности амилазы и липазы может наблюдаться также при почечной недостаточности вследствие уменьшения экскреции этих ферментов, при перфорации язвы, непроходимости кишечника (уменьшение резорбции из тонкой кишки), остром холецистите (сопутствующая реакция поджелудочной железы). Более специфичным исследованием является определение трипсина сыворотки крови, альфа-хи-мотрипсина, эластазы и особенно фосфолипазы Аг, играющей ключевую роль в процессе развития геморрагического панкреонекроза. Однако сложность их определения сдерживает широкое распространение указанных методов.
Диагностика острого панкреатита основывается на данных анамнеза (появлении резких болей в животе после обильной еды, приема алкоголя, обострения фоновых заболеваний); данных объективного и лабораторного исследований. Значительную помощь в диагностике оказывает ультразвуковое исследование, позволяющее установить этиологические факторы (холецисто- и холедохолитиаз), тяжесть морфологических изменений в поджелудочной железе и течение болезни, сопутствующие осложнения заболевания. Точность диагностики холецистита и нарушения оттока желчи при ультразвуковом исследовании достигает 92—98%. Признаками отека поджелудочной железы являются увеличение ее объема и уменьшение степени отражения сигнала. При некрозе поджелудочной железы выявляют нерезко ограниченные участки пониженной эхогенности или полного отсутствия эхосигнала. Распространение некроза за пределы поджелудочной железы («дорожки некроза»), а также абсцессы и ложные кисты могут быть визуализированы при ультразвуковом исследовании.
Рентгенологическое исследование менее информативно. Оно позволяет иногда выявить рентгеноконтрастные конкременты в желчных путях, в протоке поджелудочной железы, изменение расположения желудка и двенадцатиперстной кишки при объемных процессах в поджелудочной железе. Рентгенологическое исследование является важным для выявления паралитической непроходимости кишечника, выпота в плевральной полости, дисковидных ателектазов легкого, которые часто сопутствуют острому панкреатиту. Исследование желудка и кишечника с контрастным веществом в остром периоде панкреатита противопоказано.
Компьютерная томография дополняет ультразвуковое исследование. Она позволяет более четко выявить очаги некроза, изменения в па-рапанкреатической клетчатке, «дорожки некроза» за пределами поджелудочной железы, а также осложнения в виде абсцессов и кист. Ультразвуковое исследование легче применять для контроля за течением заболевания.
Эзофагогастродуоденоскопия не имеет большого значения для диагностики панкреатита. Показания к ней возникают при желудочно-кишечном кровотечении на фоне панкреатита. Ретроградная холедо-хопанкреатография при остром панкреатите противопоказана, за исключением случаев ущемления конкремента в ампуле, когда требуются папиллотомия и его удаление.
Лапароскопию применяют при неясном диагнозе, при необходимости лапароскопической установки дренажей для лечения острого панкреатита. Для взятия перитонеального экссудата и проведения диагностического лаважа можно воспользоваться введением в брюшную полость катетера через прокол в брюшной стенке.
Электрокардиография необходима во всех случаях как для дифференциальной диагностики с острым инфарктом миокарда, так и для оценки состояния сердечной деятельности в процессе заболевания.
Дифференциальная диагностика. Дифференциальную диагностику необходимо проводить прежде всего с тромбозом мезентериальных сосудов, так как внезапные резкие боли, шоковое состояние при мягком животе и нормальной температуре тела могут напоминать острый панкреатит. Паралитическая непроходимость кишечника и перитонит встречаются при обоих заболеваниях.
Инфаркт миокарда по клиническим данным трудно дифференцировать от острого панкреатита, так как в острой фазе панкреатита возникают изменения ЭКГ, типичные для острого инфаркта миокарда. Как в случае мезентериального инфаркта кишечника, так и при инфаркте миокарда ультразвуковое исследование помогает дифференцировать эти заболевания. При неясном диагнозе целесообразно провести артериографию сосудов брюшной полости. Острый холецистит и его осложнения можно сравнительно легко отличить по типичной клинической картине и ультразвуковой симптоматике. Острый панкреатит приходится дифференцировать от прободной язвы, странгуляционной тонкокишечной непроходимости, аневризмы аорты, почечной колики.
Осложнения. Острый панкреатит может сопровождаться многочисленными осложнениями. Наиболее тяжелыми из них являются:
гиповолемический шок;
острая почечная недостаточность, являющаяся в значительной степени следствием шока и панкреатогенной токсемии;
плевролегочные осложнения, проявляющиеся дыхательной недостаточностью в связи с развитием шокового легкого и тяжелой гипоксемией, могут способствовать также развитию дыхательной недостаточности, экссудативный плеврит, ателектаз, высокое стояние диафрагмы и т. д.;
печеночная недостаточность (от легкой желтухи до тяжелого острого токсического гепатита, развивающегося вследствие перенесенного шока и влияния токсичных ферментов и белковых субстанций). Этому способствует заболевание желчных путей и сопутствующий им холангит;
абсцессы поджелудочной железы и экстрапанкреатические абсцессы. Появление их обусловлено инфекцией, легко развивающейся в очагах некроза. Абсцесс может возникнуть в любом участке некроза забрюшинной клетчатки (поддиафрагмальной или подпеченочной). Прорыв его в полый орган или наружу может привести к возникновению внутренних и наружных свищей поджелудочной железы;
наружные свищи чаще развиваются на месте дренажей или ран. Сначала выделяется гнойно-некротическое содержимое, позднее — светлый панкреатический сок. Внутренние свищи обычно открываются в желудок, двенадцатиперстную, тонкую и толстую кишки;
кровотечения, возникающие вследствие аррозии сосудов. Кровь из брюшной полости выделяется наружу через рану или по каналу дренажа. Внутренние кровотечения чаще всего являются следствием эрозивного гастрита, стрессовой язвы, синдрома Маллори — Вейса, а также в связи с нарушением в системе гемостаза (коагулопатия потребления).
В числе поздних осложнений следует упомянуть о формировании псевдокист. Некротизированная ткань поджелудочной железы при обширном некрозе не рассасывается полностью. Она инкапсулируется и превращается в псевдокисту благодаря формированию соединительнотканной капсулы вокруг очага некроза. Содержимое кисты может быть стерильным или гнойным. Иногда происходит спонтанное рассасывание кист.
Лечение. Программа лечения острого панкреатита должна быть построена с учетом этиологии заболевания, его тяжести и клинического течения. Больному необходимо наблюдение хирурга, терапевта и специалиста по интенсивной терапии (реаниматолога), которые совместно решают сложные вопросы его лечения. В программе лечения предусматривают базисную терапию, угнетение секреции ферментов, предупреждение аутолиза ткани железы и развития осложнений, устранение этиологического фактора, лечение осложнений и, наконец, хирургическое вмешательство.
Базисная терапия включает: снятие боли (избегать введения морфина, повышающего тонус сфинктера Одди и затрудняющего отток панкреатического сока); прекращение питания и приема жидкости через рот, а при появлении признаков непроходимости кишечника — назогастральный зонд для постоянной аспирации содержимого желудка (покой для поджелудочной железы); парентеральное восполнение дефицита жидкости и электролитов под контролем ЦВД, почасового диуреза, парентеральное питание посредством введения растворов глюкозы с инсулином и жировой эмульсии (липофундин и др.); восполнение дефицита альбумина при шоке и снижении альбумина сыворотки крови; при снижении уровня гемоглобина и гематокрита — переливание крови.
Для подавления боли применяют ненаркотические анальгетики (ба-ралгин, амидопирин, анальгин). Во избежание развития или углубления шока спазмолитические средства следует назначать с осторожностью. При очень сильных болях вынужденно приходится вводить про-медол. В условиях стационара для снятия болей рекомендуют пара-нефральную блокаду, блокаду круглой связки печени раствором новокаина или более эффективную перидуральную анестезию.
Уменьшению болевого синдрома способствуют введение глкжозо-новокаиновой смеси с атропином, аспирация содержимого желудка и промывание его холодной водой.
Острый панкреатит сопровождается значительными водно-электролитными нарушениями, поэтому восполнение дефицита жидкости, электролитов, альбумина имеет первостепенное значение в профилактике и лечении шока, восстановлении нарушенного гомеостаза. С этой целью больным вводят растворы, содержащие натрий, калий, фосфор, глюкозу. Для восполнения дефицита ОЦК целесообразно вводить по-лиглюкин, гемодез, альбумин, повышающие осмолярность крови и способствующие удержанию изотонических растворов в сосудистом русле. Кроме того, названные препараты способны связывать токсичные вещества и выводить их с мочой. Введение жидкостей должно контролироваться измерением ЦВД и диуреза. При стабильном артериальном давлении применяют форсированный диурез с помощью мочегонных средств.
Парентеральное питание является обязательным компонентом лечения, так как питание через рот прекращают на 3—5 дней. Энергетические потребности организма больного (30 кал в день на 1 кг массы тела с последующим повышением до 60 кал в день) обеспечивают путем введения растворов глюкозы с инсулином под контролем содержания глюкозы крови, растворов аминокислот и липидов (липофундин и другие аналогичные препараты). Жировые эмульсии применяют не только для восстановления энергетических расходов организма, но и для стабилизации мембран клеток поджелудочной железы, что способствует ограничению повреждения их ферментами.
Для угнетения секреторной деятельности поджелудочной железы прежде всего прекращают прием пищи и жидкости через рот. Одновременно с аспирацией желудочного содержимого больным назначают антацидные средства для связывания соляной кислоты. Однако при введении большого количества антацидных средств пероральным путем нарушается принцип воздержания от приема жидкости через рот. Угнетение желудочной секреции циметидином и антихолинергически-ми препаратами (гастрозепин, атропин) целесообразно только в раннем периоде заболевания.
Ингибиторы протеолитических ферментов, таких, как контрикал (трасилол), гордокс (ингибиторы трипсина, калликреина и др.), ами-
нокапроновая кислота и ее производные, до недавнего времени широко применялись для лечения острого панкреатита. В последние годы эффективность использования их ставится под сомнение, хотя профилактическое применение при операциях на поджелудочной железе и желчных путях вполне оправдано. Введение контрикала или гордокса как препаратов, угаетающих калликреин-кининовую систему и трипсин, целесообразно в самые ранние сроки от начала заболевания. Дозировка препаратов колеблется от 120 000—200 ООО ЕД до 1 000 000 ЕД. Более эффективным препаратом, угнетающим эндокринную функцию поджелудочной железы, является фторурацил.
Перитонеальный лаваж применяют не только для диагностики, но и для лечения развившегося панкреатита: из брюшной полости удаляют экссудат, богатый протеолитическими и липолитическими ферментами, хининами и другими токсичными субстанциями; продукты расплавленных некротизированных тканей. Перитонеальный лаваж предупреждает всасывание токсичных продуктов и уменьшает действие токсинов на паренхиматозные органы. Перитонеальный лаваж более эффективен, чем ингибиторы протеолитических ферментов.
Для проведения перитонеального лаважа в брюшную полость под контролем лапароскопа вводят 2 дренажа в верхний этаж брюшной полости, а также дренажи в полость малого таза и в правый боковой канал. По верхним дренажам диализирующую жидкость подают в брюшную полость, через нижние выводят наружу.При этом необходимо следить за балансом вводимой и выводимой жидкости, контролировать ЦВД, следить за возможными легочными осложнениями.
Для улучшения микроциркуляции, в том числе в поджелудочной железе, вводят реополиглюкин, небольшие дозы гепарина, производят блокаду чревных нервов, паранефралыгую блокаду, а также применяют гемодилюцию при инфузионной терапии.
Устранение этиологической причины острого панкреатита возможно в тех случаях (около 50%), когда развитие его связано с заболеванием желчного пузыря и внепеченочных желчных протоков, т. е. при би-лиопанкреатическом рефлюксе. Если при ультразвуковом исследовании обнаруживают желчнокаменную болезнь с расширением желчных протоков вследствие застоя желчи или конкремент в терминальном отделе общего желчного протока либо в области большого сосочка двенадцатиперстной кишки, то необходимы срочная папиллотомия и удаление конкремента из общего желчного протока и сосочка (если они не отходят самостоятельно). Холецистэктомию осуществляют после стихания явлений острого панкреатита.
Антибактериальную терапию при панкреонекрозе проводят как для профилактики инфицирования очагов некроза, так и для лечения уже развивающейся инфекции. Предпочтение отдают антибиотикам широкого спектра действия, подавляющим развитие как грамположительной, так и грамотрицательной микрофлоры.
Почечная и дыхательная недостаточность часто сопровождают тяжело протекающий панкреатит. При скоплении экссудата в плевральной полости необходима срочная ее пункция и удаление экссудата с обязательным определением содержания в нем ферментов поджелудочной железы, белка, а также его бактериоскопия и бактериологическое исследование. При дыхательной недостаточности, вызванной другими причинами (шоковое легкое), необходимо в ранние сроки перевести больного на искусственную вентиляцию легких с созданием положительного давления на выдохе. При почечной недостаточности (анурия, высокое содержание креатинина и мочевины в крови) показан гемодиализ в возможно ранние сроки.
Несмотря на успехи интенсивной терапии в лечении острых панкреатитов, тяжелые их формы часто заканчиваются летально. Поэтому при определенных условиях возникает необходимость в хирургическом вмешательстве, которое является лишь дополняющим лечебным мероприятием.
Показания к оперативному лечению возникают при следующих условиях: 1) при неуверенности в диагнозе; 2) при установленном диагнозе острого панкреатита билиарного происхождения; 3) при локальном панкреонекрозе и инфицировании очагов некроза и «некротических дорожек» в забрюшинной клетчатке; 4) при панкреатогенном перитоните; 5) при отсутствии улучшения или при ухудшении состояния, несмотря на правильное интенсивное лечение, в том числе при безуспешности лапароскопического лаважа брюшной полости; 6) при наличии абсцессов в брюшной полости.
Целью хирургического лечения является удаление некротизирован-ных участков тканей до развития их нагноения, обеспечение оптимального дренирования брюшной полости при наличии перитонита, установка дренажей для терапевтического лаважа. В последнем случае в ложе поджелудочной железы устанавливают перфорированные дренажные трубки для того, чтобы обеспечить хорошее промывание этой области, удаление не только экссудата и содержащихся в нем ферментов, но и образовавшегося в результате расплавления тканей детрита. Трубки укладывают по ходу поджелудочной железы и выводят наружу через боковые отделы живота. Одну или две трубки устанавливают в полости малого таза. В течение суток через них вводят 10—12 л диализата, содержащего 5,6 г хлорида натрия, 5,09 г лактата натрия, 0,52 г хлорида кальция, 0,15 г хлорида магния, 15 г глюкозы, до 1000 мл дистиллированной воды (осмолярность раствора 360 моем/л). К раствору можно добавлять антибиотики по показаниям.
Для лучшего осмотра и дренирования поджелудочной железы производят продольные разрезы брюшины по верхнему и нижнему краям ее, тупым путем выделяют железу из окружающей клетчатки, осматривают и укутывают сальником (абдоминализация железы). Это позволяет полнее удалить токсичный экссудат, детрит, обеспечить не только изоляцию железы, но и в последующем улучшить ее кровоснабжение. Для этой же цели иногда ограничиваются лишь фиксацией сальника к передней поверхности поджелудочной железы.
При выраженном очаговом (множественном) панкреонекрозе в сочетании с перитонитом прибегают к лапаростомии и этапному лаважу. Через открытую рану брюшной стенки отделяется перитонеальный экссудат в повязку. Рану подвергают ревизии с повторным промыванием брюшной полости и удалением очагов некроза через 24—48 ч по такой же методике, как при распространенном гнойном перитоните (см. «Перитониты»). При повторных вмешательствах производят некр-эктомию и секвестрэктомию, удаляя при этом только омертвевшие ткани. При ограниченном некрозе хвоста поджелудочной железы производят дистальную резекцию ее. При тотальном панкреонекрозе в некоторых, наиболее подготовленных учреждениях производят панк-реатодуоденэктомию.
При наличии сопутствующего заболевания желчного пузыря (каль-кулезный холецистит) или желчных путей (холедохолитиаз, папил-лостеноз, конкремент в ампуле общего желчного протока и протока поджелудочной железы), затрудняющего отток желчи и панкреатического сока и способствующего рефлюксу желчи в ее проток, показано оперативное вмешательство на этих органах — удаление желчного пузыря, холедохотомия с удалением камней и последующим дренированием Т-образным дренажем, папиллотомия и др.
Отечная форма панкреатита подлежит консервативному лечению по изложенным выше правилам. В большинстве случаев интенсивное лечение позволяет остановить прогрессирование очагового некроза поджелудочной железы и добиться выздоровления больного. При геморрагическом и жировом некрозе или смешанном панкреонекрозе с обширным поражением поджелудочной железы, несмотря на полноценное консервативное и оперативное лечение, в большинстве случаев больные погибают от тяжелых осложнений. Пациенты с острым панкреатитом II степени тяжести нуждаются в оперативном лечении и интенсивной терапии. Общая послеоперационная летальность среди больных, оперированных открытым методом (после лапаротомии и вмешательства на поджелудочной железе и других органах, вовлеченных в патологический процесс), составила 43,9%. Среди больных, оперированных закрытым методом (лапароскопическое введение дренажей с последующим промыванием брюшной полости), летальность значительно ниже — 16,9%.
ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Выделяют две основные формы заболевания: хронический рецидивирующий панкреатит, при котором наблюдаются периодические обострения болезни в виде острого панкреатита, и первично-хронический панкреатит.
Этиология и патогенез. В этиологии хронического рецидивирующего панкреатита ведущую роль играют заболевания желчного пузыря и желчных путей (желчнокаменная болезнь), алкоголизм, хронические заболевания желудка и двенадцатиперстной кишки (гастрит со сниженной или повышенной секреторной функцией желудка, язвенная болезнь, дивертикулы периампулярной зоны двенадцатиперстной кишки), нарушения белкового и жирового обменов (белковая недостаточность, гиперлипидемня, ожирение), острые и хронические инфекционные заболевания, эндогенная интоксикация при тяжелых заболеваниях внутренних органов, цитотоксическое действие экзогенных ядов (в том числе некоторых лекарственных препаратов — чаще всего стероидных гормонов), гиперпаратиреоз и травма поджелудочной железы.
Патологоанатомическая картина. При хроническом панкреатите различной этиологии происходит замещение эпителиальной ткани поджелудочной железы соединительной тканью с последующим развитием фиброза и склероза, что может приводить к уменьшению или увеличению размеров поджелудочной железы. Особое место занимает калькулезный (кальцифицирующий) панкреатит, при котором отмечают отложение солей кальция в ткани поджелудочной железы или в просвете выводных протоков (вирсунголитиаз). При облитерации ее мелких выводных протоков вследствие воспалительного или скле-розирующего процесса у некоторых больных формируются кисты. Таким образом, выделяют четыре клинико-морфологические формы хронического панкреатита: 1) хронический индуративный; 2) ложноопу-холевый; 3) ложнокистозный; 4) калькулезный (в том числе вирсунголитиаз) .
Клиническая картина и диагностика. Ведущими симптомами хронического панкреатита являются тупые боли в эпигастральной области, правом или левом подреберье (в зависимости от локализации основного очага поражения железы), опоясывающие боли, усиливающиеся после погрешности в диете, диспепсические расстройства (тошнота, рвота скудным количеством желудочного содержимого), чередование запоров с поносами (при выраженной внешнесекреторной недостаточности поджелудочной железы), обтурационная желтуха, связанная со сдавлением терминального отдела общего желчного протока увеличенной головкой поджелудочной железы и обусловленная нарушением пассажа желчи и панкреатического сока в двенадцатиперстную кишку при сочетанном холедохолитиазе, рубцовой стриктуре большого сосочка двенадцатиперстной кишки. Часто наблюдается снижение массы тела, связанное с внешнесекреторной недостаточностью поджелудочной железы, нарушением переваривания пищи, а также уменьшением объема потребляемой больными пищи из-за боязни усиления болей после еды.
При объективном исследовании в фазе обострения заболевания можно выявить симптомы, характерные для острого панкреатита. В фазе ремиссии отмечают болезненность по ходу поджелудочной железы, у худощавых субъектов можно пропальпировать плотную болезненную поджелудочную железу. Пальпацию железы производят в трех положениях: лежа на спине с подложенным под нее валиком, стоя с наклоном туловища вперед на 45° и лежа на левом боку. При преимущественном поражении головки поджелудочной железы и сдавлении терминального отдела общего желчного протока у некоторых больных выявляют симптом Курвуазье, характеризующийся триадой признаков: обтурационной желтухой, увеличением желчного пузыря, отсутствием боли. Почти у половины больных (особенно при обострении заболевания) определяется положительный симптом Мейо — Робсона.
Диагностика хронического панкреатита проводится на основании жалоб больного, данных анамнеза, физикального, лабораторного и инструментальных методов исследования. При обострении заболевания и нарушении оттока панкреатического сока (чаще при вирсунголити-азе) отмечают увеличение уровня амилазы, липазы и трипсина в крови и амилазы в моче. При первично-хроническом панкреатите или хронической рецидивирующей форме заболевания в фазе ремиссии концентрация ферментов поджелудочной железы в крови и моче обычно не изменена, поэтому в данных ситуациях эти пробы не имеют диагностической ценности. Концентрация протеолитических и липолитических ферментов в дуоденальном содержимом, как правило, снижена. При копрологическом исследовании обычно выявляют кре-аторею и стеаторею. Примерно у 25% больных отмечают признаки нарушения толерантности к глюкозе по данным гликемической кривой с углеводной нагрузкой. У больных с калькулезным панкреатитом частота недостаточности инкреторной функции поджелудочной железы возрастает до 60—80%. В случае ложнокистозной и туморозной формах при обзорной рентгенографии брюшной полости можно выявить тени кальцинатов по ходу поджелудочной железы. При исследовании двенадцатиперстной кишки в условиях искусственной гипотонии (релаксационная дуоденография) определяют косвенные симптомы хронического панкреатита: развернутую вертикальную ветвь («подкову») двенадцатиперстной кишки, вдавление или дефект наполнения по ее медиальному контуру, сглаженность складок слизистой оболочки в данной зоне. При ультразвуковом исследовании и компьютерной томографии обычно выявляют увеличение того или иного отдела поджелудочной железы. Следует отметить, что указанные изменения не позволяют отличить хронический панкреатит от опухолевого поражения поджелудочной железы. С этой целью используют прицельную пункцию железы под контролем УЗИ или компьютерной томографии с последующим морфологическим исследованием биопсийного материала. При ретроградной панкреатохолангиографии у некоторых больных выявляют расширение главного протока поджелудочной железы, обусловленное стенозирующим папиллитом или вирсунголитиазом. Значительно чаще определяют сужение и деформацию протока поджелудочной железы.
Лечение. Основным методом лечения неосложненного хронического панкреатита является консервативный. Назначают диету с исключением жирной, жареной, соленой, острой пищи (перец, чеснок, уксус и т. п.). Лекарственная терапия направлена прежде всего на устранение болей и спазма сфинктера Одди с помощью ненаркотических анальгетиков, спазмолитических и холинолитических средств, ганглиоблокаторов. Необходимо также обеспечение функционального покоя поджелудочной железы (диета, пероральный прием щелочных растворов, в том числе минеральных вод). При выраженном снижении массы тела применяют парентеральное питание (растворы аминокислот, концентрированные растворы глюкозы, жировые эмульсии). У больных с выраженной экзокринной недостаточностью поджелудочной железы назначают препараты, содержащие ее ферменты (панкреатин, панзинорм, фестал и т. п.). Важная роль принадлежит также комплексному лечению других заболеваний внутренних органов — желчнокаменной болезни, язвенной болезни желудка и двенадцатиперстной кишки. При обострении хронического панкреатита лечение проводят по тем же принципам, что и при остром панкреатите.
Показаниями к оперативному вмешательству на поджелудочной железе являются вирсунголитиаз, стриктура протока поджелудочной железы и гипертензня в дистальных (по отношению к стриктуре) его отделах, тяжелые болевые формы хронического панкреатита, не поддающиеся комплексному консервативному лечению. Окончательный диагноз устанавливают на операционном столе и тут же выбирают метод хирургического вмешательства. В ходе операции хирург определяет преимущественную локализацию патологического процесса, проходимость желчных путей и протока поджелудочной железы. Для этого проводят пальпацию, интраоперационное ультразвуковое исследование поджелудочной железы и желчных путей, интраоперационную холангиографию. При необходимости выполняют вирсунгографию после предварительной пункции протока поджелудочной железы под контролем ультразвукового исследования.
При небольших по протяженности стриктурах терминального отдела протока поджелудочной железы выполняют трансдуоденальную папиллосфинктеротомию с рассечением устья протока и сшиванием его слизистой оболочки со слизистой оболочкой задней стенки общего желчного протока (вирсунгопластика). При протяженных стриктурах проксимальной части протока поджелудочной железы со значительным расширением его просвета дистальнее места препятствия для оттока панкреатического сока выполняют продольную панкреатоею-ностомию. При этой операции рассекают в продольном направлении проток поджелудочной железы от ее головки до хвостовой части, после чего формируют анастомоз с изолированной по Ру петлей тощей кишки.
У больных с тяжелыми формами болевого хронического панкреатита, не поддающимися длительному консервативному лечению, выполняют резекцию поджелудочной железы или панкреатодуоденальную резекцию.
КИСТЫ И СВИЩИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Кисты поджелудочной железы представляют собой ограниченные капсулой скопления жидкости в виде полостей, расположенных как в самой железе, так и в окружающих ее тканях. Заболевание встречается в различных возрастных группах одинаково часто у мужчин и у женщин. Понятие кисты поджелудочной железы является собирательным. Различают следующие виды кист.
I. Врожденные (дизонтогенетические) кисты, образующиеся в ре- зультате пороков развития ткани поджелудочной железы и ее прото- ковой системы.
II. Приобретенные кисты: 1) ретенционные, развивающиеся в ре- зультате стриктуры выводных протоков железы, стойкой закупорки их просвета конкрементами, опухолями; 2) дегенерационные, возни- кающие вследствие некроза ткани железы при панкреонекрозе, травме, кровоизлияниях, опухолевом процессе; 3) пролиферационные — по- лестные опухоли, к которым относятся цистадеиомы, цист аденокарциномы; 4) паразитарные кисты: эхинококк, цистицерк.
Па то л огоанат омическая картина. В зависимости от причины и механизмов образования кист, особенностей строения их стенок различают истинные и ложные кисты.
К истинным кистам относят врожденные кисты поджелудочной железы, приобретенные ретенционные кисты, цистаденомы и циста-денокарциномы. Отличительной особенностью истинной кисты является наличие эпителиальной выстилки ее внутренней поверхности. Истинные кисты составляют 20% всех кист поджелудочной железы. В отличие от ложных кист истинные обычно не достигают больших размеров и нередко являются случайными находками во время операции.
Ложные кисты составляют около 80% всех кист поджелудочной железы. Они образуются после острого панкреонекроза или травмы поджелудочной железы, которые сопровождались очаговым некрозом ткани, разрушением стенок протоков, выходом панкреатического сока и кровоизлияниями за пределы железы. Стенки ложной кисты представляют собой уплотненную брюшину, фиброзную ткань и в отличие от истинной кисты изнутри покрыты грануляционной тканью. Полость ложной кисты обычно заполнена жидкостью и некротическими тканями. Характер жидкости бывает различным. Обычно это серозный или гнойный экссудат, содержащий большую примесь измененной крови и сгустков, излившегося панкреатического сока. Ложная киста может локализоваться в головке, теле и в хвосте пожделудочной железы и достигать больших размеров. Объем содержимого при ложной кисте нередко составляет 1—2 л и более. Ложная киста больших размеров может располагаться в различных направлениях: вперед и вверх в сторону сальниковой сумки, оттесняя печень кверху, а желудок книзу; в сторону желудочно-ободочной связки, оттесняя желудок кверху, а поперечную ободочную кишку — книзу; между листками брыжейки поперечной ободочной кишки, смещая последнюю кпереди, и, наконец, в нижний этаж брюшной полости, смещая поперечную ободочную кишку кверху, а тонкий кишечник кзади и вниз.
Клиническая картина и диагностика. Кисты небольших размеров могут клинически не проявляться. Симптомы заболевания появляются в тех случаях, когда киста достигает больших размеров и вызывает сдавление и смещение соседних органов.
Наиболее частыми симптомами больших ложных кист служат боли в верхней половине живота, диспепсические явления, нарушения общего состояния — слабость, похудание, периоды повышения температуры тела, наличие пальпируемого опухолевидного образования в животе.
Боли могут быть тупыми и постоянными или приступообразными. Иногда отмечают опоясывающие и распирающие боли, из-за которых больные вынуждены принимать согнутое или коленно-локтевое положение. Особенно сильными боли бывают в том случае, когда киста оказывает давление на чревное сплетение. Однако даже при гигантских кистах боли нередко бывают выражены незначительно и больные жалуются лишь на чувство давления в эпигастральной области. Наиболее частыми диспепсическими явлениями бывают тошнота, рвота, неустойчивый стул.
При объективном исследовании выявляют опухолевидное образование. Кисту больших размеров можно обнаружить уже при первичном осмотре. Наружные ее границы четкие, форма округлая или овальная, поверхность гладкая. В зависимости от локализации кисты пальпируемое опухолевидное образование определяют в подложечной, околопупочной областях, в правом или левом подреберье.
Наблюдают как постепенное, медленно прогрессирующее течение заболевания, так и более острое, когда киста за короткий срок достигает больших размеров, вызывая тяжелые функциональные нарушения со стороны других органов, и сопровождается осложнениями.
К наиболее частым осложнениям относят кровоизлияния в полость кисты, нагноение, разрывы с развитием перитонита, наружные и внутренние свищи, расстройства, причиняемые сдавлением соседних органов.
Диагноз кисты поджелудочной железы основывается на данных клинического обследования и специальных методов исследования. Кроме незначительного повышения количества ферментов поджелудочной железы в крови и моче, иногда отмечают уменьшение их в содержимом двенадцатиперстной кишки. При рентгенологическом исследовании выявляют оттеснение желудка, поперечной ободочной кишки кпереди и кверху или книзу от обычного положения. Компьютерная томография и ультразвуковое сканирование помогают обнаружить заполненное жидкостью образование, связанное с поджелудочной железой.
Дифференциальная диагностика. При дифференциальной диагностике кист поджелудочной железы необходимо исключить опухоли поджелудочной железы, аневризму аорты, опухоли забрю-шинных лимфатических узлов, опухоли и кисты печени, гидронефроз и опухоли почек, кисты брыжейки ободочной кишки.
Лечение. Применяют только хирургическое лечение. При больших кистах поджелудочной железы выбор метода операции определяется видом кисты, ее локализацией и размерами. Радикальная операция — резекция пораженного участка поджелудочной железы или экстирпация кисты возможна лишь при небольших истинных кистах, локализующихся в основном в дистальных ее отделах. При ложных кистах, стенки которых образованы соседними органами, подобные операции невыполнимы.
Наиболее часто при ложных кистах применяют различные дренирующие операции. При гигантских кистах, исходящих из тела и головки поджелудочной железы, показано наложение анастомоза между кистой и выключенной по Ру петлей тощей кишки. При кистах хвостовой части железы показана чрезжелудочная цистогастротомия, которая заключается в создании соустья между кистой и желудком. При небольших кистах, локализованных в головке поджелудочной железы, производят трансдуоденальную цистодуоденостомию — создание анастомоза между кистой и двенадцатиперстной кишкой. При септическом состоянии, обусловленном нагноением кисты, показана марсупиализация — наружное дренирование кисты путем подшивания ее стенок к париетальной брюшине и коже. В настоящее время этот тип операций применяют редко. После оперативного лечения благоприятные результаты получают в 90—95% случаев.
Свищи поджелудочной железы — патологические сообщения ее протоков с внешней средой или внутренними органами. Различают наружные свищи, когда устье свища открывается на коже, и внутренние, при которых свищ сообщается с полым органом (желудком, тонкой или толстой кишкой). Они могут быть полными и неполными. При обтурации проксимальной части протока (полный свищ) весь панкреатический сок выделяется наружу. При неполных свищах основная часть панкреатического сока оттекает естественным путем в двенадцатиперстную кишку и только часть его отделяется по свищу.
Этиология. Наружные свищи поджелудочной железы наиболее часто возникают после открытой травмы живота или после операции на поджелудочной железе, сочетающейся со вскрытием ее протоков. Внутренние свищи обычно являются следствием деструктивных изменений в железе, переходящих на стенку соседнего органа (острый панкреатит, пенетрация и прободение кисты поджелудочной железы).
Патологоанатомическая картина. Панкреатические свищи представляют собой неравномерно суженный канал, стенки которого образованы фиброзной тканью. Своим основанием свищ сообщается с протоком поджелудочной железы. В ткани поджелудочной железы в месте формирования свища обнаруживают различного рода морфологические изменения, которые привели к его образованию (некроз, воспаление, киста, опухоль).
Клиническая картина и диагностика. Для наружных свищей поджелудочной железы характерно выделение панкреатического сока через их наружное отверстие. Количество отделяемого зависит от вида свища. При полном свище (встречается редко) за сутки выделяется до 1—1,5 л панкреатического сока, при неполных — нередко всего несколько капель. В зависимости от выраженности деструктивных и воспалительных изменений в поджелудочной железе и в стенках свища выделяется либо чистый панкреатический сок, либо сок с содержанием примеси крови и гноя. Вследствие выделения большого количества панкреатического сока очень быстро развивается мацерация кожи вокруг наружного отверстия свища. Значительная потеря панкреатического сока приводит к резкому ухудшению состояния больного, выраженным нарушениям белкового, жирового и углеводного обменов, существенным потерям воды, электролитов и расстройствам кислотно-основного состояния. Часто эти потери ведут к обезвоживанию, истощению, адинамии, а в тяжелых случаях — к коматозному состоянию.
При внутренних свищах выделение пайкреатического сока происходит в просвет желудка или кишечника. В связи с этим тяжелые патофизиологические изменения, свойственные наружным свищам, не развиваются.
Диагностика наружных свищей больших трудностей не представляет. Окончательный диагноз подтверждается обнаружением в отделяемом свища панкреатических ферментов. Для уточнения диагноза следует применять фистулографию. Если при фистулографии контраст заполняет протоки поджелудочной железы, то диагноз не вызывает сомнений.
Лечение. Неполные свищи обычно закрываются под влиянием консервативного лечения в течение нескольких месяцев. Оно включает мероприятия, направленные на улучшение общего состояния, ликвидацию истощения и обезвоживания организма. Для снижения секреторной активности поджелудочной железы назначают цитостатические и спазмолитические средства, а также специальную диету, богатую белками и бедную углеводами, ограничивающую выделение панкреатического сока. Местное лечение состоит в тщательном уходе за кожей вокруг свища, предупреждении ее мацерации и введении в просвет свища дренажа, через который аспирируют его содержимое и промывают свищ слабым раствором молочной кислоты для инактивации протеолитических ферментов.
При полных свищах показано хирургическое лечение. Наиболее распространенными типами операций являются: иссечение свища, вшивание сформировавшегося свища в желудок или тонкую кишку, иссечение свища с одномоментной резекцией пораженного патологическим процессом дистального отдела поджелудочной железы.
ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Доброкачественные опухоли
Число доброкачественных опухолей, по данным патологоанатоми-ческого исследования, составляет 0,001—0,003% от общего числа вскрытий. Различают эпителиальные (аденомы, цистаденомы), соединительнотканные (фибромы, липомы), мышечные (лейомиомы), сосудистые (гемангиомы, лимфангиомы) и неврогенные (невриномы, ган-глионевромы) опухоли. Выделяют дизонтогенетические опухоли.
К доброкачественным опухолям поджелудочной железы относят также опухоли, исходящие из клеток панкреатических островков. Некоторые из них гормонально-активны, как, например, инсуломы и ульцерогенные аденомы — гастриномы.
Инсуломы (бета-клеточные аденомы) составляют около 75% всех эндокринных опухолей поджелудочной железы. Они продуцируют большое количество инсулина, клинически проявляются синдромом гипогликемии.
Ульцерогенная аденома (гастринома) относится к группе опухолей, исходящих из непродуцирующих инсулин клеток панкреатических островков. Отличительная особенность этих опухолей заключается в том, что их клетки продуцируют гастрин, который, воздействуя на железы слизистой оболочки желудка, способствует избыточному выделению соляной кислоты и образованию язв в желудке и двенадцатиперстной кишке. У 60% больных гастриномы бывают злокачественными, метастазируют в лимфатические узлы, печень, легкие, брюшину и кожу. У 50% больных гастриномы сочетаются с аденоматозом других желез внутренней секреции (множественный эндокринный аденома-тоз). При этом опухолевые или гиперпластические изменения наблюдаются также в гипофизе, паращитовидных железах, надпочечниках.
Клиническая картина и диагностика. Доброкачественные опухоли могут располагаться во всех отделах поджелудочной железы, быть одиночными или множественными и достигать различных размеров. Патогномоничных симптомов опухоли нет. Больные обычно жалуются на тупые, нередко постоянные боли в животе, диспепсические расстройства, запор или понос. При объективном исследовании, когда опухоль достигает больших размеров, в подложечной области нередко пальпируется опухолевое образование, не связанное с другими органами. Наиболее информативны данные ультразвукового исследования и компьютерной томографии, при которых в ткани поджелудочной железы выявляют образование с ровными контурами. Окончательный диагноз возможен только после гистологического исследования опухоли.
Инсуломы проявляются множеством клинических симптомов: в 90% случаев ожирением, нервно-психическими расстройствами (недостаток концентрации внимания, ступор, амнезия, апатия, депрессия, нарушение зрения и речи, судороги, сонливость, приступы потери сознания), у 3% больных — вегетативными расстройствами (тахикардия, стенокардия, беспокойство и страх, потливость, дрожание рук или всего тела, парестезии), абдоминальными симптомами (боли в эпигастральной области).
Для гиперинсулинизма характерна триада признаков: возникновение тяжелых приступов гипогликемии вплоть до комы на фоне голодания или физической нагрузки; резкое снижение уровня глюкозы в крови; исчезновение всех симптомов гипогликемии после внутривенного введения около 20 мл 40% раствора глюкозы.
Основными методами диагностики инсуломы являются ультразвуковое исследование и компьютерная томография поджелудочной железы, определение уровня глюкозы в крови, селективная целиакогра-фия. На ангиограммах инсулому выявляют в виде четко отграниченного и, как правило, хорошо васкуляризованного образования диаметром от 0,5 до 2—3 см; иногда обнаруживают множественные аденомы, локализованные преимущественно в области хвоста и тела поджелудочной железы.
Клиническая картина ульцерогенного аденоматоза характеризуется синдромом Золлингера — Эллисона.
Лечение. Аденому поджелудочной железы удаляют вместе с ее капсулой. При множественных аденомах хвоста и тела поджелудочной железы, а также аденомах с признаками малигнизации (злокачественные аденомы при гиперинсулинизме встречаются в 10% случаев от общего числа наблюдений) производят резекцию поджелудочной железы.
Лечение синдрома Золлингера — Эллисона возможно в трех направлениях: 1) удаление желудка как органа, в котором под влиянием гастрина образуются рецидивирующие язвы (опасность перфорации, кровотечения); 2) удаление опухоли (маловероятно ввиду множественной локализации и частой малигнизации); 3) постоянное лечение блокаторами Щ-рецепторов (циметидин, ранитидин), угнетающих желудочную секрецию. Успешное лечение этими препаратами наблюдается почти у 80% больных.
Рак
В общей структуре злокачественных новообразований рак поджелудочной железы составляет 2—7%. Наиболее часто он встречается в среднем и пожилом возрасте. Мужчины заболевают в 2 раза чаще, чем женщины.
Патологоанатомическая картина. Рак поджелудочной железы может развиваться из эпителия выводных протоков, экзо-кринных синусов и клеток панкреатических островков (инсулоцитов).
Наиболее частой локализацией опухоли является головка поджелудочной железы (70%). Гистологическое строение рака поджелудочной железы различно. Часто наблюдаются аденокарциномы, исходящие из эпителия протоков или ацинарной ткани. Значительно реже опухоль имеет строение цилиндроклеточного, альвеолярного или фиброзного рака.
Распространение рака поджелудочной железы происходит главным образом путем инфильтрирующего роста. В результате этого опухоль инфильтрирует тот или иной отдел железы и со временем прорастает в соседние ткани и органы. Часто вовлеченными в процесс оказываются общий желчный проток, двенадцатиперстная кишка, антральный отдел и тело желудка, крупные артерии и вены.
Лимфогенное метастазирование осуществляется в парапанкреати-ческие лимфатические узлы у верхнего края поджелудочной железы, а в дальнейшем в ретроперитонеальные и лимфатические узлы ворот печени. Гематогенное метастазирование происходит в печень, легкие, почки, надпочечники, кости.
Клиническая картина и диагностика. В начальных стадиях рак поджелудочной железы протекает бессимптомно или проявляется общими расстройствами — слабостью, повышенной утомляемостью, диспепсическими явлениями, тяжестью в животе. Нередко возникает понос, свидетельствующий о нарушениях внешнесекреторной функции поджелудочной железы. Позднее появляются боли в животе, похудание, желтуха. Боли носят постоянный тупой характер и временами усиливаются независимо от приема пищи, локализуются в эпигастральной области, правом или левом подреберье, что зависит от расположения опухоли и ее распространения. Нередко боли ирра-диируют в спину, поясницу, носят опоясывающий характер. Особенно сильные боли в спине бывают при опухоли тела поджелудочной железы. Они усиливаются в положении больного лежа на спине и ослабевают в положении сидя или в согнутом вперед положении.
При локализации опухоли в головке поджелудочной железы постепенно развивается желтуха. Без типичной печеночной колики появляется постепенно увеличивающийся в размерах растянутый безболезненный желчный пузырь (симптом Курвуазье). При раке, сочетающемся с желтухой, нарастает содержание билирубина в крови, в кале отсутствует стеркобилин; уменьшается, а затем исчезает уроби-линоген в моче.
При раке тела поджелудочной железы больных беспокоят интенсивные боли в эпигастральной области и спине, особенно по ночам, обусловленные прорастанием опухоли в забрюшинное пространство (область чревного сплетения), увеличением селезенки (сдавление селезеночной вены); иногда возникают тромбофлебиты вен конечностей за счет активации свертывающей системы крови.
В результате нарушения внешнесекреторной функции поджелудочной железы значительно снижается концентрация ее ферментов (амилазы, трипсина, липазы) в дуоденальном содержимом. В кале появляется большое количество непереваренных мышечных волокон и капель нейтрального жира.
У 30—40% больных раком поджелудочной железы повышается содержание амилазы крови, наблюдаются нарушения углеводного обмена (гипергликемия, глюкозурия, изменения гликемической кривой при двойной нагрузке глюкозой).
Диагноз рака поджелудочной железы в поздних стадиях заболевания больших трудностей не представляет. На ранних стадиях диагностика возможна при применении специальных инструментальных методов исследования.
Рентгенологическое исследование позволяет выявить только ряд косвенных симптомов рака поджелудочной железы, обусловленных давлением опухоли на соседние органы: деформацию и смещение желудка кпереди, смещение и развертывание «подковы» двенадцатиперстной кишки, сдавление ее нисходящей ветви с дефектом по внутреннему контуру. При раке тела поджелудочной железы рентгенологически можно выявить смещение малой кривизны желудка с утолщением и инфильтрацией складок слизистой оболочки в этой области, смещение и сдавление тощей кишки в области связки Трейтца. Однако эти рентгенологические данные являются поздними признаками рака поджелудочной железы. Относительно ранняя его диагностика возможна при применении специальных инструментальных методов исследования. Наиболее информативными из них являются: компьютерная томография, при которой выявляют наличие небольшой тени опухоли с нечеткими контурами; селективная ангиография, при которой обнаруживают изменения архитектоники сосудов, появление зон гиперваскуляризации за счет вновь образованных сосудов; ретроградная панкреатография, выявляющая изменения нормального рисунка про-токовой системы, смещение или «ампутацию» протоков поджелудочной железы; ультразвуковое сканирование, позволяющее установить изменение плотности ткани поджелудочной железы, увеличение ее размеров, иногда наличие опухолевого узла. При ультразвуковом исследовании можно выявить значительное увеличение размеров желчного пузыря.
Дифференциальная диагностика. Дифференциальный диагноз следует проводить с заболеваниями желчевыводящих путей (холедохолитиаз, стриктуры, опухоли), кистой поджелудочной железы, хроническим панкреатитом, раком большого сосочка двенадцатиперстной кишки, раком желудка.
Лечение. На ранних стадиях заболевания применяют радикальные операции, на поздних — паллиативные. Выбор метода операции зависит от локализации опухоли.
При раке головки и тела поджелудочной железы показана тотальная панкреатодуоденэктоми я. Операция заключается в удалении всей поджелудочной железы, двенадцатиперстной кишки, антрального отдела желудка, дистальной части общего желчного протока, селезенки и регионарных лимфатических узлов. Операцию завершают наложением двух анастомозов — холедохоеюноанастомоза и гастроеюноанастомоза.
При опухоли головки поджелудочной железы небольших размеров показана правосторонняя гемипанкреатодуоденэктомия. Операция заключается в удалении правой половины поджелудочной железы, двенадцатиперстной кишки и дистальной резекции половины желудка. Селезенку не удаляют. В конце операции накладывают холедохоею-ноанастомоз и гастроэнтероанастомоз. Оставшуюся дистальную часть поджелудочной железы анастомозируют с просветом тощей кишки (панкреатоеюноанастомоз) либо ушивают наглухо.
При раке хвоста поджелудочной железы выполняют левостороннюю гемипанкреатэктомию. Операция заключается в резекции левой половины поджелудочной железы с одновременной спленэктомией. Культю проксимальной половины поджелудочной железы ушивают наглухо.
Радикальные операции относятся к числу технически сложных и труднопереносимых больными. Послеоперационная летальность составляет 10—30%. Пятилетняя выживаемость низкая — до 5%.
Паллиативные операции при неоперабельных формах рака поджелудочной железы применяют для устранения обтурационной желтухи и ее последствий. Наиболее распространенными паллиативными би-лиодигестивными операциями являются операции холецисто- и холе-дохоеюностомии на выключенной по Ру петле тощей кишки.
В результате билиодигестивных операций уменьшаются или исчезают желтуха, кожный зуд, боли и диспепсические явления, благодаря чему продлевается жизнь больного.
При резком сужении опухолью просвета двенадцатиперстной кишки может возникнуть необходимость в гастроэнтеростомии для обеспечения эвакуации желудочного содержимого в тонкую кишку.
СЕЛЕЗЕНКА
Селезенка — непарный орган брюшной полости, расположенный в левом подди-афрагмальном пространстве. Масса ее составляет в среднем 150—250 г. Селезенка фиксирована в левом поддиафрагмальном пространстве хорошо выраженным связочным аппаратом: диафрагмально-селезеночной, селезеночно-почечной, селезеночно-толстоки-шечной и желудочно-селезеночной связками.
Артериальное кровоснабжение осуществляет селезеночная артерия (ветвь чревного ствола). Венозный отток происходит по одноименной вене в систему воротной вены.
Иннервацию селезенки осуществляет чревное сплетение.
Кровеносные сосуды входят в ткань селезенки в области ее ворот и следуют по ходу трабекул, образованных соединительной тканью. Трабекулярные артерии входят как в красную, так и в белую пульпу селезенки. Белая пульпа образована селезеночными лимфоидными узелками, а также лимфоидными периартериальными влагалищами, окружающими центральные артерии. Большинство клеточных элементов белой пульпы представлено лимфоцитами, плазматическими клетками и макрофагами. Красная пульпа состоит из трабекул ретикулярных клеток, образующих ячеистую структуру красной пульпы. Между трабекулами расположены извилистые сосудистые синусы, связывающие артериальную и венозную системы селезенки.
Функции селезенки многочисленны. Селезенка принимает участие в разрушении и фагоцитозе старых эритроцитов и тромбоцитов. В период эмбрионального развития и в детском возрасте селезенка обладает функцией эритропоэза. Белая пульпа селезенки является основным местом образования лимфоцитов. Селезенка является депо тромбоцитов. В норме около 30% их сохраняется в селезенке. Разрушение тромбоцитов происходит здесь же.
Селезенка активно участвует в выработке некоторых фракций иммуноглобулинов. Ретикулоэндотелиальные клетки ее задерживают имеющиеся в циркулирующей крови витальные красители, металлы, находящиеся в коллоидном состоянии, возбудителей некоторых инфекционных заболеваний (особенно пневмококки). Селезенка также активно участвует в обмене железа в организме и гуморальной регуляции деятельности костного мозга.
ПОРОКИ РАЗВИТИЯ
К данной патологам относятся врожденное отсутствие селезенки, удвоение селезенки, добавочные селезенки. Добавочные селезенки являются наиболее частым пороком развития и локализуются в области ворот, в ее связках и большом сальнике. К пороку развития можно отнести и так называемую блуждающую селезенку, обладающую чрезмерной подвижностью вследствие удлинения ее ножки. Однако это может произойти и в период постнатального развития вследствие увеличения селезенки.
ПОВРЕЖДЕНИЯ СЕЛЕЗЕНКИ
Выделяют открытые и закрытые повреждения.
Открытые повреждения могут быть трансабдоминальными и трансторакальными, а по характеру ранящего предмета — огнестрельными, колото-резаными и т. п. В большинстве случаев отмечают повреждение соседних органов брюшной или грудной полости (желудка, толстой кишки, поджелудочной железы, почки, диафрагмы, левого легкого).
Клиническая картина и диагностика. Симптоматика открытого повреждения селезенки зависит от характера самого ранения и повреждения соседних органов. На первый план выступают симптомы внутреннего кровотечения и шока (бледность кожных покровов, тахикардия, снижение артериального давления, снижение уровня гемоглобина и гематокрнта, ОЦК). По мере излияния крови в брюшную полость присоединяются симптомы раздражения брюшины, а при трансторакальных ранениях — симптомы гемоторакса. В случае скопления крови в поддиафрагмальном пространстве нередко наблюдают симптом «ваньки-встаньки» (В. Н. Розанова): больной лежит на левом боку с приведенными к животу ногами. При попытке перевернуть его на спину или другой бок он занимает прежнее положение вследствие массивного раздражения нервных рецепторов диафрагмальной брюшины. Значительное количество излившейся крови в брюшную полость можно определить перкуторно. При пальпации определяют резистентность или легкое напряжение мышц передней брюшной стенки, положительный симптом Щеткина — Блюмберга. При повреждении полых органов с развитием распространенного перитонита, забрюшинной гематомы, шока, гемопневмоторакса и др. клиническая картина может меняться.
Значительные трудности в диагностике могут возникнуть в случае изолированного повреждения селезенки, когда бурные клинические проявления кровотечения отсутствуют. В такой ситуации весьма информативными могут оказаться экстренная лапароскопия, а при технической невозможности ее выполнения — лапароцентез с введением в брюшную полость «шарящего» катетера. При этом для обнаружения крови производят фракционное промывание брюшной полости. Если из левого поддиафрагмального пространства по катетеру получена кровь, следует думать о повреждении ткани селезенки. Диагноз уточняют при ультразвуковом исследовании и компьютерной томографии.
Лечение. Осуществляют экстренное оперативное вмешательство для создания надежного гемостаза и предупреждения инфицирования брюшной полости. Чаще выполняют спленэктомию. Современные представления о многочисленных важных функциях селезенки значительно сузили показания к выполнению спленэктомии. При небольших повреждениях, особенно в области одного из ее полюсов, а также при поверхностных повреждениях можно применить шов селезенки (для предотвращения прорезывания швов используют участок большого сальника или синтетические материалы), резекцию одного из полюсов, перевязку селезеночной артерии. Эффективно также применение специального медицинского клея, фибриногена. Органосохраняющие операции не могут быть выполнены при обширных повреждениях селезенки, при ее размозжении, разрыве в области ворот и отрыве селезеночной ножки.
Закрытые повреждения селезенки возникают при тупой травме живота, падении с высоты. Описаны спонтанные разрывы нормальной селезенки. Они чаще наблюдаются при различных заболеваниях, сопровождающихся увеличением селезенки и изменением ее структуры (малярия, инфекционный мононуклеоз). Особое место занимают случайные ятрогенные повреждения селезенки во время операций на органах верхней части брюшной полости (гастрэктомия, резекция желудка, поджелудочной железы и т.д.).
При тупой травме живота выделяют одномоментный и двухмомен-тный разрывы селезенки. При одномоментном разрыве с самого начала имеется дефект капсулы органа и в этом случае на первый план выступают симптомы внутреннего кровотечения большей или меньшей интенсивности. При двухмоментном разрыве вначале образуется под-капсульная гематома без нарушения целостности капсулы селезенки и лишь спустя некоторое время (от нескольких дней до нескольких недель) под влиянием даже незначительной физической нагрузки происходит разрыв капсулы селезенки с опорожнением гематомы в брюшную полость и развитием внутреннего кровотечения. Такой механизм разрыва селезенки при ее закрытом повреждении наблюдают почти у
15% пострадавших. В этом случае диагноз может представлять определенные трудности. Важная роль принадлежит тщательно собранному анамнезу с выяснением факта закрытой травмы живота.
Клиническая картина и диагностика. Клиническая картина при тупой травме живота с повреждением селезенки, как и при ее открытых повреждениях, зависит от сочетанных травм других органов брюшной полости. При установлении диагноза наиболее ценными методами являются лапароскопия, лапароцентез с использованием «шарящего» катетера.
Лечение. Повреждения селезенки требуют оперативного вмешательства. В случае двухмоментных разрывов операцией выбора является спленэктомия.
При случайном повреждении селезенки во время операций на соседних органах брюшной полости применяют как спленэктомию, так и органосохраняющие вмешательства. В последнее время при случайных повреждениях селезенки начали применять аутотрансплантацию фрагментов селезеночной ткани в карман, выкроенный из большого сальника. Обследования в отдаленные сроки после таких операций подтвердили наличие функционирующей селезеночной ткани, а частота различных инфекционных осложнений у этой группы больных была меньше, чем у больных, перенесших аналогичные операции на органах брюшной полости со спленэктомией. При разрыве увеличенной вследствие различных болезней селезенки показана экстренная спленэктомия.
ЗАБОЛЕВАНИЯ СЕЛЕЗЕНКИ
Инфаркт селезенки. Причиной развития инфаркта служат тромбоз или эмболия сосудов этого органа. Инфаркт селезенки развивается при бактериальном септическом эндокардите, стенозе левого атрио-вентрикулярного отверстия, портальной гипертензии, брюшном тифе. Заболевание начинается внезапно с интенсивных резких болей в левом подреберье, сопровождающихся лихорадкой, выраженной тахикардией, рвотой, парезом кишечника. Выраженность клинической картины зависит от обширности инфаркта. Мелкие инфаркты могут протекать с минимальными клиническими проявлениями или бессимптомно. В большинстве случаев наступает самоизлечение с организацией и рубцеванием зоны инфаркта. Реже наблюдаются инфицирование и гнойное расплавление пораженной зоны с образованием абсцесса селезенки, иногда в зоне инфаркта развивается ложная киста.
Абсцесс селезенки. Наиболее частыми причинами развития абсцесса являются септикопиемия, нагноение инфаркта селезенки или ранее существовавшей гематомы, переход инфекции контактным путем с соседних органов. Абсцессы бывают одиночные и множественные. Клинически абсцесс проявляется тупыми болями в левом подреберье, усиливающимися при движении больного, повышением температуры до 39 °С, тахикардией; в анализах крови выявляют высокий лейкоцитоз. При массивных абсцессах можно прощупать увеличенную селезенку, а при локализации гнойника в ее нижнем полюсе — определить симптом флюктуации. Если абсцесс располагается в верхнем полюсе селезенки, то нередко выявляют «сочувственный» выпот в левой плевральной полости, который в последующем может инфицироваться и стать причиной развития эмпиемы плевры.
Осложнениями абсцесса селезенки являются прорыв его в свободную брюшную полость с развитием общего гнойного перитонита или в просвет полого органа (желудка, толстой кишки), реже — в почечную лоханку. Клинически такие осложнения проявляются наличием гноя в рвотных массах, кале, моче.
Среди инструментальных методов исследования наиболее информативны ультразвуковое исследование, компьютерная томография, радиоизотопное сканирование селезенки.
Лечение. Осуществляют спленэктомию.
Кисты селезенки. Различают непаразитарные и паразитарные кисты.
Непаразитарные кисты могут быть истинными (покрытые изнутри эндотелием) и ложными (не имеющими эндотелиальной выстилки). Истинные кисты являются врожденными и возникают в результате нарушения эмбриогенеза. Ложные кисты являются приобретенными и возникают после травм, инфекционных заболеваний и как следствие перенесенного инфаркта селезенки. Кисты могут быть одиночными и множественными. Их объем варьирует от нескольких десятков миллилитров до 5 л и более. Содержимое кисты имеет серозный или геморрагический характер.
Паразитарные кисты селезенки наиболее часто вызываются эхинококками, значительно реже цистицерком и исключительно редко — альвеококком. Паразиты могут проникнуть в селезенку гематогенным, реже лимфогенным путем. Длительность заболевания составляет от нескольких до 15 лет и более. По мере развития паразита соседние органы брюшной полости оттесняются, развивается атрофия ткани селезенки.
Клиническая картина и диагностика. Клинические проявления непаразитарных кист разнообразны. Большинство больных отмечают постоянные тупые боли в левом подреберье с иррадиацией в левое плечо, при больших размерах кист — симптомы сдав-ления соседних органов брюшной полости (желудка, толстой кишки). При физикальном исследовании можно отметить выбухание в левом подреберье, некоторую асимметрию живота, пропальпировать увеличенную гладкую безболезненную селезенку. В случае локализации кисты в нижнем полюсе селезенки можно выявить симптомы флюктуации.
Клинические проявления паразитарных кист селезенки аналогичны таковым при непаразитарных кистах. Как осложнение эхинококкоза селезенки могут развиваться нагноение кисты с клиническими проявлениями абсцесса или разрыв кисты.
Для диагностики кист используют те же методы, что и при абсцессах селезенки, включая ангиографию (цилиакографию). При этом на рентгеновском снимке определяют бессосудистую зону в проекции кисты селезенки, оттесняющую интраорганные сосуды. С помощью компьютерной томографии в селезенке выявляют четко очерченное образование низкой плотности. В диагностике паразитарных кист селезенки, кроме вышеуказанных способов, применяют реакцию Касони и латекс-тест.
Лечение. Как при паразитарных, так и при непаразитарных кистах селезенки осуществляют спленэктомию.
Опухоли селезенки. Различают доброкачественные и злокачественные опухоли селезенки. К доброкачественным опухолям относят гемангиомы, лимфангиомы, эндотелиомы. Встречаются они очень редко, не имеют характерной клинической симптоматики. По мере развития опухоли появляются боли в левом подреберье с иррадиацией в левое плечо. К злокачественным опухолям относят различные типы сарком (фибросаркома, лимфосаркома и т. п.). Эти опухоли характеризуются довольно бурным ростом и скудной клинической картиной на ранних стадиях болезни. По достижении опухолью больших размеров появляются симптомы интоксикации, кахексия, асцит.
Основные принципы диагностики опухолей селезенки такие же, как и при указанных выше неопухолевых поражениях.
Лечение. При доброкачественных опухолях спленэктомия приводит к излечению, при злокачественных эта операция возможна только на ранних стадиях болезни. При значительных размерах опухоли спленэктомия является паллиативным вмешательством.
ГИПЕРСПЛЕНИЗМ
В клинической практике принято выделять гиперспленизм и спле-номегалию. Под спленомегалией понимают увеличение селезенки в размерах. Гиперспленизм — чрезмерное разрушение селезенкой клеточных элементов крови, что клинически проявляется снижением числа эритроцитов, лейкоцитов или тромбоцитов в циркулирующей крови. Спленомегалия часто сопровождается гиперспленизмом, но такое сочетание не является обязательным. Гиперспленизм может возникать и без выраженной спленомегалии.
Выделяют первичный гиперспленизм, вызванный гипертрофией селезенки (причина его неясна), и вторичный, возникающий при некоторых заболеваниях. Первичный гиперспленизм может быть врожденным (гемолитическая микросфероцитарная анемия, большая талассе-мия, гемоглобинопатия и т. д.) и приобретенным (тромбоцитопениче-ская пурпура, нейтропения и панцитопения). Вторичный гиперспленизм может быть обусловлен брюшным тифом, туберкулезом, сарко-идозом (болезнью Бека), малярией, циррозом печени, тромбозом воротной или селезеночной вены, ретикулезом (например, болезнь Гоше), амилоидозом, лимфогранулематозом и многими другими болезнями.
Увеличенная селезенка может быть обнаружена пальпаторно, особенно в положении больного лежа на правом боку. При обзорной рентгенографии органов брюшной полости можно выявить косвенные признаки спленомегалии по характеру смещения соседних органов (желудка, толстой кишки), особенно после предварительной инсуф-фляции воздуха в просвет этих органов. Наиболее ценные данные о
размерах селезенки получают при ультразвуковом исследовании и компьютерной томографии. Широко используют и радионуклидное исследование — сканирование селезенки с радиоактивным технецием или индием.
Гиперспленизм проявляется снижением количества форменных элементов крови, что может быть выявлено при обычном исследовании гемограммы больного. Следует помнить, что иногда показатели гемограммы могут быть близкими к норме за счет усиления кроветворной функции костного мозга, которая при патологических условиях может возрастать в 5—10 раз. Поэтому зачастую прибегают к исследованию мазка костного мозга, обращая особое внимание на количество рети-кулоцитов, соотношение элементов красного и белого ростков и т. п. При некоторых заболеваниях в периферической крови можно обнаружить аномальные (сфероцитарные) эритроциты, клетки-мишени (при талассемии). При гемолитических анемиях обращают внимание на повышение уровня непрямого билирубина, увеличение концентрации стеркобилина в кале. Аномальные эритроциты, как правило, в функциональном отношении неполноценны и менее стойки, чем нормальные. На этом явлении основан способ определения осмотической стойкости эритроцитов. Для неполноценных эритроцитов характерно снижение их осмотической стойкости.
Первичный гиперспленизм. Различают врожденный и приобретенный гиперспленизм.
Гемолитическая микросфероцитарная анемия (врожденная гемолитическая желтуха, ефероцитарная анемия, микросфероцитарная анемия) является заболеванием, наследуемым по аутосомно-доминантному признаку и связанным с дефектом строения мембраны эритроцитов. Мембрана становится хорошо проницаемой для натрия, что приводит к увеличению осмотического давления внутри эритроцита, и он приобретает сферическую форму, становится более хрупким. Неполноценные эритроциты захватываются и подвергаются быстрому разрушению селезеночной тканью. Это приводит к развитию гемолитической анемии. Существует также мнение, что при этом заболевании селезенка продуцирует избыточное количество аутогемолизинов. За счет усиленной работы селезенки (гиперфункции) возникает спленомегалия.
Клиническая картина и диагностика. Заболевание начинается в раннем возрасте, а иногда с момента рождения. Оно может протекать с развитием гемолитических кризов, при которых наблюдается быстрое (в течение нескольких дней) нарастание анемии и клинических проявлений гемолитической желтухи. В этот период у больного возникают тошнота, рвота, боли в верхней части живота, тахикардия, одышка, гипертермия, бледность кожных покровов, которая быстро сменяется нарастающей желтухой. У детей подобные кризы могут привести к смерти. Нередко гемолитические кризы провоцируются острыми инфекционными заболеваниями.
При бескризовом течении заболевания на первый план выступают симптомы анемии и гемолитической желтухи. Анемия весьма умеренная, желтуха редко бывает интенсивной. В этих случаях заболевание может впервые отчетливо проявиться в подростковом, юношеском и даже зрелом возрасте. В связи с повышением уровня билирубина в крови у 50—60% больных с гемолитической микросферонитарной анемией возникает желчнокаменная болезнь, что клинически проявляется приступами печеночной колики, острого холецистита или первично-хронического холецистита. Поэтому наличие конкрементов в желчном пузыре у детей, особенно младше 10 лет, является показанием к тщательному обследованию для выявления гемолитической микро-сфероцитарной анемии.
При физикальном обследовании определяют увеличенную селезенку; печень, как правило, не увеличена. Ведущим методом диагностики является лабораторное исследование крови, при котором обнаруживают микросфероцитоз, снижение осмотической стойкости эритроцитов. В норме эритроциты начинают разрушаться в 0,47% растворе хлорида натрия, при гемолитической анемии этот процесс начинается уже в 0,6% растворе хлорида натрия. В общем анализе крови отмечают ретикулоцитоз. При исследовании мазка костиого мозга выявляют гиперплазию красного ростка. Во время криза наблюдают ретикуло-цитопению и гипоплазию красного ростка костного мозга. После криза число ретикулоцитов существенно увеличивается. Характерными признаками гемолитической анемии являются анемия, увеличение концентрации непрямого билирубина в крови, повышенное содержание уробилина в моче и стеркобилина в кале.
Лечение. Консервативное лечение дает временный эффект и не предупреждает дальнейшего прогрессирования болезни и развития гемолитического криза. Радикальным способом лечения гемолитической микросфероцитарной анемии является спленэктомия. Хотя основная причина болезни кроется не в гиперплазии селезенки и повышении ее функции, а в характере изменений эритроцитов, спленэктомия приносит больному полное выздоровление. В результате этой операции длительность жизни эритроцитов (даже неполноценных, аномальных) существенно увеличивается, исчезают анемия и желтуха. Если во время операции выявлены конкременты в желчном пузыре, то следует дополнить спленэктомию холецистэктомией (если позволяет общее состояние пациента). Оперативное вмешательство целесообразно выполнять в период ремиссии болезни, а у детей — в возрасте 3—4 лет.
Большая талассемия (средиземноморская анемия, анемия Кули) также является врожденным заболеванием, наследуемым по аутосом-но-доминантному признаку. В основе болезни лежит выработка неполноценных эритроцитов вследствие генетических нарушений строения пептидных цепей гемоглобина.
Клиническая картина и диагностика. Легкие формы заболевания протекают бессимптомно и могут быть выявлены только при гематологическом исследовании. Тяжелые формы болезни проявляются желтушной окраской кожного покрова пациента, выраженными нарушениями строения черепа (большая голова, сильно развитые челюсти, западение корня носа). Нередко больные склонны к инфекционным заболеваниям. При обследовании выявляют увеличение печени и селезенки. При гематологическом исследовании обнаруживают характерные клетки-мишени, повышенную осмотическую резистентность эритроцитов. Отмечают также увеличение количества лейкоцитов и ретикулоцитов в крови при нормальном содержании тромбоцитов. Уровень билирубина в крови несколько выше нормы, концентрация сывороточного железа значительно повышена. Желчные конкременты образуются у 25% больных большой талассемией.
Лечение. Спленэктомия при талассемии является паллиативным вмешательством и позволяет лишь уменьшить число проводимых ге-мотрансфузий и ликвидировать неудобства, связанные с чрезмерно увеличенной селезенкой.
Гемолитическая аутоиммунная анемия является аутоиммунным заболеванием. В основе его лежит образование антител к собственным эритроцитам. Болезнь провоцируют различные физические и химические агенты, лекарственные вещества, микробная инфекция. Эритроциты больного имеют в своем составе аномальные протеины, а сыворотка крови содержит гамма-глобулины, способные вызывать агглютинацию как собственных, так и нормальных донорских эритроцитов.
Клиническая картина и диагностика. Клинически заболевание протекает почти так же, как и гемолитическая микросфероцитарная анемия. Однако для аутоиммунной гемолитической анемии характерны начало заболевания в зрелом возрасте (чаще у женщин старше 50 лет), склонность к гемолитическим кризам, более тяжелое по сравнению с микросфероцитарной формой течение. Спле-номегалия отмечается у половины больных, при этом довольно часто выявляют и гепатомегалию. Значительно реже наблюдают увеличение лимфатических узлов. В анализах крови — умеренная анемия, повышение уровня непрямого билирубина, малоизмененная осмотическая резистентность эритроцитов. Прямая и непрямая реакции Кумбса у большинства пациентов положительны.
Лечение. Необходимо устранение сенсибилизирующих факторов, назначение средств, подавляющих выработку антител (кортико-стероиды), трансфузии отмытых донорских эритроцитов. В связи с тем что агглютинированные антителами эритроциты поглощаются и разрушаются всей ретикулоэндотелиальной системой, а не только селезенкой, спленэктомия далеко не всегда приводит к желаемым результатам. Показаниями к спленэктомии служат невозможность применения кортикостероидных препаратов и неэффективность стероидной терапии, частые гемолитические кризы, выраженные явления гипер-спленизма. Если большая часть эритроцитов разрушается селезенкой, а не печенью, то можно рассчитывать на эффективность спленэктомии, существенное удлинение периодов ремиссии. Однако после спленэктомии возможны рецидивы болезни и даже развитие гемолитических кризов, что связано с сохраненной функцией ретикулоэндотелиальной системы других органов. Поэтому после операции приходится продолжать стероидную терапию.
Тромбоцитопеническая пурпура (болезнь Всрльгофа) проявляется геморрагическим диатезом.
Этиология и патогенез. Этиологические факторы заболевания не выяснены. Определенная роль принадлежит нейроэндокринным нарушениям, бактериальной и вирусной инфекции. Выделяют острую и хроническую формы заболевания. Острая форма встречается в основном у детей и развивается в течение нескольких месяцев, недель или даже дней. Хроническая форма заболевания протекает годами и обнаруживается чаще у женщин, особенно в период полового созревания и в молодом возрасте.
В патогенезе геморрагического синдрома ведущая роль принадлежит тромбоцитопении, нарушению адгезивных свойств тромбоцитов, нарушениям в системе гемостаза с выраженной гипокоагуляцией. При тромбоцитопенической пурпуре отмечают повышенную проницаемость и ломкость капилляров. Роль селезенки в патогенезе этого заболевания до конца не известна. Считают, что она участвует в выработке ан-титромбоцитарных антител, активно захватывает и разрушает циркулирующие тромбоциты и, возможно, оказывает угнетающее действие на тромбоцитообразующую функцию костного мозга.
Клиническая картина и диагностика. Клинически заболевание проявляется подслизистыми и подкожными кровоизлияниями, маточными кровотечениями (особенно у женщин в репродуктивном периоде), кровотечениями из носа, десен. Несколько реже бывают желудочно-кишечные кровотечения, макрогематурия, кровоизлияния в мозг. Характерны кровотечения из поверхностных ран и царапин, при которых у здорового человека кровотечение отсутствует или оно бывает незначительным.
При объективном исследовании можно обнаружить бледность кожных покровов; множественные подкожные кровоизлияния, чаще расположенные на передней поверхности груди, живота, конечностей; подслизистые кровоизлияния во рту, глазных яблоках. Диаметр подкожных кровоизлияний варьирует от нескольких миллиметров до нескольких сантиметров. Печень и селезенка не увеличены. Лишь у 2% больных удается пальпаторно обнаружить увеличенную селезенку. Симптом Кончаловского — Румпеля — Лееде (жгута) положительный.
В общем анализе крови выявляют анемию, которая может быть значительно выраженной: число тромбоцитов снижено до 50X107 л и менее. В момент обострения заболевания и особенно при кровотечении число тромбоцитов может снижаться до нуля. При исследовании свертывающей системы крови определяют гипокоагуляцию, удлинение времени кровотечения, образование рыхлого кровяного сгустка, отсутствие его ретракции при нормальном времени свертывания крови и про-тромбиновом времени. В мазках костного мозга выявляют значительное снижение числа тромбоцитообразующих форм мегакариоцитов.
Лечение. Выбор метода лечения тромбоцитопенической пурпуры зависит от возраста больного, длительности тромбоцитопении, формы заболевания и эффективности проводимого ранее лечения. Наиболее благоприятен прогноз у детей 16 лет с острой формой болезни. Адекватная кортикостероидная терапия позволяет повысить число тромбоцитов в крови, уменьшить явления геморрагического диатеза, а в последующем добиться выздоровления или продолжительной клинической ремиссии почти у 80% больных. Лечение острой формы заболевания у взрослых представляет более сложную задачу. Возможно применение как стероидной терапии, так и спленэктомии. Оперативное вмешательство на фоне кровотечения сопряжено с довольно большим риском, однако оно необходимо, когда кровотечение не останавливается консервативными мероприятиями. Летальность при операциях на высоте кровотечения достигает 3—5%.
Среди консервативных методов лечения хронических форм тромбоцитопенической пурпуры наиболее эффективны терапия кортико-стероидными препаратами, переливание крови и ее компонентов. Консервативное лечение обеспечивает повышение числа тромбоцитов крови у 60% больных, хотя длительный клинический эффект наблюдают только у 15—30%. При неэффективности консервативного лечения, частых рецидивах заболевания показана спленэктомия. Во время операции необходимо помнить о возможности существования добавочных селезенок (оставление их может служить причиной неэффективности операции). Длительные ремиссии после спленэктомии наблюдают у 60—90% больных. Кортикостероидная терапия после спленэктомии и терапия иммунодепрессивными (азатиоприн), а также цитостатиче-скими (циклофосфан) препаратами становятся более эффективными.
Вторичный гиперспленизм. При некоторых острых инфекционных заболеваниях наблюдают частичный гемолиз эритроцитов, снижение их выработки костным мозгом. Это наблюдается при гиперреактивности ретикулоэндотелиальной системы, что приводит к развитию спленомегалии и в последующем к вторичному гиперспленическому синдрому. Адекватное лечение острой инфекции ликвидирует гиперспленизм.
Хронические воспалительные и паразитарные заболевания могут сопровождаться гиперплазией тканей ретикулоэндотелиальной системы, что также ведет в последующем к гиперспленизму.
Одной из наиболее частых причин вторичного гиперспленизма является малярия. При малярии селезенка может достигать огромных размеров, вызывая выраженные явления гиперспленизма, сдавление окружающих органов. Кроме того, значительно увеличенная селезенка представляет реальную угрозу спонтанного разрыва. В этих случаях показана спленэктомия.
Повышение давления в системе воротной вены при портальной гипертензии, вызванной чаще всего циррозом печени, и при тромбозе селезеночной вены приводит к увеличению селезенки, спленомегалии, т. е. вторичному гиперспленизму, проявляющемуся панцитопенией. Спленэктомия ликвидирует явления гиперспленизма. Иногда оперативное вмешательство дополняют созданием портокавального анастомоза для снижения давления в системе воротной вены. При портальной гипертензии спленэктомия не приводит к существенному уменьшению венозного давления в системе воротной вены.
Болезнь Гоше проявляется образованием в крови пациента аномальных липоидов — керазина. Он активно захватывается клетками ретикулоэндотелиальной системы и прежде всего селезенкой. В этих органах образуются так называемые клетки Гоше (керазиновые). Этиология заболевания изучена мало. Имеются сообщения о семейном ее характере.
Клиническая картина и диагностика. Болезнь может протекать в двух формах — острой и хронической. При острой форме быстро развиваются спленомегалия и гиперспленизм, что клинически проявляется геморрагическим диатезом. Чаще заболевают дети. Хроническая форма болезни начинается в детском возрасте, протекает длительно, иногда несколько десятков лет. До развития спленомегалии симптомы заболевания не выражены. Для стадии развернутых проявлений заболевания характерны желтоватая или коричневая окраска кожи кистей рук и лица вследствие отложения гемосидерина, гиперемия и припухлость кожи в области крупных суставов, характерное утолщение конъюнктивы, иногда булавовидные утолщения в нижней трети бедра. Характерны также умеренная анемия, реже симптомы геморрагического диатеза.
При объективном исследовании выявляют выраженную спленоме-галию (иногда селезенка занимает почти всю брюшную полость), умеренное увеличение печени. Периферические лимфатические узлы обычно не увеличены. Желтухи и асцита, как правило, не бывает.
В анализах крови выявляют умеренную анемию, лейкопению, тром-боцитопению. Диагноз подтверждают при обнаружении клеток Гоше в пунктате костного мозга или селезенки.
Лечение. Единственным эффективным способом лечения болезни Гоше является спленэктомия, хотя и она не приводит к полному выздоровлению пациента. После операции исчезают признаки гиперспленизма и неудобства, причиняемые пациенту чрезмерно увеличенной селезенкой.
Лимфогранулематоз (болезнь Ходжкина) — системное опухолевое заболевание лимфоидной ткани. Морфологически выявляют инфильтрацию ткани лимфатических узлов многоядерными гигантскими клетками Березовского — Штернберга и их предшественниками — одноядерными клетками Ходжкина. Опухолевый процесс наиболее часто поражает лимфатические узлы (шейные, забрюшинные, медиастиналь-ные, паховые), а также органы, богатые лимфоидной тканью, — селезенку, печень, костный мозг. Поражение других внутренних органов наблюдают крайне редко. Заболевают чаще мужчины в возрасте 20—40 лет.
Клиническая картина и диагностика. Заболевание протекает циклически с периодами ремиссий и обострений и продолжается в среднем 2—5 лет. Имеются сообщения о так называемых доброкачественных вариантах течения болезни длительностью 10 лет и более. Известны наблюдения чрезвычайно бурного течения лимфогранулематоза, когда смерть больного наступает уже на первом году заболевания.
В начале развития болезни процесс носит чаще локальный, ограничений характер с поражением определенной группы лимфатических узлов. На более поздних стадиях в опухолевый процесс вовлекаются лимфатические узлы различной локализации, селезенка, печень и т. д. В этот период лимфогранулематоз проявляется общей слабостью, недомоганием, снижением трудоспособности, кожным зудом. Наблюдается лихорадочная реакция, которая носит типичный волнообразный характер: периоды высокой гипертермии сменяются периодами с нормальной температурой тела. По мере прегрессирования заболевания периоды гипертермии возникают все чаще. Весьма характерным симптомом является увеличение лимфатических узлов, причем в начале болезни процесс захватывает чаще всего шейные лимфатические узлы (заднюю группу). При пальпации выявляют их мягкоэластическую консистенцию, безболезненность, подвижность. В поздних стадиях развития заболевания лимфатические узлы становятся плотными, спаянными между собой, неподвижными. При поражении медиастинальной группы лимфатических узлов можно обнаружить ряд симптомов, обусловленных сдавлением жизненно важных органов средостения, — синдром верхней полой вены, синдром Бернара — Горнера, осиплость голоса и т. п. (см. «Опухоли средостения»). При поражении абдоминальных и забрюшинных групп лимфатических узлов возникает упорный понос. В последующем нарастают симптомы интоксикации, кахексия.
Приблизительно у /з больных при объективном исследовании можно обнаружить спленомегалию. Селезенка плотноэластической консистенции, поверхность ее гладкая, пальпация вызывает умеренную болезненность. Значительно увеличенная селезенка иногда вызывает спонтанные боли в левом подреберье. Опухолевый процесс может избирательно поражать только селезенку, и тогда заболевание протекает более доброкачественно. При значительной спленомегалии часто развиваются периспленит, повторные инфаркты селезенки, что клинически проявляется в виде интенсивных болей в левом подреберье, гипертермии.
В анализе крови выявляют умеренную гипохромную анемию, ней-трофилез, лимфопению, реже эозинофилию, тромбоцитопению. СОЭ, как правило, значительно увеличена. В случае медиастинальной формы лимфогранулематоза при рентгенологическом исследовании выявляют расширенные тени средостения.
В последние годы в программу клинического обследования больных лимфогранулематозом введена операция диагностической лапаротомии с биопсией брыжеечных, парааортальных лимфатических узлов, печени и спленэктомией. Это позволяет установить оптимальный способ лечения и установить прогноз течения заболевания.
Лечение. Спленэктомия показана при локальной форме лимфогранулематоза, выраженном гиперспленизме и спленомегалии со сдавлением органов грудной и брюшной полостей. После установления стадии заболевания применяют рентгенотерапию пораженной группы лимфатических узлов и курс лечения цитостатическими средствами.
Хронический лейкоз является системным заболеванием органов кроветворения. Выделяют два наиболее часто встречающихся типа хронических лейкозов — хронический миелолейкоз и хронический лимфолейкоз. Для хронического миелолейкоза характерно появление в крови незрелых клеток, возникающих из клеток — предшественниц миелопоэза. Это сопровождается гиперплазией костного мозга, селезенки, печени, лимфатических узлов. При хроническом лимфолейкозе в крови появляются незрелые клетки лимфоидного ряда, что сопровождается гиперплазией лимфоидных структур лимфатических узлов, селезенки, печени, реже других органов. Заболевание возникает в зрелом и пожилом возрасте, чаще у мужчин.
Клиническая картина и диагностика. Больные отмечают общую слабость, утомляемость, снижение работоспособности, потливость, субфебрилитет. Одним из первых симптомов болезни является увеличение подкожных лимфатических узлов, что особенно характерно для хронического лимфолейкоза. При хроническом мие-лолейкозе увеличение лимфатических узлов весьма умеренное, часто отмечаются боли в костях, обусловленные гиперплазией миелоидной ткани. Значительно увеличены печень и особенно селезенка, которая может достигать гигантских размеров, вызывая сдавление органов грудной и брюшной полостей. Выражены явления гиперспленизма. Нередко наблюдают периспленит, повторные инфаркты селезенки. Чрезмерно увеличенная селезенка может вызывать постоянные тупые боли в левом подреберье, существует также реальная угроза ее разрыва с массивным внутренним кровотечением в брюшную полость.
Диагноз хронического лейкоза ставят на основании тщательного исследования гемограммы, пунктата костного мозга, селезенки.
Лечение. Основным способом лечения хронических лейкозов являются терапия цитостатическими средствами, кортикостероидами, при увеличении лимфатических узлов (при лимфолейкозе) — рентгенотерапия. В случаях выраженного гиперспленизма, среди проявлений которого на первом месте стоят геморрагические осложнения, при повторных инфарктах селезенки возникают показания к спленэктомии. При хроническом лимфолейкозе более эффективным способом лечения оказывается спленэктомия. После этой операции уменьшаются число лейкоцитов в крови, а также геморрагические и гемолитические явления. Общее состояние больных улучшается. Рентгенотерапию селезенки применяют при значительном ее увеличении с явлениями гиперспленизма, при невозможности по тем или иным причинам выполнить спленэктомию. Сочетание спленэктомии с консервативным и лучевым лечением позволяет улучшить общее состояние больных, в некоторых случаях добиться длительной клинической ремиссии, продлить жизнь пациентов.
БРЮШИНА И ЗАБРЮШИННОЕ ПРОСТРАНСТВО БРЮШИНА
Брюшина — тонкая серозная оболочка, покрывающая изнутри внутреннюю поверхность брюшной стенки (париетальная брюшина) и расположенные в брюшной полости органы (висцеральная брюшнна). Общая поверхность брюшины составляет около 2 м . Полость брюшины у мужчин замкнута, у женщин — сообщается с внешней средой через отверстия маточных труб. В брюшной полости в нормальных условиях находится небольшое количество прозрачной жидкости, увлажняющей поверхность внутренних органов и облегчающей перистальтику желудка и кишечника.
Брюшнна представляет собой полунепроницаемую активно функционирующую мембрану, через которую в обоих направлениях (в брюшную полость и из нее — в общий кровоток) диффундируют низкомолекулярные субстанции. Она выполняет резорбтивную функцию, обеспечивая всасывание из брюшной полости через лимфатические и кровеносные сосуды сецерннруемой жидкости, экссудата, продуктов распада и лизиса белков, некротических тканей, бактерий. Расщепление указанного материала осуществляют макрофаги н лизосомальные ферменты. Экссудативная функция брюшины сводится к выделению жидкости и фибрина. Барьерная функция заключается не только в механической защите органа брюшной полости. Брюшина обеспечивает защиту организма от инфекции с помощью гуморальных (комплемент, свободные антитела) и клеточных (макрофаги, гранулоциты) механизмов. Наиболее активной способностью всасывать жидкость обладает диафрагмальная брюшина, в меньшей степени — тазовая. Эта особенность диафрагмальной брюшины вместе с разветвленной сетью лимфатических сосудов, связывающих поддиафрагмальную часть брюшинного листка и диафрагмальные отделы плеврального, обусловливает возможность перехода воспалительного процесса из верхнего этажа брюшной полости в плевральную полость. В течение суток брюшина может сецернировать и реэорбировать 5—6 л жидкости. При перитоните развивается отек брюшины, препятствующий нормальной реэорбтивной функции брюшины, что приводит к накоплению в ее полости до 4 л экссудата.
Клетки брюшины относятся к так называемой мононуклеарно-фагоцитарной системе. Вместе с гранулоцитами, Т- и В-лимфоцитами они выполняют важные защитные функции: фагоцитируют и переваривают проникшие бактерии и инородные частицы. Эта функция больше свойственна большому сальнику, в котором содержится максимальное число иммунологи чески активных клеток Т-лимфоцитов.
Париетальная брюшина иннервируется соматическими нервами (ветвями межреберных нервов). Поэтому она чувствительна к любому виду воздействия (механическому, химическому и т. п.), а возникающие при этом боли (соматические) четко локализованы. Висцеральная брюшина имеет вегетативную иннервацию (парасимпатическую и симпатическую) и ие имеет соматической. Поэтому боли, возникающие при раздражении ее, ие локализованы, носят разлитой характер (висцеральные боли). Тазовая брюшина не имеет соматической иннервации. Этим объясняется отсутствие защитного напряжения мышц передней брюшной стенки (висцеромоторного рефлекса) при воспалительных изменениях тазовой брюшины.
Брюшина обладает выраженными пластическими свойствами. В ближайшие часы после нанесения механической или химической травмы на поверхности брюшины выпадает фибрин, что приводит к склеиванию соприкасающихся серозных поверхностей и отграничению воспалительного процесса. Брюшина и продуцируемая ею жидкость обладают и антимикробным действием.
ПОВРЕЖДЕНИЯ БРЮШИНЫ
Повреждения брюшины бывают двух типов — открытые и закрытые. Открытые повреждения (проникающие ранения живота), как правило, сочетаются с ранением внутренних органов, что диктует необходимость экстренного хирургического вмешательства.
При закрытой травме живота могут возникать повреждения брюшины, которые также часто сочетаются с травмами внутренних органов. На первый план выступают симптомы внутреннего кровотечения, перитонита и т. п. Изолированные закрытые повреждения брюшины встречаются редко и при отсутствии кровотечения нз мест разрывов брюшины серьезной опасности для жизни больного не представляют.
ПЕРИТОНИТЫ
Перитонит — острое или хроническое воспаление брюшины, сопровождающееся как местными, так и общими симптомами заболевания, серьезными нарушениями деятельности важнейших органов и систем организма. Под термином «перитонит» чаще понимают острый диффузный распространенный процесс, вызванный микрофлорой.
Классификация. Существует несколько принципов классификации перитонитов.
По характеру проникновения микрофлоры в брюшную полость выделяют первичные и вторичные перитониты. При первичных перитонитах микрофлора попадает в брюшную полость гематогенным, лимфогенным путем или через маточные трубы. Первичные перитониты встречаются редко, приблизительно в 1 % всех наблюдений. Вторичные перитониты обусловлены проникновением микрофлоры из воспалительно измененных органов брюшной полости (аппендикс, желчный пузырь и т. п.), при перфорации полых органов, проникающих ранениях живота, в случае несостоятельности швов анастомозов, наложенных во время предшествующих операций на органах брюшной полости.
По этиологическому фактору выделяют перитониты, вызванные микрофлорой пищеварительного тракта (кишечная палочка, стафилококки, стрептококки, энтерококки, неклостридиальные анаэробы, протей, и т. п.) и микрофлорой, не имеющей отношения к пищеварительному тракту (гонококки, микобактерии туберкулеза, пневмококки и т. п.). При перитонитах, вызванных микроорганизмами первой группы, из перитонеального экссудата высевают смешанную микрофлору, в то время как при перитонитах, вызванных микроорганизмами второй группы, высевают монокультуру.
Кроме микробных перитонитов, выделяют асептические (абактери-альные) перитониты, вызванные попаданием в брюшную полость различных неинфекционных агентов, обладающих агрессивным действием на брюшину (кровь, моча, желчь, панкреатический сок).
Выделяют также особые формы перитонита: карциноматозный при карциноматозе брюшины, характерном для неоперабельного рака внутренних органов; при ревматизме; фибропластический — при попадании на брюшину талька или крахмала с перчаток хирурга и т. п.
По характеру выпота выделяют серозный, фибринозный, фибри-нозно-гнойный, гнойный, геморрагический и гнилостный перитониты.
В зависимости от распространенности воспалительного процесса по поверхности брюшины выделяют отграниченные и общие перитониты.
Отграниченный перитонит (абсцесс) не имеет тенденции к дальнейшему распространению на другие отделы брюшной полости, от которых он четко отграничен спайками, фибринозными налетами, большим сальником или петлями кишечника. Наиболее часто встречаются аппендикулярные, поддиафрагмальные, подпеченочные и тазовые абсцессы.
Диффузный перитонит не имеет четких границ и тенденций к отграничению. Диффузный перитонит, локализованный только в непосредственной близости от источника инфекции, занимающий лишь одну анатомическую область живота, может быть назван местным. Диффузный перитонит, занимающий несколько анатомических обла-
стей живота, называют распространенным. Поражение всей брюшины именуют общим перитонитом.
5. По клиническому течению различают острый, подострый и хронический перитониты. Наиболее частой формой является острый перитонит.
При формулировке диагноза на первое место ставят основное заболевание (деструктивный аппендицит, холецистит, перфоративная язва желудка и т. п.), а затем его осложнение — перитонит с указанием вышеизложенных признаков классификации.
Этиология и патогенез. В клинической практике наиболее часто наблюдают распространенный гнойный перитонит. Самой частой его причиной является деструктивный аппендицит (свыше 60% всех случаев перитонита), далее по частоте следуют деструктивные формы острого холецистита (10%), заболевания желудка и двенадцатиперстной кишки (7%), язва, рак, осложнившиеся перфорацией (7%), острый панкреатит (3%), перфорация дивертикулов и рака ободочной кишки (2%), тромбоз сосудов брыжейки тонкой и толстой кишки, проникающие ранения живота, несостоятельность швов анастомозов после операций на органах брюшной полости.
Патогенез перитонита сложный и определяется многими факторами. Он может существенно меняться в зависимости от источника инфекции, характера и вирулентности микрофлоры, реактивности организма больного, распространенности патологического процесса по брюшине и т. п. В патогенезе перитонита ориентировочно можно выделить три стадии.
Стадия I (реактивная) — реакция организма на возникновение очага инфекции в брюшной полости. Она характерна для первых суток от начала развития перитонита. Эта стадия четко выражена при внезапном инфицировании брюшной полости (перфорация полого органа). Попадание на брюшину микроорганизмов вызывает воспалительную реакцию с типичными признаками: гиперемия, повышение проницаемости капилляров, отек, экссудация. Экссудат вначале имеет серозный характер, а по мере накопления в нем бактерий и лейкоцитов становится гнойным.
К местным проявлениям защитной реакции организма относят отек и инфильтрацию близлежащих тканей (большого сальника, кишки или ее брыжейки). Выпадение фибрина способствует склеиванию органов вокруг очага инфекции и его отграничению; повышаются фагоцитарная активность лейкоцитов и макрофагов, барьерная функция ретикулоэндотелиальной системы печени и селезенки.
К общим механизмам реакции относят неспецифическую реакцию гипоталамо-гипофизарно-адреналовой системы в ответ на воздействие факторов, вызвавших перитонит. Выброс катехоламинов, глюкокорти-коидов, экзотоксинов стимулирует секрецию интерлейкинов (особенно интерлейкина-6). В результате запускается «цепная реакция» изменений, свойственных воспалению.
Стадия II (токсическая) — реакция организма в ответ на поступление в общий кровоток экзотоксинов и эндотоксинов, интерлейкинов, а также продуктов белковой природы, образующихся при распаде клеток (лизосомальные ферменты, протеазы, полипептиды и т. п.) и токсичных веществ, накапливаемых в тканях за счет нарушения метаболизма. Она развивается через 24—72 ч от начала заболевания.
Прогрессирующий перитонит приводит к нарушению иммунной защиты организма: снижаются фагоцитарная активность лейкоцитов, содержание иммуноглобулинов IgG и IgM, повышается связывание комплемента, нарушается функция ретикулоэндотелиальной системы печени, селезенки. Воспаление в зависимости от возбудителя из се-розно-фибринозного переходит в гнойное или гнилостное. Состояние больного ухудшается. Интерлейкины вызывают сильную пирогенную реакцию организма и способствуют высвобождению кининов, резкому расширению периферических сосудов, снижению периферического сосудистого сопротивления, что приводит к падению артериального давления. Вследствие этих процессов нарушается микроциркуляция в органах и тканях, развивается синдром диссеминированного внутри-сосудистого свертывания с коагулопатией потребления. Возникает недостаточность многих систем и органов, развивается катаболический тип обмена веществ и т. д.
Бели механизмы местной, клеточной и гуморальной (иммунной) защиты способны преодолеть вирулентность микрофлоры и обеспечить отграничение воспалительного процесса, т. е. формирование абсцесса, то при соответствующем лечебном воздействии заболевание может быть излечено. Если местные и общие механизмы защиты не в состоянии локализовать воспалительный процесс, то воспаление прогрессирует, распространяясь на другие отделы брюшной полости, при этом развивается диффузный перитонит.
Стадия III (терминальная) развивается спустя 72 ч от начала заболевания. В этой стадии перитонита часто развивается септический шок. Местные и общие механизмы защиты организма оказываются неэффективными. Если на первой стадии перитонита за счет этих сил возможна локализация инфекции и даже излечение от перитонита, то в терминальной стадии заболевания такой исход невозможен без хирургического вмешательства и интенсивной терапии.
Изменения гемодинамики, характерные для реакции организма на стрессорное воздействие (учащение пульса, повышение артериального давления, увеличение ударного и минутного объемов сердечного выброса и т. д.), происходят в самом начале развития перитонита. В терминальной стадии перитонита гипертензия сменяется гипотензией, обусловленной гиповолемией вследствие потери жидкости с рвотой, недостатком приема жидкости, отеком брюшины, экссудацией в брюшную полость, депонированием жидкости в просвете кишечника за счет паралитической непроходимости кишечника. Все это приводит к снижению венозного возврата к сердцу, увеличению тахикардии и к глубоким изменениям в сердечно-сосудистой системе. В токсической и терминальной фазах перитонита гемодинамические сдвиги в значительной мере обусловлены действием интерлейкинов, тканевых гормонов и биологически активных веществ — кининов, серотонина, катехоламина, гистамина и т. п.
Изменения в системе органов дыхания развиваются в основном на поздних стадиях перитонита и связаны с нарушениями гемодинамики (гиповолемией, нарушением перфузии легких), выраженными метаболическими расстройствами, гипоксией. Тяжелые изменения дыхательной системы появляются при нарушении микроциркуляции в легочной ткани, открытии артериовенозных шунтов, развитии ин-терстициального легочного отека (картина «шокового легкого»). Все эти факторы предрасполагают к развитию легочной или легочно-сердечной недостаточности. В организме больных перитонитом при септическом шоке появляются специфические факторы (факторы угнетения), избирательно нарушающие функцию миокарда и легких.
Нарушения функций печени можно выявить уже на ранней стадии перитонита. Они развиваются в результате гиповолемии и гипоксии ее ткани. При усугублении микроциркуляторных нарушений выделяемые тканевые биологически активные вещества приводят к усилению гипоксии печени, выраженным дистрофическим изменениям в ее паренхиме и в финале — к печеночной недостаточности.
Нарушения функции почек развиваются вследствие спазма сосудов и ишемии коркового слоя, возникающих в реактивной стадии перитонита как следствие общей реакции организма на стрессорные воздействия. Дальнейшее ухудшение происходит за счет гиповолемии, эндотоксемии, гипотонии, нарушения микроциркуляции. В результате снижается диурез, нарастает азотемия, развивается острая почечная или острая печеночно-почечная недостаточность.
Нарушение моторной активности пищеварительного тракта происходит уже в самом начале развития перитонита. Атония кишечника, возникающая как реакция на имеющийся в брюшной полости воспалительный очаг, носит рефлекторный характер и может способствовать отграничению патологического процесса. В последующем в результате воздействия токсинов на нервно-мышечный аппарат кишки, нарушения кровообращения в ее стенке, расстройства метаболизма в мышечных волокнах и нервных клетках кишки наступает стойкий парез пищеварительного тракта — паралитическая непроходимость кишечника. Следствием этого является депонирование большого объема жидкости как в отечных стенках, так и в просвете кишок, развиваются выраженные нарушения водно-электролитного обмена, расстройства кислотно-основного состояния. Энтеральное питание больных в этих условиях невозможно. При перитоните нарушается белковый, жировой и углеводный обмен, возникает необходимость в парентеральном питании. Перитонит, начавшись как локальное заболевание, довольно быстро вызывает опасные для жизни нарушения деятельности всех органов и систем организма.
Распространенный гнойный перитонит. Заболевание занимает одно из ведущих мест в структуре всех перитонитов. Источники возникновения — осложнения острых заболеваний органов брюшной полости, операций, травмы. Только в терминальной стадии заболевания, когда преобладают общие расстройства гомеостаза, клинические проявления его однотипны. Симптоматика заболевания определяется также вирулентностью микрофлоры, состоянием реактивности организма, временем, прошедшим с начала развития воспалительного процесса в брюшной полости.
Клиническая картина и диагностика. При расспросе больных можно выявить жалобы, характерные для заболевания того или иного органа брюшной полости, послужившего причиной развития перитонита.
На I (реактивной) стадии перитонита больные жалуются на интенсивную боль в животе постоянного характера, усиливающуюся при перемене положения тела. Локализация боли зависит от локализации первичного воспалительного очага. Боль связана с массивным раздражением многочисленных нервных окончаний брюшины. Любое изменение положения тела сопровождается растяжением того или иного участка воспалительно измененной брюшины, вызывает раздражение огромного рецепторного поля, что усиливает боль. Для уменьшения болей больные стараются неподвижно лежать на боку с приведенными к животу ногами, избегая лишних движений.
Рвота большим количеством застойного желудочного содержимого не приносит облегчения. Она связана с переполнением желудка вследствие угнетения моторной активности пищеварительного тракта (динамическая непроходимость кишечника).
При физикальном исследовании определяют тахикардию до 100— ПО ударов в 1 мин; при этом артериальное давление может быть нормальным, а при мезентериальном тромбозе, перфорации полого органа — пониженным.
При осмотре отмечают сухость слизистых оболочек, что связано с нарастающей дегидратацией организма. При исследовании живота выявляют ограничение подвижности брюшной стенки при дыхании, более выраженное в зоне проекции основного воспалительного очага. При перкуссии определяют зону болезненности, соответствующую области воспалительно измененной брюшины, высокий тимпанит за счет пареза кишечника, притупление перкуторного звука — при скоплении значительного количества экссудата (750—1000 мл) в той или иной области живота.
При поверхностной пальпации живота выявляют защитное напряжение мышц передней брюшной стенки соответственно зоне воспалительно измененной париетальной брюшины. Мышечная защита наиболее резко выражена при перфорации полого органа («доскооб-разный живот»). Защитное напряжение мышц передней брюшной стенки может отсутствовать при локализации воспалительного процесса в малом тазу, при поражении задней париетальной брюшины, у недавно родивших женщин, у стариков, у лиц, находящихся в алкогольном опьянении. В диагностике перитонита ценным оказывается пальцевое исследование прямой кишки, при котором можно определить нависание ее передней стенки за счет скопления экссудата, болезненность при давлении на стенки прямой кишки. У женщин при исследовании через влагалище можно обнаружить нависание его заднего свода, болезненность при смещении шейки матки. Для выявления признаков воспаления задней париетальной брюшины необходимо определить тонус мышц задней брюшной стенки. Для этого врач помещает ладони в поясничной области больного в положении его на спине и легким давлением сравнивает тонус мышц справа и слева.
При глубокой пальпации передней брюшной стенки можно определить воспалительный инфильтрат, опухоль, увеличенный орган (деструктивно измененный желчный пузырь), инвагинат и т. д. Характерным симптомом перитонита является симптом Щеткина — Блюмберга, механизм которого связан с висцеромоторным рефлексом, с изменением степени растяжения воспалительно измененной париетальной брюшины в момент быстрого прекращения давления на стенку живота. Этот симптом более выражен в зоне проекции основного воспалительного очага, степень его выраженности уменьшается по мере удаления от наиболее измененных отделов брюшины. Симптом Щеткина — Блюмберга можно определить и при воспалении задней париетальной брюшины. В этом случае методика его определения аналогична таковой при определении тонуса мышц задней брюшной стенки.
При аускультации живота определяют ослабление перистальтических шумов, на поздних стадиях перитонита кишечные шумы не выслушиваются (симптом «гробовой тишины»).
В общем анализе крови выявляют лейкоцитоз до 16—18x10 /л, нейтрофилез, сдвиг лейкоцитарной формулы влево, увеличение СОЭ, мочевины, креатинина (в поздней стадии). Рентгенологическое исследование является обязательным. При обзорной рентгенографии живота выявляют скопление газа под правым или левым куполом диафрагмы (при перфорации полого органа), ограничение ее подвижности (при локализации патологического процесса в верхнем этаже брюшной полости) и высокое стояние купола диафрагмы на стороне поражения, «сочувственный» плеврит в виде большего или меньшего количества жидкости в реберно-диафрагмальном синусе, дисковидные ателектазы в легком. Можно определить паретичную, раздутую газом кишку, прилежащую к очагу воспаления, а в поздних стадиях перитонита — уровни жидкости с газом в петлях кишечника (чаши Клойбера), характерные для паралитической непроходимости кишечника.
Лапароскопия показана при неуверенности диагноза, когда неин-вазивные способы исследования оказываются неинформативными. При лапароскопии можно осмотреть почти все органы брюшной полости, оценить состояние париетальной и висцеральной брюшины, выявить источник перитонита, наличие и характер экссудата. Более простым способом исследования является лапароцентез — прокол брюшной стенки с введением в брюшную полость катетера, через который аспирируют перитонеальный экссудат. По характеру полученной жидкости (кровь, гной и т. п.) можно сделать заключение о природе изменений в брюшной полости.
Ультразвуковое исследование позволяет определить скопление экссудата в том или ином отделе брюшной полости.
В токсической стадии перитонита интенсивность болей в животе несколько уменьшается, наблюдаются срыгивание и рвота жидкостью бурого цвета, задержка стула и отхождения газов. На этой стадии развития перитонита выражены общие симптомы, характерные для резкой интоксикации организма. Пульс учащается свыше ПО—120 ударов в 1 мин, снижается артериальное давление. Сохраняется высокая гипертермия (свыше 38 °С), нарастает тахипноэ; черты лица заострены, язык сухой (как щетка). Необходимо отметить, что при перитоните развивается сухость не только языка, но и внутренней поверхности слизистой оболочки щеки вследствие выраженной дигид-ратации, в то время как при тахипноэ, не связанном с перитонитом, отмечают лишь сухость языка за счет испарения с него слюны при дыхании.
Живот резко вздут вследствие пареза кишечника, защитное напряжение мышц несколько ослабевает вследствие истощения висцеро-моторных рефлексов, кишечные шумы не выслушиваются. Симптом Щеткина — Блюмберга становится несколько менее выраженным. При специальном исследовании можно определить снижение объема циркулирующей крови, белка, нарушение водно-электролитного баланса и кислотно-основного состояния — гипокалиемию и алкалоз, а при снижении диуреза — гиперкалиемию и ацидоз.
В терминальной стадии перитонита развиваются симптомы поражения ЦНС — адинамия, иногда сменяющаяся эйфорией и психомоторным возбуждением, спутанность сознания, бред. Появляется бледность кожных покровов с акроцианозом, заостряются черты лица, западают глазные яблоки (fades hippocratica); развиваются резкая тахикардия, гипотензия. Вследствие развития дыхательной недостаточности дыхание становится очень частым, поверхностным. Возникает рвота большим количеством желудочного и кишечного содержимого с каловым запахом; живот резко вздут, перистальтика отсутствует; появляется разлитая болезненность по всему животу. В анализе крови отмечают высокий лейкоцитоз, который затем снижается и может сменяться лейкопенией при истощении защитных сил организма. Нарушения водно-электролитного баланса, кислотно-основного состояния достигают максимума. На ЭКГ выявляют признаки, характерные для токсического повреждения миокарда и электролитных расстройств. При исследовании коагулограммы отмечают признаки диссеминиро-ванного внутрисосудистого свертывания, которое ведет к нарушению микроциркуляции, существенно утяжеляет течение заболевания. Все эти неблагоприятные факторы приводят к декомпенсации функций жизненно важных органов и систем с развитием сердечно-сосудистой, легочной и печеночно-почечной недостаточности.
Дифференциальная диагностика. В токсической и терминальной стадиях перитонита дифференциальная диагностика, как правило, не представляет серьезных затруднений, но именно на этих стадиях лечение перитонита зачастую оказывается малоэффективным. Распознавание перитонита в начальной фазе намного труднее, так как его клинические проявления мало отличаются от симптомов заболевания, которое стало причиной развития перитонита (острый аппендицит, острый холецистит и т. п.).
При остром панкреатите защитное напряжение мышц передней брюшной стенки не определяется или оно нерезко выражено, отсутствуют также симптомы раздражения брюшины. Температура тела в начале заболевания остается нормальной, изменения в лейкоцитарной формуле незначительны. Повышено содержание амилазы крови и мочи.
Клинические проявления острой механической непроходимости кишечника отличаются от таковых при перитоните лишь на ранних стадиях, а в последующем при отсутствии адекватного лечения развивается распространенный перитонит. В начале заболевания боли носят довольно интенсивный схваткообразный характер, при перитоните другого происхождения боли постоянные. При рентгенологическом исследовании выявляют характерные для непроходимости кишечника признаки — чаши Клойбера, симптом «органных труб» и т. п. В связи с динамической непроходимостью эти симптомы могут быть и при перитоните.
Для печеночной колики характерны внезапные боли в правом подреберье с иррадиацией в правую лопатку, правое плечо, рвота небольшим количеством желудочного содержимого с примесью желчи. Однако мышечное напряжение в правом подреберье не выражено, отсутствуют симптомы раздражения брюшины. Местное применение тепла и спазмолитических средств быстро купирует приступ печеночной колики.
При остром флегмонозном холецистите можно выявить наиболее характерные для местного перитонита симптомы: постоянные боли, защитное напряжение мышц, симптомы раздражения брюшины в правом верхнем квадранте живота, угнетение перистальтики, гипертермия, лейкоцитоз. Тщательное почасовое наблюдение за больным с неоднократным определением температуры тела, пульса, величины артериального давления, лейкоцитоза с учетом изменений в жалобах больного и данных объективного исследования позволят врачу правильно сориентироваться в тенденции развития острого процесса в желчном пузыре, эффективности лечения и показаниях к операции.
Почечная колика может сопровождаться болевыми ощущениями в животе, его вздутием, задержкой стула и отхождения газов, что бывает и при перитоните. Однако характерная локализация болей (преимущественно в поясничной области), их схваткообразный характер, иррадиация в бедро, половые органы, отсутствие связи болей с переменой положения тела больного, беспокойное поведение пациента, отсутствие гипертермии, симптомов раздражения брюшины, лейкоцитоза, а также характерные изменения в анализе мочи (гематурия, лейкоцитурия) позволяют четко отдифференцировать эти два заболевания.
Некоторые другие заболевания, не связанные с поражением органов брюшной полости (базальный плеврит, пневмония, инфаркт миокарда), могут сопровождаться некоторыми местными симптомами, характерными для перитонита. В этих случаях помогает тщательное обследование органов грудной полости.
У детей диагностика перитонита затруднена из-за отсутствия адекватного контакта с пациентом и невозможности собрать полноценный анамнез заболевания. Следует помнить, что у детей перитонит часто протекает по типу гиперергической реакции с выраженными болевыми ощущениями, резким напряжением брюшных мышц, высокой гипертермией и лейкоцитозом.
Существенные трудности может представить диагностика перитонита у лиц старческого возраста. У этого контингента больных трудно собрать анамнез, а вследствие снижения реактивности организма болевые ощущения и объективные признаки болезни (мышечная защита, гипертермия, лейкоцитоз) могут быть слабовыраженными.
Особые трудности в диагностическом плане представляют послеоперационные перитониты. Основными причинами инфицирования являются несостоятельность швов анастомозов, скопление крови, экссудата с последующим их нагноением, так как во время операции микроорганизмы всегда попадают в операционное поле. Трудность диагностики связана с тем, что симптомы перитонита могут быть весьма скудными. Действие антибактериальных средств и наркотических анальгетиков затушевывает клиническую картину осложнения. Гипертермия, тахикардия, напряжение мышц жив эта, симптом Щеткина — Блюмберга, парез кишечника, лейкоцитоз всегда отмечаются после операции на органах брюшной полости. И все же высокая гипертермия, усиление, а не ослабление с течением времени болевых ощущений в том или ином отделе живота, увеличение мышечной защиты, стойкий парез пищеварительного тракта и нарастающий лейкоцитоз дают основание заподозрить развитие послеоперационного перитонита. Принципы его диагностики такие же, как и перитонита, вызванного острым хирургическим заболеванием органов брюшной полости.
Лечение. Распространенный гнойный перитонит является абсолютным показанием к экстренному оперативному вмешательству. Своевременная диагностика ранних форм перитонита и адекватное хирургическое вмешательство определяют успех лечения. Основные принципы лечения перитонита заключаются в раннем проведении операции с удалением очага инфекции или дренированием гнойников; механическом очищении (аспирация жидкости) брюшной полости; промываний антисептическими растворами во время и после операции (перитонеальный лаваж); массивной антибактериальной терапии; ликвидации паралитической непроходимости кишечника (аспирация желудочного и кишечного содержимого, стимуляция деятельности кишечника); коррекции нарушений водно-электролитного обмена, кислотно-основного состояния, белкового обмена с помощью массивной инфузионной терапии; коррекции и поддержании на оптимальном уровне функционального состояния сердечно-сосудистой системы, легких, печени, почек.
В качестве операционного доступа используют срединную лапаро-томию. Очаг инфекции в каждом случае устраняют с учетом конкретных условий, или дренируют зону катастрофы.
Если источником перитонита является орган, который может быть удален (аппендикс, желчный пузырь), и технические условия позволяют это сделать, то его удаляют (аппендэктомия, холецистэктомия, резекция кишки и т. п.). В случае перфорации полого органа (язвы желудка, двенадцатиперстной кишки) ушивают перфоративное отверстие или производят операцию на желудке. При послеоперационном перитоните, вызванном несостоятельностью швов ранее наложенного анастомоза, и невозможности наложить швы выполняют двухэтапные паллиативные операции. В этом случае обычно приходится ограничиваться удалением гноя, подведением дренажной трубки к отверстию для аспирации гнойного или кишечного содержимого, тампонированием данного участка для отграничения очага инфекции от остальных отделов брюшной полости или выведением самого анастомоза (межкишечного) из брюшной полости на кожу передней брюшной стенки.
Брюшную полость тщательно осушают электроотсосом и марлевыми салфетками, удаляют рыхлые налеты фибрина, промывают изотоническим раствором хлорида натрия, а затем раствором антисептического вещества (диоксидин, хлоргексидин, фурацилоин).
Для декомпрессии кишечника в тонкую кишку через рот проводят длинный двухпросветный зонд с множественными отверстиями. Зонд можно также провести через прямую кишку. С его помощью из просвета кишечника аспирируют жидкость и газы, периодически промывают кишечник. При неэффективности манипуляции прибегают к илеостомии. Выполнение энтеротомии или илеостомии при перитоните нежелательно, так как возможно развитие несостоятельности кишечных швов. В корень брыжейки тонкой кишки в конце операции вводят 100—120 мл 0,25% раствора новокаина для предотвращения пареза кишки.
Для дренирования брюшной полости дренажи вводят в полость малого таза (справа и слева), под диафрагму (с обеих сторон) и под печень (рис. 129). Все дренажи выводят через отдельные проколы передней брюшной стенки по передней аксиллярной линии. Рану передней брюшной стенки зашивают наглухо лишь в том случае, если полость ее дренируют трубкой с множеством отверстий для аспирации раневого содержимого и постоянного промывания полости раны в подкожной жировой клетчатке растворами антисептиков. При таком способе частота нагноения послеоперационной раны значительно снижается.
Если во время операции выявлен распространенный гнойный перитонит и источник инфекции удален, то через дренажные трубки осуществляют перитонеальный лаваж. С его помощью достигается дальнейшее механическое очищение брюшной полости от инфекции. В первые же сутки в верхние дренажи вводят изотонический раствор хлорида натрия с добавлением к нему калия, натрия, хлора, кальция. Эффективность перитонеального лаважа увеличивается при добавлении
Рис. 129. Дренирование брюшной полости при перитоните.
к диализирующему раствору антибиотиков широкого спектра действия. Отток диализата происходит через нижние дренажи. Такой способ перитонеального лаважа называют проточным. Если количество оттекающей жидкости меньше количества вводимой, то переходят на фракционный лаваж. В этом случае вводят раствор в тот или иной дренаж и на несколько часов перекрывают его, а затем аспирируют жидкость и экссудат. Такой способ уступает по эффективности проточному лаважу. При проточном лаваже за сутки капельно в брюшную полость вводят 8—10 л и более раствора, при фракционном — 2—3 л. Перитонеальный лаваж проводят в течение 2—3 дней. За это время, как правило, удается хорошо отмыть брюшную полость от инфицированного материала. Кроме того, в этот период в брюшной полости образуются рыхлые сращения, отграничивающие дренажи от свободной брюшной полости и препятствующие ирригации большой площади брюшины. Дальнейшее проведение лаважа нецелесообразно.
Недостатками проточного и фракционного перитонеального лаважа является возможность формирования межкишечных, поддиафрагмаль-ных и тазовых абсцессов вследствие разграничения брюшной полости спайками.
В последние годы для лечения распространенного гнойного перитонита с успехом применяют этапный лаваж (программированное промывание) брюшной полости. При этом после операции края раны брюшной стенки лишь сближают швами на специальных прокладках. Иногда к краям апоневроза прямых мышц живота подшивают нейлоновую сетку, т. е. формируют лапаростому, обеспечивающую отток экссудата из брюшной полости. В зависимости от распространенности перитонита, агрессивности его течения и общего состояния пациента через 24—48 ч проводят повторную ревизию брюшной полости с механическим очищением петель кишок и других органов путем промывания большим объемом антисептических растворов (15—20 л), после чего края раны снова сближают. У больных с запущенными формами гнойного перитонита в среднем требуется проведение 3—5 сеансов этапного лаважа брюшной полости. Данная методика позволяет существенно улучшить результаты лечения больных перитонитом и значительно снизить послеоперационную летальность. Если же источник перитонита во время первой операции не был ликвидирован (например, при несостоятельности пищеводно- или желудочно-кишечного анастомозов), то применение данного способа лечения нецелесообразно.
Антибактериальная терапия включает введение антибиотиков ме-стно (в брюшную полость через дренажи) и парентерально (внутривенно и внутримышечно). В начале заболевания назначают антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, полусинтетические пенициллины, метронидазол). В последующем после получения результатов бактериологического исследования экссудата из брюшной полости проводят направленную антибиотикотерапию с учетом чувствительности микрофлоры к антибиотикам. При резистентности микрофлоры к большинству антибактериальных препаратов прибегают к внутривенному введению растворов антисептических средств — (диоксидина и др.). Дозировку антибактериальных препаратов устанавливают с учетом функционального состояния печени и почек больного.
Ликвидацию паралитической непроходимости кишечника начинают уже на операционном столе (декомпрессия кишечника, введение раствора новокаина в корень брыжейки тонкой кишки). В послеоперационном периоде больному 2—3 раза в день откачивают желудочное содержимое. Если же его количество превышает 1 л, то в желудок через нос вводят тонкий зонд для постоянной декомпрессии верхних отделов пищеварительного тракта. Кроме того, производят стимуляцию кишечника с помощью прозерина (ингибитор холинэстеразы), накожную электростимуляцию кишечной деятельности. Для ликвидации угнетающего действия токсинов на моторику кишки применяют соответствующую дезинтоксикационную и инфузионную терапию.
Во второй и третьей фазах перитонита на первый план выступают симптомы нарушения гомеостаза с явлениями декомпенсации водно-электролитного обмена, кислотно-основного состояния, белкового обмена с глубоким нарушением функций жизненно важных органов. Поэтому своевременная и адекватная коррекция нарушений гомеостаза является важнейшим компонентом лечения перитонита. После операции больному проводят парентеральное питание. При этом количество внутривенно вводимой жидкости рассчитывают по формуле с учетом массы тела больного (не менее 4—5 л) в соответствии с ощутимыми потерями воды и электролитов с мочой и рвотой, при аспирации кишечного содержимого, а также неощутимыми потерями при потоотделении, дыхании. В связи с дисэлектролитемией показано введение полиионных кристаллоидных растворов с учетом содержания К^ и Na в крови. Инфузионную терапию проводят под контролем диуреза, концентрации электролитов крови, кислотно-основного состояния, объема циркулирующей крови. В более поздний период, когда восстанавливается деятельность кишечника, приступают к эн-теральному питанию. Для устранения синдрома диссеминированного внутрисосудистого свертывания применяют препараты, улучшающие реологические свойства крови (низкомолекулярные декстраны, дез-агреганты, гепарин).
Для дезинтоксикации организма наряду с инфузионной терапией (гемодилюция) и форсированным диурезом (введение фуросемида) применяют экстракорпоральные методы очищения организма от продуктов метаболизма и токсичных веществ. С этой целью используют плазмаферез (более эффективный метод), плазмо- и гемосорбцию. При возникновении на фоне перитонита острой почечной недостаточности осуществляют гемодиализ.
Прогноз. При перитоните прогноз зависит от характера основного заболевания, вызвавшего перитонит, своевременности оперативного пособия, адекватности интенсивной терапии и проводимого лечения. Летальность при распространенном гнойном перитоните составляет в среднем 25—30%, а при сочетании с полиорганной недостаточностью — 85—90%.
Отграниченные перитониты (абсцессы)
В соответствии с источником инфекции и топографическими особенностями брюшной полости абсцессы возникают в типичных местах: в субдиафрагмальном, подпеченочном пространствах, между петлями кишечника, вокруг слепой кишки, в прямокишечно-маточном углублении.
Клиническая картина и диагностика. Клинические проявления абсцессов весьма разнообразны. При отграниченных абсцессах симптомы менее драматичны, чем при диффузном перитоните, и зависят от локализации, причины возникновения, вирулентности и природы возбудителя.
Абсцессы, возникают либо в раннем (через 6—7 дней), либо в позднем (через несколько недель) периоде после операции.
Поддиафрагмальные и подпеченочные абсцессы локализуются в правом или левом поддиафрагмальном пространстве между диафрагмой, печенью и поперечной ободочной кишкой и являются осложнением различных острых хирургических заболеваний органов брюшной полости: аппендицита, острого холецистита, перфоративной язвы желудка и двенадцатиперстной кишки, острого панкреатита, а также различных операций на органах брюшной полости.
Клиническая картина и диагностика. Больных беспокоят постоянные боли, усиливающиеся при глубоком вдохе, локализующиеся в правом или левом подреберье, иррадиирующие в ряде случаев в спину, лопатку, плечо (за счет раздражения окончания диафрагмального нерва); тошнота, икота. Температура тела повышена до фебрильных цифр, носит интермиттирующий характер. Пульс учащен до 100—ПО в 1 мин.
При осмотре выявляют вынужденное положение больного на спине или на боку, иногда полусидя. Язык сухой, обложен грязно-серым налетом. Живот несколько вздут, болезненный при пальпации в подреберьях, в межреберных промежутках (соответственно локализации абсцесса). Иногда в этих областях можно определить некоторую па-стозность кожи. Симптомы раздражения брюшины определяются нечасто. В общем анализе крови выявляют лейкоцитоз, нейтрофилез, сдвиг лейкоцитарной формулы крови влево, увеличение СОЭ, т. е. признаки, характерные для гнойной интоксикации. При подозрении на поддиафрагмальный абсцесс обязательно проводят рентгенологическое исследование. В случае поддиафрагмального абсцесса отмечают более высокое стояние купола диафрагмы на стороне поражения, ограничение ее подвижности, «сочувственный» выпот в плевральной полости. Прямым рентгенологическим симптомом поддиафрагмального абсцесса является наличие уровня жидкости с газовым пузырем над ним. Ценную информацию дают ультразвуковое исследование и компьютерная томография.
Лечение. Проводят хирургическое лечение — вскрытие и дренирование абсцесса. Применяют как чрезбрюшинный, так и внебрю-шинный доступ по А. В. Мельникову. Последний метод предпочтительнее, так как позволяет избежать массивного бактериального обсеменения брюшной полости. Абсцесс иногда дренируют путем чрескожной пункции под контролем ультразвукового исследования или компьютерной томографии. Данная процедура малотравматична и гораздо легче переносится больными, чем оперативное вмешательство.
Абсцесс прямокишечно-маточного углубления (дугласова пространства) локализуется в наиболее низком отделе брюшной полости — в области малого таза (рис. 130). Основными причинами его развития являются острый деструктивный аппендицит, гнойные воспалительные процессы при гинекологических заболеваниях. Несколько реже абсцесс прямокишечно-матового углубления является следствием перенесенного распространенного гнойного перитонита.
Рис 130. Абсцесс прямокишечно-маточного углубления.
систенции. У женщин при исследовании через влагалище можно выявить нависание его заднего свода, резкую болезненность при смещении шейки матки. При бимануальном исследовании можно ориентировочно определить размеры абсцесса. В анализе крови также выявляют признаки, характерные для гнойного процесса. В качестве диагностической процедуры используют УЗИ, пункцию заднего свода влагалища у женщин или передней стенки прямой кишки у мужчин в месте наибольшего размягчения инфильтрата.
Лечение. Под наркозом осуществляют насильственное расширение ануса, через переднюю стенку прямой кишки абсцесс пунктируют и вскрывают по игле, введенной в его полость. В образовавшееся отверстие вводят дренажную трубку.
Межкишечные абсцессы развиваются в результате деструктивного аппендицита, прободной язвы желудка и двенадцатиперстной кишки, после перенесенного общего гнойного перитонита.
Клиническая картина и диагностика. Больных беспокоят тупые боли умеренной интенсивности без четкой локализации, периодическое вздутие живота. По вечерам температура тела повышается до 38 °С и выше. Живот остается мягким, признаков раздражения брюшины нет, и лишь при близкой локализации гнойника к передней брюшной стенке и при его больших размерах определяется защитное напряжение мышц передней брюшной стенки. В анализах крови выявляют умеренный лейкоцитоз, ускорение СОЭ. В случае достаточно больших размеров абсцесса при рентгенологическом исследовании выявляют очаг затемнения, значительно реже с уровнем жидкости и газа. Компьютерная томография и ультразвуковое исследование являются основными способами диагностики.
Лечение. Полость абсцесса вскрывают и дренируют. Возможны также пункция и дренирование абсцесса под контролем ультразвукового исследования или компьютерной томографии.
Отдельные формы перитонита
Туберкулезный перитонит в настоящее время встречается редко. Развивается гематогенным путем из экстраабдоминальных источников (легкие, лимфатические узлы), а также из органов брюшной полости и мезентериальных лимфатических узлов, пораженных туберкулезом. Клиническое течение может быть острым, подострым или хроническим. Последняя форма встречается наиболее часто. Выделяют экссудативную, казеозно-язвенную и фиброзную формы. В зависимости от формы процесса в клинической картине преобладают различные симптомы — нарастающий асцит, частичная или полная непроходимость кишечника, распространенный перитонит. В диагностике помогают данные анамнеза о перенесенном туберкулезе, положительная проба с туберкулином.
Лечение. Обычно проводят консервативную терапию с учетом современных принципов лечения туберкулезного процесса и лишь при появлении симптомов распространенного перитонита или острой непроходимости кишечника показано хирургическое вмешательство.
Генитальные перитониты. Выделяют неспецифические и специфические перитониты. Неспецифический генитальный перитонит возникает при прорыве в брюшную полость гноя из воспалившихся маточных труб и яичников, гнойников параметрия, нагноившейся кисты яичника, при перекруте ее ножки. Генитальные перитониты развиваются также в послеродовом периоде и после внебольничных септических абортов за счет распространения инфекции из матки (метроэндометрит) лимфогенным или гематогенным путем. Еще одна возможная причина возникновения перитонита — попадание микрофлоры в брюшную полость при проникающих повреждениях матки (перфорация во время аборта).
Воспалительный процесс может захватывать полость таза, вызывая так называемый пельвиоперитонит, он может распространяться и на большую часть поверхности брюшины, вызывая распространенный перитонит.
Пельвиоперитонит протекает относительно доброкачественно. Наблюдаемые в начале болезни тупые боли внизу живота, высокая температура тела под влиянием массивной антибактериальной терапии через некоторое время уменьшаются, экссудат подвергается рассасыванию, наступает выздоровление. При прогрессировании пельвиопе-ритонита развивается распространенный перитонит, появляются симптомы гнойной интоксикации, выраженная гипертермия. При отграничении воспаления формируется абсцесс. В этом случае показано вскрытие абсцесса и его дренирование. Используют доступ через задний свод влагалища — заднюю кольпотомию. В полости абсцесса оставляют дренаж для аспирации содержимого и промывания его полости.
Специфический пельвиоперитонит чаще обусловлен гонококковой флорой. Примерно у 15% больных гонореей развивается пельвиоперитонит. Возбудители инфекции проникают в брюшную полость из пораженных гонореей придатков матки. Процесс, как правило, не выходит за пределы полости таза. При этом возникают интенсивные боли внизу живота, тенезмы, жидкий стул, повышается температура тела. Живот вздут, при пальпации выявляют напряжение мышц передней брюшной стенки, положительный симптом Щеткина — Блюмберга. При пальцевом исследовании прямой кишки и исследовании через влагалище выявляют признаки воспаления тазовой брюшины, серозно-гнойные выделения из влагалища.
Лечение. Гонорейный пельвиоперитонит требует консервативного лечения. Назначают холод на живот, дезинтоксикационную и антибактериальную терапию. Прогноз благоприятный.
ОПУХОЛИ БРЮШИНЫ
Опухоли брюшины бывают двух видов — первичные и вторичные (при метастазировании злокачественных опухолей — карциноматоз). Первичные опухоли брюшины наблюдают очень редко. К доброкачественным опухолям относят фибромы, нейрофибромы, ангиомы и т. п., к злокачественным — мезотелиому.
Лечение. Доброкачественные опухоли брюшины удаляют в пределах здоровых тканей. При карциноматозе брюшины хирургическое лечение невозможно. В случае локализованных форм мезотелиомы радикальное удаление опухоли дает излечение больного. При диффузных формах хирургическое лечение не показано. Прогноз, как и при карциноматозе брюшины, неблагоприятный.
ЗАБРЮШИННОЕ ПРОСТРАНСТВО
Забрюшинное пространство спереди ограничено задней париетальной брюшиной, сзади — мышцами задней брюшной стенкн, выстланными внутрибрюшной фасцией, сверху — диафрагмой, снизу — мысом крестца и пограничной линией таза, ниже которой оно переходит в подбрюшинное пространство малого таза. Забрюшинное пространство выполнено жировой клетчаткой и рыхлой соединительной тканью, в которых расположены забрюшинные органы: почки, надпочечники, мочеточники, поджелудочная железа, аорта и нижняя полая вена. Для удобства в составе забрюшинной клетчатки выделяют околопочечное (паранефральная клетчатка) и околоободочное (para colon) клетчаточные пространства, так как именно в этих отделах часто возникают скопления гноя.
ПОВРЕЖДЕНИЯ ТКАНЕЙ ЗАБРЮШИННОГО ПРОСТРАНСТВА
Наиболее часто встречаются забрюшинные гематомы, возникающие при прямых травмах поясничной области, живота, падении с высоты без повреждения и с повреждением костей и внутренних органов.
Клиническая картина и диагностика. Клинические проявления забрюшинной гематомы зависят от количества излившейся крови, а также от характера повреждений костей и внутренних органов. При небольших гематомах в случае сочетанной травмы на первый план выступают симптомы поражения внутренних органов. Обширные гематомы обычно сопровождаются шоком и внутренним кровотечением, а также симптомами раздражения брюшины и пареза кишечника. Диагностика забрюшинной гематомы довольно сложна, особенно при сочетанной травме с повреждением внутренних органов. При обзорной рентгенографии можно выявить нечеткость контура подвздошно-пояс-ничной мышцы, смещение тени почки или ободочной кишки. Диагноз уточняют с помощью компьютерной томографии и ультразвукового исследования.
Лечение. Забрюшинные гематомы поддаются консервативному лечению (ликвидация шока и кровопотери, нормализация нарушенных функций внутренних органов). При подозрении на повреждение органов забрюшинного пространства и особенно крупных сосудов показано оперативное вмешательство.
ГНОЙНО-ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ ЗАБРЮШИННОЙ КЛЕТЧАТКИ
Абсцессы и флегмоны возникают как осложнение воспалительных заболеваний забрюшинно расположенных органов. Инфекция может проникать гематогенным и лимфогенным путем из более отдаленных гнойных очагов. Выделяют параколиты, паранефриты и флегмоны собственно забрюшинной клетчатки.
Клиническая картина и диагностика. Клиническая симптоматика гнойников забрюшинной клетчатки разнообразна, что объясняет определенные трудности в диагностике. На первый план выступают общие симптомы гнойного процесса — высокая температура тела, ознобы, тахикардия, увеличение количества лейкоцитов в крови, нарастание СОЭ. По мере формирования абсцесса и его увеличения появляются боли в поясничной области, боковых отделах живота или в глубине брюшной полости (при параколите). При контакте абсцесса с подвздошно-поясничной мышцей развивается сгибательная контрактура бедра. В случае прорыва забрюшинного абсцесса через брюшину возникает перитонит. Диагностике помогает рентгенологическое исследование, хотя при этом трудно выявить прямые симптомы гнойной полости. Существенную помощь оказывают компьютерная томография и ультразвуковое исследование.
Лечение. При отсутствии симптомов гнойного расплавления тканей применяют консервативное лечение, в случае выявления абсцесса или флегмоны показано широкое вскрытие и дренирование гнойника.
ОПУХОЛИ
Выделяют четыре группы опухолей: мезенхимального, нейрогенного происхождения, тератомы и кисты. Опухоли бывают доброкачественными (фиброма, липома, невринома, лейомиома) и злокачественными (различного гистологического типа саркомы).
Диагностика забрюшинных опухолей достаточно сложна, так как клинические проявления заболевания возникают довольно поздно, когда опухоль вызывает сдавление либо смещение того или иного органа и нарушение его функции. Иногда больные сами впервые определяют у себя опухоль в животе. Установление диагноза требует тщательного исследования органов брюшной полости (рентгенография желудка, ирригоскопия, урография, ангиография) для исключения первичного очага в одном из этих органов и выявления степени его смещения опухолью. Наиболее информативны в диагностике опухолей ультразвуковое исследование и компьютерная томография.
В забрюшинном пространстве наиболее часто встречаются опухоли почек и надпочечников. Опухоли почек и мочевыводящих путей относят к урологическим заболеваниям, поэтому в данном разделе будут описаны лишь опухоли надпочечников.
В связи с тем что надпочечник является органом, продуцирующим гормоны, опухоли, развивающиеся из его ткани, чаще всего обладают гормональной активностью. Наиболее часто встречаются кортикосте-рома, анд росте рома, кортикоэстрома, альдостерома, смешанные опухоли коры надпочечников, феохромоцитома. Все эти виды опухолей могут быть как доброкачественными, так и злокачественными.
Кортикостерома развивается из пучковой зоны коркового вещества надпочечника. Опухолевая ткань в избыточном количестве продуцирует кортизол, что является причиной развития синдрома Иценко — Кушинга. Заболевают чаще женщины (почти 80%) в возрасте 20—40 лет. В клинической картине преобладают симптомы, характерные для болезни Кушинга: ожирение, гипертрихоз. Появляются атрофические полосы на коже груди и живота, нарушения половой функции — дисменорея, аменорея. Почти у всех больных выявляют артериальную гипертензию, нередко развивается стероидный диабет. У многих больных определяют нарушения психики, что выражается чаще всего в депрессии. В диагностике болезни решающая роль принадлежит изучению концентрации уровня 17-кетостероидов (17-КС) в крови и суточной моче. При кортикостероме этот показатель значительно повышен, особенно при злокачественном характере опухоли.
Андростерома развивается из сетчатой зоны коркового вещества надпочечника. Клинические проявления болезни связаны с чрезмерной продукцией андрогенов. Заболевание возникает в молодом и зрелом возрасте. Чаще болеют женщины. В детском возрасте у девочек появляется гипертрихоз, ускоряется рост, чрезмерно развивается мускулатура, голос становится низким, грубым. У мальчиков наступает преждевременное половое созревание: характерны усиление развития мускулатуры, невысокий рост, короткие нижние конечности. У женщин заболевание проявляется симптомами маскулинизации с развитием мужских половых признаков — уменьшением подкожной жировой клетчатки, усилением развития мускулатуры, атрофией молочных желез, нарушением менструальной функции, часто возникает гирсутизм.
При исследовании гормонального профиля пациента обращает на себя внимание резкое повышение концентрации 17-КС в моче.
Кортикоэстрома (феминизирующая опухоль коркового вещества надпочечника) встречается довольно редко. В основе болезни лежит гиперпродукция тканью опухоли эстрогенов. У девочек болезнь проявляется ускорением физического развития с ранним половым созреванием, у мальчиков — отставанием в половом развитии. У мужчин выявляют симптомы феминизации — гинекомастию, распределение подкожной жировой клетчатки по женскому типу, отсутствие волос на лице, повышение тембра голоса, нарушение половой функции. У женщин гормональные проявления опухолевого роста не дают клинических симптомов. В моче обнаруживают увеличение концентрации эстрогенов.
Альдостерома (первичный гиперальдостеронизм, синдром Конна) развивается из клубочковой зоны коркового вещества надпочечника.
В подавляющем большинстве случаев опухоль носит доброкачественный характер и лишь в 5% — злокачественный. Опухолевая ткань вырабатывает в избыточном количестве ал ьдосте рои. Следует помнить, что избыточная продукция альдостерона в 75% случаев обусловлена наличием опухоли, а в 25% — двусторонней гиперплазией клубочковой зоны надпочечника. Вторичный гиперальдостеронизм протекает (в отличие от первичного) с повышенным выделением ренина (например, при стенозе артерии надпочечника или при циррозе печени). Заболевание чаще поражает женщин зрелого возраста. Симптомы альдосте-ромы разнообразны. Наиболее часто выявляют мышечную слабость, парестезии, судороги. Часто наблюдают полиурию, никтурию, гипо-стенурию. В связи с потерей большого количества жидкости с мочой развивается жажда. Значительные нарушения выявляют в водно-электролитном обмене (гипокалиемия, гипернатриемия, гипохлоремия). При исследовании кислотно-основного состояния определяют метаболический алкалоз. Экскреция калия с мочой увеличена, натрия — снижена.
В моче выявляют повышенное содержание альдостерона, активность ренина плазмы крови значительно снижена.
Феохромоцитома развивается из мозгового вещества надпочечника или хромаффинной ткани в области вегетативных нервных сплетений. Опухоль может быть одиночной и множественной, доброкачественной и злокачественной. Заболевание чаще возникает в зрелом возрасте у мужчин и женщин примерно с одинаковой частотой. Имеются сообщения о семейном характере феохромоцитомы. Клинические проявления заболевания обусловлены гиперпродукцией тканью опухоли адреналина и норадреналина. Кардинальным симптомом феохромоцитомы является артериальная гипертензня, которая может быть двух типов — стабильной (70%) и пароксизмальной (30%), в связи с чем и выделяют соответствующие типы клинического течения болезни. Артериальная гипертензия достигает довольно высоких цифр — 250 мм рт. ст. и выше. Кроме того, часто наблюдаются головные боли (у 80% больных), потливость, повышенная возбудимость, беспокойство, дрожание рук, бледность лица, тошнота.
Длительная артериальная гипертензия приводит к патологическим изменениям во внутренних органах, которые аналогичны таковым при гипертонической болезни.
В диагностике феохромоцитомы ведущая роль принадлежит исследованию концентрации катехоламинов в крови и в моче. Гиперпродукция норадреналина и повышение экскреции этого гормона с мочой при нормальной концентрации адреналина характерны для экстраад-реналовой локализации опухоли. Одновременное повышение концентрации обоих гормонов в моче более характерно для надпочечниковой локализации опухоли. На практике довольно часто используют определение концентрации ванилил-миндальной кислоты в моче. Эта кислота является метаболитом обоих гормонов, и ее концентрация в моче в несколько десятков раз превышает концентрацию адреналина и норадреналина. Для феохромоцитомы характерно значительное увеличение концентрации ванилил-миндальной кислоты в моче.
Гормонально-неактивные опухоли надпочечников встречаются редко. Чаще других обнаруживают неврогенные, соединительнотканные опухоли (доброкачественные и злокачественные), а также кисты. Обычно они протекают бессимптомно и проявляются лишь при достижении значительных размеров. Принципы диагностики, и лечения такие же, как при гормонально-активных опухолях.
Лечение. Все опухоли забрюшинного пространства требуют хирургического, а злокачественные — комбинированного (хирургическое и лучевое) лечения. Прогноз при доброкачественных опухолях относительно благоприятный, но эти опухоли склонны к рецидивированию, что требует повторных хирургических вмешательств. При злокачественных опухолях прогноз неблагоприятный.
ТРАНСПЛАНТАЦИЯ ОРГАНОВ
Трансплантация органов стала возможной благодаря разработке А. Каррелем сосудистого шва. Ниже приведены основные даты исследований, которые способствовали развитию трансплантологии — учения о пересадке органов и тканей.
