
[Rukavishnikov_A.I.]_Azbuka_raka(BookFi.org)
.pdf
Итак, маргинотомия ДНК в процессе деления нормальной клетки,– это и есть молекулярная причина и «счѐтчик» ограниченного числа деления, старе-
ния и смерти нормальной клетки.
Маргинотомия или укорочение теломер молекулы ДНК является повре-
ждением ДНК клетки. Поэтому считают, что гибель клетки после «лимита Хейфлика» происходит через апоптоз. Это имеет биологический смысл: клетки всех тканей должны обновляться, иначе живое не может существовать. Так что природа живого предусмотрела ограничение числа делений нормальной клетки и еѐ гибель с этой целью.
При репликации дочерней молекулы ДНК в качестве матрицы использу-
ется одна из ее цепей: нематричная – для одной дочерней молекулы ДНК, мат-
ричная – «стяжками Оказаки назад» – для другой. Предположение нашего учѐ-
ного – проф. А.М. Оловникова о том, что репликация ДНК с помощью ДНК-
полимеразы всегда происходит с укорочением концов дочерней молекулы, а
значит и хромосомы, многие учѐные называют открытием «на кончике пера»
(А.Г. Голубев, 1996). Это предположение было подтверждено в 1972 г. Д. Уот-
соном (J.D. Watson, 1972). Он учѐл другую особенность фермента при реплика-
ции ДНК, но с теми же последствиями, что предсказал A.M. Оловников.
Оказалось, что ДНК-полимераза не может синтезировать копию из нук-
леотидов ни нематричной, ни матричной цепи, а может только достраивать уже существующую короткую цепочку нуклеотидов и только с 3’-конца растущей цепи ДНК. Что из себя представляет эта короткая цепочка нуклеотидов, и кто еѐ синтезирует?
Это короткая цепь из 10 до 20 нуклеотидов, комплементарных матери-
нской цепи, т.е. матрице, и называется затравкой. Она образует начальный 5’-
концевой участок дочерней цепи. Еѐ синтезирует другой фермент – РНК-
полимераза, называемая праймазой (от англ. primer – затравка). ДНК-
полимераза присоединяется к 3’-концу затравки и удлиняет дочернюю цепь комплементарными нуклеотидами в направлении от 5’ к 3’, но с 3’-конца затра-
вки (Рис. 3).
70

Рис. 3. Репликация нематричной цепи ДНК: I-II – достраивание нуклео-
тидами 3’-концов праймерами на нематричной цепи материнской ДНК; II-III –
выщипление рибонуклеотидов праймерной РНК; III-IV – заполнение брешей от праймерной РНК, начиная от 3’-концов фрагментов Оказаки; V – дочерняя ДНК с укороченной нематричной цепью (рис. и цит. по: А.Г. Голубев, 1996).
После репликации дочерней цепи молекулы ДНК, крайняя затравка уда-
ляется, т.е. выщипляется специальным ферментом. В матричной цепи также удаляется затравка из фрагментов Оказаки.
Удаление самой крайней затравки приводит к тому, что дочерняя цепь как нематричной, так и матричной цепи оказывается короче на длину затравки,
т.е. на 10-20 нуклеотидов. В результате 3’-конец нематричной цепи ма-
теринской ДНК остается недореплицированным, а 5’-конец матричной цепи дочерней молекулы ДНК оказывается укороченным на длину затравки.
В результате этой особенности репликации, ведущей к укорочению 5’-
конца дочерней цепи, 3’-конец нематричной цепи в дочерней молекуле ДНК получается ни с чем не спаренным и образует выступающий 3’-конец матери-
нской цепи, его называют 3’-оверхенг. В нормальной клетке этот одноцепочеч-
ный конец уничтожается каким-либо ферментом, в результате дочерняя моле-
71

кула укоротится с конца, а значит, укоротится перед делением клетки и хромо-
сома.
Ясно, что с каждой последующей репликацией перед делением нормаль-
ной клетки, концы цепей дочерней молекулы ДНК – 3’- и 5’-конец – укорачи-
ваются на величину затравки (Рис. 4).
Рис. 4. Уничтожение выступающего 3’-конца нематричной цепи в дочер-
ней молекуле ДНК. В результате: укорочение 3’- и 5’-го конца цепей в дочер-
ней молекуле ДНК на одинаковую длину.
Итак, то, что считалось сегментом телогена, теперь это – РНК-праймер, а
телоген – это теломера, или теломерная ДНК.
Г. Мюллер (1932) раньше всех понял, что теломеры на концах хромосомы предохраняют хромосому от разрушения. Но многие годы о теломерах больше ничего не было известно, в частности, из чего они состоят.
Лишь в конце 1970-х – начале 1980-х годов американские генетики Е.
Блэкберн и Дж. Голл открыли строение теломеры.
Оказалось, что теломера в хромосоме человека – это гексануклеотид с тимином на 5’-конце и целиком из гуанина – на 3’-конце, т.е. – ТТАГГГ. Эта последовательность создаѐт концы молекулы ДНК, а в комплексе с белками, –
концы хромосомы.
ТТАГГГ создаѐт фрагмент Г-цепи, а комплементарные ему основания – фрагмент Ц-цепи. Такой двухцепочечный фрагмент многократно повторяется и создаѐт концы молекулы ДНК, а в комплексе с белками – концы хромосомы. В
литературе употребляются равнозначные термины – теломера или теломерная ДНК.
72

Именно теломера укорачивается на длину РНК-праймера при каждой ре-
пликации цепи перед делением клетки. Но укорачивается теломера, а гены при этом обычно не страдают.
Укорочение теломеры на величину праймера каждый раз перед делением клетки – это метка, указывающая сколько ещѐ клетке осталось делиться, то есть жить.
Нормальная клетка прекращает делиться, когда еѐ теломеры становятся слишком короткими, чтобы защитить концы хромосом от склеивания или их неправильного распределения – анеуплоидии и пр. На этом этапе в клетке во-
зникает сигнал на самоуничтожение, т.е. апоптоз, а не тогда, когда теломеры полностью «расходуются».
Потери теломеры на 10-20 нуклеотидов при каждом делении нормальной соматической клетки, позволяют ей делиться, т.е. жить не более «лимита Хейф-
лика»: 50±10 раз.
Итак, предположение немецкого биолога А. Вейсманн (1891) о том, что способность нормальной клетки к делению «не вечна, но ограничена», впервые нашло подтверждение в 1961 г. в работе Л. Хейфлик с П. Мурхедом в опытах с нормальными клетками в культуре. Однако, выяснить причины этого явления им не удалось.
В 1953 г. была открыта структура молекулы ДНК и, исходя из неѐ, был объяснен механизм ее репликации, которая необходима любой клетке перед еѐ делением.
Однако, в 1971 г. наш учѐный, ныне сотрудник Института биохимической физики РАН, проф. А.М. Оловников, впервые обратил внимание на то, что ДНК-полимераза «не в состоянии» полностью копировать концы цепочек нук-
леотидов молекулы ДНК. Следствием этого должно быть укорочение, т.е. не-
дорепликация ДНК перед каждым делением нормальной клетки. Это и оказа-
лось молекулярной причиной ограниченного числа деления нормальной клетки любого типа – лимит Хейфлика.
73

Проф. А.М. Оловников предсказал и способ, которым клетка могла бы решать эту проблему: «наращивание некодирующей белок последовательности нуклеотидов, которую не жалко было бы потерять при репликации» (акад. В.П.
Скулачѐв, 1997).
По его мнению, для наращивания нуклеотидов необходим особый фер-
мент. В 1985 г. его открыли другие учѐные, – это фермент теломераза.
Понимание механизма работы и регуляции этого фермента позволит учѐ-
ным глубже проникнуть в сущность процессов старения и бессмертия раковой клетки.
Акад. В.П. Скулачѐв (1997) писал так: «Работа А.М. Оловникова – один из немногих примеров, когда блестящая мысль отечественного учѐного не ос-
талась забытой, но, к сожалению, получила развитие, не у нас в стране, а за ру-
бежом, причем приоритет автора общепризнан и нигде не подвергается сомне-
нию».
3.2. Передача сигнала извне для деления нормальной клетки
Организм взрослого человека из 5.1013-14 клеток (В.Н. Сойфер, 1998 и др.).
По признакам структуры и функции эти клетки разделены на типы, – их более
200.
Функции любого типа клетки в многоклеточном организме определяются генами через их продукты – белки. В разных клетках имеет место экспрессия разных генов, остальные гены «молчат». Клетка в организме – его часть; свои-
ми функциями она вносит свой вклад для нужд организма как целого. Так что в жизни клетки каждого типа определено: «что ей позволено, а что – нет» (Е.Д.
Свердлов, 1999).
Деление клетки, т.е. размножение, – признак того, что она живая. Этим свойством старые и дефектные клетки ткани заменяются новыми, а, значит, об-
новляется организм. Без этого многоклеточный организм не может жить.
74

В организме нормальная клетка может делиться лишь после получения сигнала к делению. Без сигнала ей это «запрещено» генами.
Любое свойство клетки определяется микросредой, окружающей клетку.
В состав этой среды входят: 1) соседние клетки, с которыми она связана моле-
кулами; 2) внеклеточный матрикс – продукт самих клеток; с ним клетка также связана молекулами; 3) жидкая среда – тканевая жидкость, кровь и лимфа
(Ю.М. Васильев, 1997).
Для деления клетка получает сигнал из микросреды – из тканевой жидко-
сти, от клеток-соседей и от внеклеточного матрикса.
Чем является сигнал для клетки в организме? Это сигнальная молекула,
иначе – молекула-лиганд. Для размножения клетки ей нужны молекулы-
лиганды. Среди них – это молекулы фактора роста и цитокины. С химической точки зрения, это белки. Через молекулы-лиганды клетки разного типа осуще-
ствляют связи между собой, обмениваются информацией и этим создают мно-
гоклеточный организм как единое целое.
Откуда берутся молекулы-лиганды для нормальной клетки? Они не син-
тезируются в самой этой клетке. Они синтезируются в других клетках, выделя-
ются из них и мигрируют к другим клеткам, в том числе и к ней.
Это важно для отличия нормальной клетки от раковой клетки.
Что нужно, чтобы молекула-лиганд подействовала на клетку? Для этого нужна молекула-рецептор на клетке, на которую будет действовать молекула-
лиганд.
В клетке разного типа синтезированный белок обычно своей частью вы-
ставляется на поверхность клетки. Это продукт генов данного типа клетки.
Белки данного типа клетки своего рода антенны – это и есть молекулы-
рецепторы. Они определяют набор молекул-лиганд, с которыми может реаги-
ровать клетка данного типа. Реагирование клетки означает, что еѐ молекула-
рецептор будет узнавать в межклеточной среде свою молекулу-лиганд и соеди-
няться с ней. Молекула-лиганд своей поверхностью комплементарна поверхно-
сти молекулы-рецептора, т.е. подходит, как субстрат к своему ферменту. Если
75

клетка не имеет специфического рецептора, она «слепа» в отношении этого сигнала. Клетку, способную воспринимать свой сигнал, называют клеткой-
мишенью.
Что представляет собой молекула-рецептор? Это молекула белка, напри-
мер, ростового фактора. В ней различают три части: внешняя часть – на по-
верхности мембраны клетки, контактирует с межклеточной жидкостью; сред-
няя часть – пересекает насквозь мембрану клетки, и внутреннюю часть – вы-
ступает в цитоплазму клетки (Рис. 1).
Рис. 1. Схема строения молекулы-рецептора.
Для деления нормальной клетки молекулой-лигандом обычно являются факторы роста (GF): эпидермальный фактор роста (EGF), тромбоцитарный фак-
тор роста (ТGF), интерлейкины 1, 2 и др. Но только прохождение фазы G1 кле-
точного цикла стимулируется такими митогенами. У многих молекул-
рецепторов внутренняя часть является ферментом – протеинкиназой. Функция киназы – присоединять фосфатную группу к белку и этим активировать его.
Другие ферменты фосфатазы отщепляют фосфатную группу и этим прекраща-
ют активность белка.
Так как для деления клетки необходима репликация еѐ ДНК, а также ряд белков, в том числе ферменты, то ясно, что путь передачи сигнала к делению начинается на мембране клетки и заканчивается в ядре клетки (Рис. 2).
76

Рис. 2. Схема этапов передачи сигнала для деления клетки (рис. и цит. по:
Г.П. Георгиев, 1999) с изменениями.
1-й этап. Молекула-рецептор своим участком связывается с молекулой-
лиганд. Это вызывает аллостерическое изменение внутренней части молекулы-
рецептора. Изменение формы этой части активирует рецептор (Рис.3).
2-й этап. Протеинкиназа активирует цепочки белков в цитоплазме при-
соединением к белку фосфатной группы, активируя его; он активирует сле-
дующий в цепочке белков и т.д.
3-й этап. Передача сигнала активированным белком переходит в ядро клетки. Там активируются белки транскрипции для синтеза иРНК и др. иРНК после выхода из ядра направляются в рибосомы, где по ним синтезируются но-
вые белки для следующего деления клетки, в ядре – синтез ДНК, т.е. еѐ репли-
кация и затем деление клетки.
Рис. 3. Схема связывания рецептора с молекулой-лигандом.
77
Все этапы передачи сигнала в клетке обратимы, как только молекула-
лиганд отделяется от рецептора или в результате распада самой молекулы-
лиганда. Обратимы также и промежуточные этапы цепи передачи сигнала – пу-
тѐм удаления фосфатной группы с белка.
Передача сигнала извне для деления нормальной клетки регулируется ря-
дом генов через их продукт – белки. Эти белки в нормальной клетке являются молекулой-лигандом, молекулой-рецептором, протеинкиназой С и белками це-
почки передачи сигнала в цитоплазме, а в ядре – белками транскрипции.
Это были обычные белки-рецепторы для вызова ответа нормальной клет-
ки.
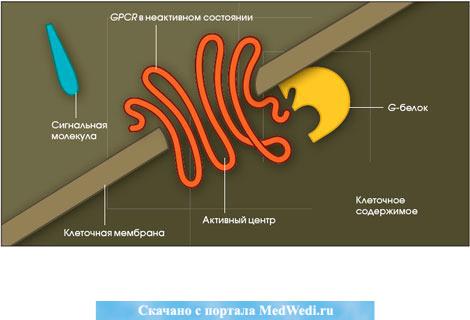
Но на мембране клетки имеется также универсальные белки-рецепторы,
сопряженные с G-белком, их обозначают – GPCR, от англ. G-protein coupled receptor. Он реагирует на молекулу-лиганд любого типа.
GPCR – это белок, полипептидная цепь которого семь раз пересекает мембрану клетки. В нѐм два участка: с внешней стороны мембраны участок,
вылавливающий молекулу-лиганд, а участок, контактирующий с G-белком, –
на еѐ цитоплазматической стороне.
Его действие на клетку реализуется по химическому сигналу к внутри-
клеточным мишеням через G-белок. Пока с активным центром GPCR не свя-
жется молекула-лиганд, он находится в неактивном состоянии – «выключен».
Причина: нет контакта его участка с G-белком. Результат – нет ответа клетки
(Рис. 4).
78

Рис. 4. GPCR в клетке «выключен». Нет ответа клетки (рис. и цит. по: Т.
Кенакин, 2007).
GPCR «включается», когда молекула-лиганд связывается с его активным центром, и тогда участок его молекулы связывается с G-белком. Этот белок ак-
тивируется и посылает сигналы клетке. Результат – возникает ответ клетки
(Рис. 5).
Рис. 5. GPCR в клетке «включен». Есть ответ клетки (рис. и цит. по: Т.
Кенакин, 2007).
Знания о функциях GPCR и G-белка в нормальной клетке важны для по-
нимания нарушений в раковой клетке. Эти молекулярные структуры становятся новыми мишенями для создания селективно действующих лекарств, уничто-
жающих раковые клетки.
79
