
[Rukavishnikov_A.I.]_Azbuka_raka(BookFi.org)
.pdf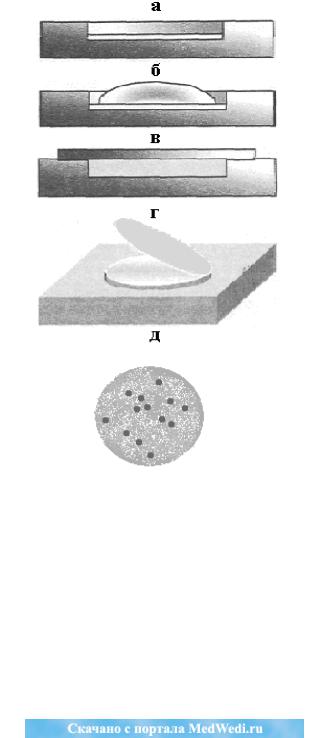
ММК может сочетаться с ПЦР для размножения молекул-мишеней. Сна-
чала гель полимеризуют, затем вымачивают в воде, чтобы удалить все раство-
римые вещества, затем автоклавируют и сушат.
Перед началом ПЦР гель пропитывают реакционной смесью. Этим авто-
ры достигают полного сохранения активности ДНК-полимеразы и уничтожения молекул ДНК из окружающей среды, которые могли бы попасть в гель при его приготовлении. Синтез кДНК на молекуле иРНК может быть осуществлѐн от-
дельно или в геле. Для детекции мишеней используется универсальная реа-
кционная смесь с ДНК-полимеразой (Рис. 5).
Рис. 5. Схема проведения ПЦР-ММК (рис. и цит. по: А.Б. Четверин, Е.В.
Четверина, 2002).
1.а – лунка с высушенным полиакриламидным гелем;
2.б – пропитывание геля реакционным раствором, содержащим, в том числе, исследуемый образец и специфические праймеры;
180

3.в – инкубация геля в течение 30 мин при 55-65° С – условия обратной транскрипции, с последующими 40 циклами ПЦР;
4.г – промакивание геля нейлоновой мембраной – перенос колоний;
5.д – гибридизация мембраны с радиоактивно меченым зондом, специ-
фичным к искомой мишени; получение радиоавтографа мембраны.
Как пишут авторы метода, «ММК позволяет преодолеть все проблемы стандартной ПЦР и впервые сделать ПЦР-диагностику действительно чувстви-
тельной, количественной и надѐжной» (2003).
Основные отличия ПЦР-ММК от стандартной ПЦР
1) Реакционную смесь для размножения мишеней – ДНК и РНК, вносят не в жидкость в специальной пробирке, а в лунку с пленкой высушенного поли-
акриламидного геля. В результате чего «потомство каждой молекулы образует колонию, а не распространяется по реакционному объѐму».
2) Каждая колония является клоном молекул, а число колоний прямо ука-
зывает «на число молекул ДНК или РНК, присутствующих в геле до начала ре-
акции».
3) ПЦР-ММК фактически дешевле стандартной ПЦР: а) «многократно» сокращает число проб для проведения анализа; б) расход реактивов «почти та-
кой же»: объѐм геля – 65 мкл, в стандартной ПЦР объѐм реакционной смеси 50
мкл.
Для выполнения ПЦР-метода, а тем более ПЦР-ММК пригодны любая ткань, биологическая жидкость и выделения человека. По генным маркерам эти методы позволяют выявлять минимальное число раковых клеток при раке кро-
ви и лимфатической системы, так и при солидном раке. Это крайне важно для ранней диагностики раковых клеток первичного очага рака или метастазов, а
также для выявления остатков раковых клеток после лечения рецидива рака.
Плазма крови от пациента является универсальным источником генных маркеров из раковых клеток любого типа клетки, т.е. любой локализации рака у пациента.
181

Повышение содержания генов-маркеров из раковых клеток в плазме кро-
ви при раке установлено многими исследователями.
Проф. Д. Сидрански (1994) считает, что ПЦР позволила совершить «гене-
тическую революцию в ранней диагностике рака», подчѐркивая следующее:
- рак начинается из одной клетки, утратившей зависимость деления от за-
щитных механизмов организма;
- в такой клетке возникают изменения генов, что вызывает бесконтроль-
ное еѐ деление с образованием из неѐ клона клеток – рак;
- особенность лечения человека от рака в том, что эффект лечения возмо-
жен лишь до образования его метастазов;
- рак опасен из-за того, что отдельные его клетки отрываются от клона и,
продолжая делиться, проникают в окружающие здоровые ткани, а другие обра-
зуют метастазы в отдалѐнных органах. Это причина гибели людей от рака;
-ПЦР позволяет в биологических жидкостях от больного выявлять самые начальные изменения в структуре ДНК клеток, а в сущности предрак;
-с помощью ПЦР удаѐтся в жидкостях обнаружить даже одну дефектную или мутантную молекулу ДНК из раковых клеток среди многих других молекул
висследуемой жидкости; чувствительность этого метода до 100%.
-ПЦР – это универсальный метод для ранней диагностики раковых кле-
ток любой локализации рака у пациента. Им можно выявить тех лиц, которых необходимо обследовать детально.
Проф. А.С. Белохвостов (2000) впервые в двух работах изложил основы ранней диагностике раковых клеток с помощью ПЦР-метода; мы излагаем их кратко:
1) бессимптомный рост рака от одной клетки до очага в 2 мм в ткани про-
должается долгие годы или даже десятилетия; 2) такой очаг из раковых клеток до 2 мм в диаметре дремлет в тканях до
тех пор, пока не произойдут изменения в генах его клеток, вызывающих ангио-
генез и лимфангиогенез. С этого момента начинается рост и распространение
182

его клеток через кровь и лимфу по организму пациента – рак становится болез-
нью всего организма.
3) ещѐ недавно диагностировать рак размером 2 мм, особенно если он на-
ходился во внутренних органах, было почти не возможным. И только метод ПЦР позволил определять очень малое число дефектных генов, иногда даже одну молекулу дефектного гена из раковой клетки.
Раковые клетки содержат эпимутации основных свойств и мутации или эпимутации генов-супрессоров. Такие изменения являются генетической мет-
кой, т.е. маркером раковой клетки.
Ген-супрессор белка р53. В норме он сдерживает деление «генетически дефектных клеток и заставляет их запускать апоптоз».
Мутации в этом гене обнаруживаются в половине случаев раковой клетки разного типа; эти поломки в гене «позволяют генетически дефектной клетке избежать апоптоза».
Ген-супрессор белка p16. Он в норме подавляет деление дефектной клет-
ки «в другой точке клеточного цикла», но инактивирован из-за метилирования его промотора почти у половины раковых клеток разного типа.
Ген k-ras – мутантная форма одного из ключевых нормальных генов сти-
муляторов деления клетки. Есть ещѐ ряд генов с высокой частотой дефектов в раковой клетке. Для ранней диагностики раковой клетки важна регистрация эпимутаций и мутаций в нескольких генах.
ДНК из раковых клеток попадает «в межклеточную жидкость и далее в кровоток» после разрушения раковых клеток в тканях.
В плазме крови у таких пациентов будут, пишет автор, находиться фра-
гменты ДНК из раковых клеток. Обнаружить их долго не удавалось, пока не появился ПЦР-метод.
По расчѐтам проф. А.С. Белохвостова и первый его опыт применения это-
го метода показал возможность диагностировать в любой ткани рак размером с
2-х мм в диаметре.
183

Автор подчѐркивает, что диагностика раковых клеток в организме паци-
ента по их генам-маркерам в плазме крови ПЦР-методом, позволяет осу-
ществлять слежение за эффектом лечения рака. Он рекомендует сроки взятия для этого плазмы крови: до операции, после операции иссечения рака и путей лимфооттока, а также спустя не ранее, чем через 2 недели после лечения, и по-
сле химиотерапии.
Если, маркер, например ген белка р53, выявлен в клетках и в плазме до операции и/или после окончания химиотерапии, это означает, что раковых кле-
ток «или совсем не осталось в организме или их незначительная часть находит-
ся в покоящемся состоянии». В любом случае, рецидив или метастазы в бли-
жайшие месяцы маловероятны.
«Если же мутантный ген или измененный в экспрессии ген продолжает выявляться в ДНК плазмы крови или его количество нарастает, это указывает на рецидив рака или метастазы. Это требует изменения схемы лечения – добав-
ления или замены химиопрепаратов, средств биотерапии и т.д.». Такие анализы учѐный рекомендует выполнить несколько дней, а «значение ответа – ценою в жизнь».
Мы видим, что учѐные сконцентрировали свое внимание на поиске в плазме и других биологических жидкостях генов-маркеров из ядер раковых клеток, а это нелегкая задача (В.П. Шелепов и соавт., 1997).
Оказалось, что мутации могут быть и в митохондриях – органеллах, рас-
положенных в цитоплазме клетки и обнаружить их в раковых клетках до-
статочно просто. Это открытие сделано проф. Д. Сидрански (2000).
Гены, превращающие нормальную клетку в раковую клетку, часто нахо-
дятся в ядре клетки в виде одной или многих копий. Но, оказалось, что дефекты и изменения могут возникать не только в них, но и в генах митохондрий рако-
вой клетки.
В каждой клетке, в том числе и раковой, имеется несколько сот митохон-
дрий. Митохондрии – это самореплицирующиеся органеллы.
184

В каждой из них есть своя ДНК, в ней несколько генов, обеспечивающих синтез белков митохондрий. Количество копий такой ДНК может быть от од-
ной до десяти на митохондрию.
Гены ДНК митохондрий в раковых клетках подвергаются «усиленному воздействию токсических продуктов кислорода». Это вызывает «накопление большого числа изменений в генах митохондрий, чем в генах ядра раковой клетки».
В результате мутации ряда генов митохондрий выявляются в более чем половине случаев раковой клетки разного типа.
Другой важной особенностью в раковой клетке является «вытеснение ми-
тохондрий с нормальными генами путѐм преимущественного размножения ми-
тохондрий с мутантной ДНК». Это приводит к тому, что «все митохондрии в раковой клетке становятся потомками митохондрий с мутантными генами еѐ ДНК».
Отсюда: если «в гене, находящемся в ДНК ядра клетки может быть лишь одна или две копии мутантного гена, то в митохондриях одной раковой клетки может находиться от нескольких сотен до десяти тысяч копий мутантного гена митохондриальной ДНК».
Из этого, проф. А.С. Белохвостов (2000) делает вывод: «если раковые клетки обнаруживать по мутантным генам митохондрий в плазме крови и в других биологических средах пациента, чувствительность ПЦР-теста можно увеличивать ещѐ в сотни раз по сравнению с применяемым сейчас методом вы-
явления маркеров измененных генов из ДНК ядра раковой клетки».
Сейчас, пишет проф. А.С. Белохвостов, возможным пределом размера обнаруживаемого рака считается очаг в 2-3 мм в диаметре, то при применении ПЦР для поиска в плазме крови мутантных генов митохондриальной ДНК, из раковых клеток, по-видимому, можно будет определять очаг рака в ткани в 1
мм в диаметре.
185

В случае успеха такого подхода к оценке генов-маркеров раковых клеток ядерного генеза будут добавлены гены-маркеры из ДНК митохондрий раковых клеток.
О повышении выявляемости раковых клеток автор даѐт пояснения. Он говорит, что «мутации какого-либо гена раковой клетки, взятого в качестве маркера, встречаются только у части пациентов».
Изменения в экспрессии генов свойств нормальной клетки – главная при-
чина канцерогенеза.
Метилирование CpG-островков в промоторе гена выключает ген, а деме-
тилирование – включает ген. При этом изменений структуры в последователь-
ности оснований гена не происходит. Это обозначают термином – эпимутация,
о чѐм мы уже писали в разделе канцерогенеза.
Метилирование или деметилирование промотора генов – это маркеры ра-
ковой клетки. Для анализа статуса метилирования генов раковой клетки часто используют МС-ПЦР – метилспецифическая полимеразная цепная реакция.
Материалом для этого является ДНК раковых клеток в образцах плазмы крови и других биологических жидкостей, фрагменты из опухоли от пациента.
Диагностика раковых клеток по их эпигенетическим изменениям в срав-
нении с нормальной клеткой – это новое направление в ранней диагностике ра-
ковых клеток. Оно открывает новые пути для создания новых лекарственных средств и методов лечения от рака.
В целях изучения канцерогенеза и других проблем учѐные используя ме-
тоды – ПЦР-ММК, МС-ПЦР, микрочипы и др. занялись изучением профилей экспрессии «изолированных клеток и клеточных культур».
1. Фенотип стволовой клетки. Цель – знать типичный профиль экспрес-
сии генов в эмбриональных и региональных стволовых клетках. Оказалось, что в этих клетках набор экспрессируемых генов «ограничен». Это важно для по-
нимания явления «стволовости».
2. Сравнение экспрессии генов в эмбриональных стволовых и раковых клетках. Обнаружено, что многие раковые клетки экспрессируют белки-
186

маркеры эмбриональных стволовых клеток. Например, Oct-4, Nanog и hTERT,
что указывает на сходство биологии эмбриональных стволовых «и, по крайней мере, части раковых клеток».
3. Сравнение профилей экспрессии региональных стволовых и раковых клеток. Профиль экспрессии некоторых типов раковой клетки сходен с профи-
лем экспрессии региональных стволовых клеток той ткани, из которой возника-
ет раковая клетка, это указывает на то, что «именно региональные стволовые клетки в этих тканях способны претерпевать злокачественное перерождение»
(К.Н. Ярыгин, Е.Е. Егоров, И.Б. Чеглаков и соавт., 2006).
7.2. Биочип или микроматрица – устройство для ранней диагностики
раковых клеток, слежения за лечением рака и контроля излечения
Биочип – это организованное размещение молекул ДНК или белка на специальном носителе – «платформе».
Платформа представляет из себя пластинку площадью всего 1 см2 или чуть больше. Она сделана из стекла или пластика, либо из кремния. На ней в строго определѐнном порядке может быть размещено множество молекул ДНК или белка. Отсюда и присутствие в термине слова – «микро».
На биочипе можно проводить анализ молекул различных веществ. Для этого на нѐм закрепляют «узнающие» молекулы. Каждую из таких молекул обозначают термином – «молекула-зонд», а каждую из исследуемых молекул –
«молекула-проба».
Молекула-зонд на биочипе определяется самим исследователем, т.е. он планирует, какую молекулу нужно искать среди молекул в исследуемом мате-
риале – в жидкости и т.д. Если на микрочипе исследуется ДНК – это ДНК-чип,
если молекула белка – белковый чип.
Как фиксируются молекулы-зонды на биочипе?
Во многих странах молекулы-зонды прикрепляют прямо к стеклянной пластинке, т.е. к подложке при помощи лазеров. В нашей стране молекулы-
187

зонды размещаются в ячейки из геля, диаметром менее 100 микрон каждая,
ячейки фиксированы к пластинке в процессе изготовления микрочипа. Коли-
чество ячеек на чипе достигает уже несколько тысяч.
В ячейках молекулы-зонды химически привязаны и находятся в функци-
онально активном состоянии.
Так как ячейки заполнены гелем трехмерной структуры, то они удержи-
вают большее количество молекул-зондов, нежели чипы, в которых молекулы-
зонды просто прикреплены к пластинке. Важно и то, что химическая реакция между молекулой-зондом и вносимой в ячейку из геля молекулы-пробы, проте-
кает как и в жидкостях, а значит, как и в живом организме.
Изучение генома и протеома каждого типа клетки в норме и при любой болезни позволит выяснить – какой ген или гены вызывают ту или иную бо-
лезнь.
На ДНК-чипе выясняется причина возникновения болезни: дефекты в структуре гена или генов, или изменения активности гена при нормальной его структуре.
На белковом чипе определяются последствия «поломок» в гене по из-
менениям его продукта – белков в клетке. Изменения в гене клетки или белке – это их метка или маркер (от англ. mark – знак, метка).
Отсюда: ген с меткой – это ген-маркер, а белок с меткой – это белок-
маркер. Эти маркеры позволяют обнаруживать у пациента дефектную или больную клетку, характерную для конкретной болезни, в том числе и раковую стволовую клетку. При диагностике болезни ген-маркер и белок-маркер для контроля сравнивают с нормальным геном клетки и его продуктом – белками.
Ясно, что на ДНК-чипе молекулой-зондом является ген-маркер, а для контроля в отдельной ячейке – нормальный ген, в белковом микрочипе в ка-
честве молекулы-зонда может быть или антитело, или антиген.
Способы изготовления биочипов
188

1. Молекулы ДНК или белка предварительно синтезируют, а затем раз-
мещают на матрице. Недостаток этого метода: невысокая плотность молекулы-
зонда на матрице – до 1000 молекул и трудоѐмкий процесс их синтеза.
Копии гена-маркера можно получить ПЦР-ММК методом, такого метода для копий белка-маркера нет. Его копии можно создавать встраиванием иРНК гена белка-маркера в бактерию: E. coli или в клетки дрожжей.
2. Для ДНК-чипов синтез олигонуклеотидов производят непосредственно на матрице. Такие чипы обладают гораздо большей плотностью молекул-зон-
дов.
3. Нанесение олигонуклеотидов в строго определѐнное место матрицы струйным принтером.
В нашей стране биочипы – ДНК-чип и белковый чип готовят по первому способу.
Биочип – новейшее устройство для медицины XXI века. По молекулам-
маркерам он позволяет:
1)диагностировать любую болезнь: до еѐ начала или в самом еѐ начале;
2)находить в организме тот или иной вирус, бактерии и раковые клетки;
3)белковым чипом можно находить лекарства среди низкомолекулярных соединений в целом ряде анализируемых материалов;
4)решение этих задач на биочипах можно сделать за считанные часы, а
не дни и т.д.
Принцип действия биочипов и этапы анализа
1. ДНК-чип.
Мы знаем, что молекула ДНК состоит из двух комплементарных цепей.
Основа каждой цепи – это последовательность из четырѐх азотистых осно-
ваний: аденин (А), гуанин (Г), тимин (Г) и цитозин (Ц).
При этом последовательность оснований одной цепи определяет по-
следовательность оснований в другой: А-Т и Г-Ц. Когда между этими ком-
плементарными основаниями спонтанно образуются водородные связи, две це-
пи соединяются, т.е. гибридизуются в двойную спираль и удерживают цепи
189
