
[Rukavishnikov_A.I.]_Azbuka_raka(BookFi.org)
.pdf
Глава 8. Методы уничтожения раковых клеток
8.1. «Малые интерферирующие РНК» – «выключатели» гена и сред-
ство для ингибирования пролиферации раковых клеток
В клетке каждого типа организма одинаковый набор генов. Но только часть из них работает. Причем в одном типе – одни, а в другом типе клетки – другие гены. Мы ещѐ не знаем, какие гены в клетке разного типа включены, а
какие нет.
Включение или экспрессия гена – это синтез копии его кодирующей це-
почки – иРНК, а по ней как на матрице синтез белка в рибосоме клетки.
Этот процесс происходит в клетке так:
-две цепи ДНК в нужном месте разделяются, открывая ген, т.е. участок кодирующей цепи;
-к нуклеотидам его по принципу комплементарности оснований присое-
диняются нуклеотиды, образуя одноцепочечную информационную РНК
(иРНК). В ней, в отличие от ДНК, основание Т (тимин) заменяется основанием
– У (урацил).
Этот процесс переноса информации с гена на РНК с образованием иРНК называется транскрипцией гена. По такому принципу на разных генах в клетке образуется также транспортная (тРНК) и рибосомная РНК (риб-РНК).
иРНК несет в себе всю информацию гена, кроме той, что в интронах гена,
– она удаляется при созревании иРНК. иРНК передает информацию на риб-
РНК в рибосоме клетки. тРНК доставляет к рибосоме части для белков – ами-
нокислоты в соответствии с той инструкцией, что в иРНК. Так на рибосоме строится полипептидная цепь, но обычно цепи, образующие молекулы белков.
Понимание молекулярных причин «включения» и «выключения» генов позволит управлять этим процессом и держать его под контролем, чтобы, на-
пример, предупредить возникновение из нормальной клетки раковой клетки.
В клетке гены, кодирующие белки, составляют 2%, а вне-генная, т.е. не кодирующая белки остальная часть ДНК, составляет 98% генома клетки. По-
210

этому ее назвали – «junk» ДНК, что означает «хлам, утиль». Но «не кодирует» –
не значит, что «не используется».
Оказалось, что во «вне-генной» части имеется множество генов, которые
«разбросаны» внутри обычных генов и между генами. Но их продуктом являет-
ся не белок, а «малые» РНК. В класс «малых» молекул РНК включают молеку-
лы, содержащие короткой длины цепочки нуклеотидов.
Отличия «малых» РНК от трѐх клеточных РНК:
-они из двух цепей нуклеотидов, которые спариваются друг с другом по принципу комплементарности, что и в ДНК хромосом;
-по 3 концам каждой из цепочек всегда остаѐтся два неспаренных нук-
леотида.
В клетке «малые» РНК заняты другим делом: регулируют работу обыч-
ных генов. Они включают их экспрессию или выключают их из экспрессии, ко-
гда это нужно в клетке.
История «малых РНК» клетки началась в начале 90-х годов ХХ в. с экс-
периментов учѐных на цветке «петуний», а затем на черве C.elegans. На обоих живых существах учѐные пытались усилить выражение опредѐленного призна-
ка. Для этого они вводили в их клетки копии гена, т.е. иРНК этого признака. Но вместо усиления выражения, т.е. экспрессии гена, происходило его «замолка-
ние». В биологии это обозначают термином – «сайленсинг» от англ. «silencing»
– молчание, немота. Причиной этого явления оказалась малая интерферирую-
щая РНК (siRNA), которую открыли в 1998 г. ученые из США Эндрю Файр
(Andrew Z. Fire) и Крэйг Меллоу (Craig C. Mello). Эти РНК обладают способно-
стью «выключать» гены путем разрушения их иРНК. Эффект «гашения» экс-
прессии гена «малыми РНК» назван РНК-интерференцией, а короткие молеку-
лы, вызывающие его, назвали siРНК (short interfering RNAs, малые интерфери-
рующие РНК). Это самые короткие молекулы, состоящие у млекопитающих всего из 21-23 нуклеотида.
Вначале было непонятно, как siРНК появляется в клетке после введения в
неѐ копии гена. Авторы открытия выяснили, что в клетке есть молекулярный
211

механизм для синтеза этой молекулы и накопления еѐ. Механизм РНК-
интерференции в клетке запускается двухцепочечной РНК (дцРНК) и осущест-
вляется в несколько этапов.
1-й этап. Белок Дайсер нарезает дцРНК на фрагменты, содержащие ко-
роткие в 21 нуклеотид фрагменты РНК. Это уже siРНК.
2-й этап. Такие фрагменты захватывается комплексом белков – RISC (RNA induced silencing complex).
3-й этап. В комплексе дуплекс коротких РНК расплетается, и только одна цепь siРНК остаѐтся в нѐм. Это фрагмент антисмысловой цепочки гена.
4-й этап. Комплекс RISC с помощью антисмысловой цепи siРНК скани-
рует молекулы РНК клетки. siРНК-наводчик находит комплементарную ей по-
следовательность нуклеотидов в соответствующей смысловой иРНК, т.е. копии гена и разрезает еѐ. Теперь в клетке уже нет иРНК, а, значит, нет и синтеза бел-
ка гена.
Ни один из блокаторов гена, известных до сих пор, не обладает такой специфичностью к своему гену-мишени. Основная функция siРНК – защита ге-
нома клетки. Эти молекулы предохраняют геном от мутаций, генов извне – от вирусов, а также от транспозонов.
Итак, учѐные доказали, что siРНК в клетке блокирует тот ген, матричная цепь которого комплементарна антисмысловой цепи внутри siРНК. Мишенью для молекулы является не сам ген, а его иРНК. То есть ген «выключается» пу-
тѐм разрушения его копии – иРНК, после выхода еѐ из ядра в цитоплазму клет-
ки. Каждая siРНК распознает и разрушает только свою специфическую иРНК и не вызывает никаких побочных эффектов. Замена даже одного нуклеотида внутри siРНК резко снижает эффект интерференции.
Открытие siРНК в 2002 г. признано важнейшим открытием года в списке десяти открытий. Введение в клетку siРНК – это новый метод «выключения» гена (Рис. 1).
212
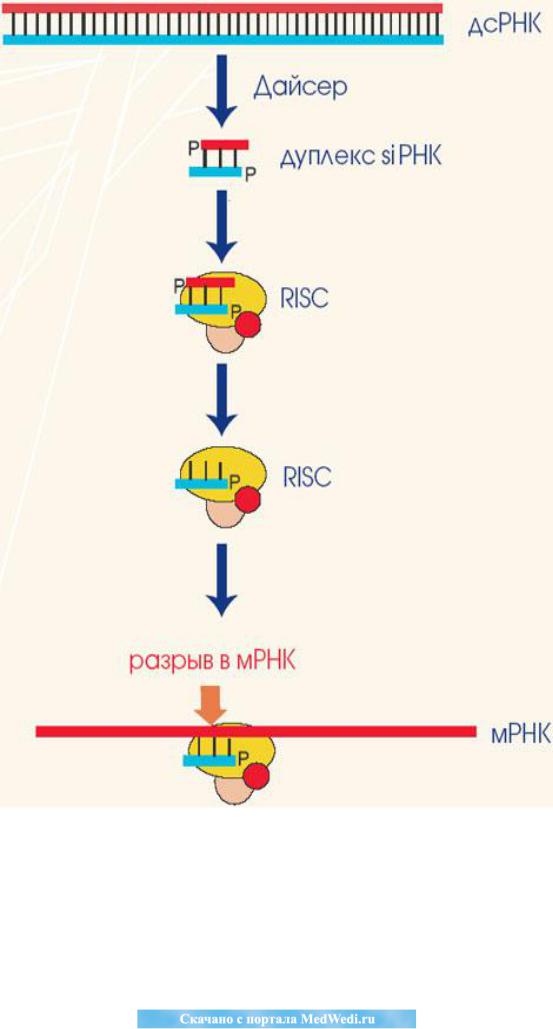
Рис.1. Этапы «РНК-интерференции» в клетке (рис. и цит. по: Т. Бархато-
ва, 2005).
В отличие от антисмысловых РНК, siРНК – «инструмент многоразового использования». Они связываются всѐ с новыми и новыми молекулами специ-
фической иРНК, выводя каждый раз их из строя.
213

Раскрытие генома человека в 2000 г. – это открытие нуклеотидной карты ДНК человека. Однако, эта карта описывает только последовательность нук-
леотидов в каждом гене, но не функции гена. Чл.-корр. Л. Киселѐв (2006) счи-
тает, что теперь стало возможным перейти к созданию карты функций генов.
Эта работа, по мнению Л. Киселева, может быть закончена уже через один-два года.
Метод «выключения» гена очень необходим не только для выяснения функций каждого гена в клетке, но и для «выключения» гена-причины, вызы-
вающего ту или иную болезнь, в том числе возникновение раковой клетки из нормальной клетки ткани. Выяснив гены-причины раковой клетки, можно «за-
глушить» гены, – значит, предупредить и возникновение рака.
Для выявления функций гена необходимо иметь клетки в культуре, и, ис-
пользуя метод Файера и Меллоу, можно по очереди выключать ген за геном и смотреть, какие функции клетки при этом пропадают или появляются. Так лю-
ди будут впервые знать, какую функцию или функции выполняет каждый ген в клетке (Л. Киселѐв, 2006).
За открытие «РНК-интерференци» – подавления генов двухцепочечной РНК, американским учѐным Эндрю Файер и Крейг Меллоу присуждена Нобе-
левская премия в области медицины и физиологии за 2006 г.
Успех применения препарата siРНК зависит от доставки его в клетки-
мишени и защиты его от воздействия ферментов клетки. siРНК должны нахо-
диться в клетке достаточно долго, чтобы выполнить свою роль – найти специ-
фические иРНК и связаться с ними. Препарат представляет собой синтезиро-
ванные in vitro двухцепочечные РНК длиной в 21 нуклеотидную пару. Чтобы молекула-препарат легче проникала в клетку и не разрушалась, к молекуле присоединяют липофильную группу (Г. Стикс, 2005). Предполагается, что со временем короткие двухцепочечные РНК можно будет вводить в кровоток па-
циента и лечить системные болезни. Рак с размера узелка 2 мм в диаметре тоже становится системной болезнью.
214

Джон Марганоре (J.M. Marfganore, 2006) из США пишет, что у животного единичная доза siРНК сохраняет активность в организме в течение 22 суток. «Если то, что проделано с клетками млекопитающих в культуре, удастся повто-
рить на уровне целого организма, мы получим уникальный метод создания ле-
карственных препаратов. Осуществится заветная мечта, можно будет прицель-
но выводить из строя нужные гены».
С открытием «РНК-интерференции» появилась возможность подавлять избыточный или недостаточный синтез определѐнных белков в нормальной клетке, что может превратить еѐ в раковую клетку. Учѐные предполагают, что этот метод должен быть лишен побочных эффектов, которыми сопровождаются другие методы лечения рака. Однако надо прежде провести соответствующие исследования на животных, а затем и на пациентах.
8.2. Апоптоз и пути его применения для уничтожения раковых кле-
ток
Это необычное явление впервые заметил древний врач К. Гален (131-203
гг. н.э.). Он наблюдал листопад с деревьев осенью: листья опадают с живой ветки, а если еѐ сломать, то листопад прекратится.
Из этого К. Гален сделал выводы: 1) листопад – это преднамеренное са-
моубийство; 2) листья убивают сами себя, так как при наличии их зимой, снег сломает ветки. Это явление он обозначил термином апоптоз.
Термин «апоптоз» происходит от греч. apo – отделение, ptosis – опадание.
Для К. Галена осталось неясным, – что это за причина в листьях, ведущая их к самоубийству.
Оказалось, что способность к самоубийству присуща любой клетке, как у растений, так и у животных. То есть в каждой клетке имеется программа на апоптоз. В нормальной клетке эта программа выключена.
215

Для поддержания жизни многоклеточного организма требуется, как заме-
на клеток новыми путѐм деления, так и присутствие смерти уже ненужных кле-
ток – апоптоз их.
Отмирание клеток в многоклеточном организме первыми обнаружили биологи. Так, у эмбриона человека между пальцами рук и ног имеются пере-
понки, есть жабры и хвост. Но они к рождению человека исчезают через апоп-
тоз их клеток.
После открытия апоптоза в течение десятилетий учѐные были заняты описанием морфологии апоптоза клеток и стадиями или этапами этого процес-
са. Позднее была изучена морфология другого типа смерти клетки – некроза.
В. Флемминг (W. Flemming, 1843-1905) в 1895 г. дал подробное морфоло-
гическое описание апоптоза клетки. В такой клетке в первую очередь ядро рас-
падается на отдельные фрагменты, которые затем как бы «рассасываются». Па-
раллельно сама клетка распадается на частицы, в последствии названные
«апоптозными тельцами».
Дж. Керр (J.R. Kerr, 1972) и соавторы отметили, что апоптоз имеет не меньшее значение, чем митоз. Любая живая клетка снабжена программой апоп-
тоза, регулируемой рядом генов.
До 1960-х гг. XX века причина апоптоза оставалась невыясненной. Пред-
полагалось, что такая ликвидация клетки происходит посредством фагоцитоза или каким-то другим, ещѐ неизвестным способом.
В 1963 г. двое британцев – С. Бреннер (S. Brenner) и Дж. Салстон (J. Sulston) и американец Р. Горвиц (R. Horvitz) занялись изучением развития много-
клеточного организма от одной клетки до взрослого организма.
Для этого С. Бреннер впервые предложил удачный объект – червь нема-
тоду (C. elegans). Длина его тела меньше 1 мм, а тело прозрачно, что делает удобным изучение размножения клеток просто под микроскопом. При изуче-
нии развития этого простого многоклеточного организма Дж. Салстон открыл апоптоз.
216

Он заметил, что в процессе развития тканей и органов червя клетки не только делились, но и умирали. Удивляло то, что смерть их не была вызвана какими-либо внешними повреждениями. Ему стало ясно, что смерть клеток – чѐтко отрегулированный процесс при развитии червя.
Дж. Салстон мог точно отметить те клетки, которым суждено погибнуть,
– это и есть регулируемый процесс смерти клетки – апоптоз. Учѐный обнару-
жил, что апоптоз регулируется генами – выявил мутацию одного из генов – nuc-
1, продукт его оказался необходимым для деградации ДНК погибающей клет-
ки.
В1970-е гг. Р. Горвиц поставил задачу – обнаружить эти «внутренние причины» гибели клетки, т.е. апоптоза. Он открыл несколько генов, мутации в которых приводят к нарушению апоптоза в эмбриогенезе червя.
В1986 г. он сделал сообщение о первых двух генах, вызывающих апоп-
тоз: «гены смерти» – ced-3 и ced-4 ( название ―ced‖ – от англ. cell death – смерть клетки). Показал, что наличие этих двух генов необходимо, чтобы произошла смерть клетки.
Позднее Р. Горвиц доказал, что другой ген – ced-9, взаимодействуя с ге-
нами ced-3 и ced-4, предотвращает гибель клетки. То есть ген ced-9 – это «ген жизни». Он обнаружил множество генов, направляющих элиминацию погиб-
шей клетки. Он показал, что в геноме человека присутствует ген, подобный ге-
ну ced-3 нематоды: ген ced-3 кодирует фермент каспазу; ген ced-4 –аналог гена у человека для фактора – Apat-1; аналог гена ced-9, предупреждающего апоп-
тоз, у человека – ген bcl-2.
В 2002 г. этим трѐм учѐным – «за открытие регуляции развития органов и программированной клеточной смерти генами» присуждена Нобелевская пре-
мия.
Апоптоз и некроз клетки – разные типы смерти клеток
Показатель |
Апоптоз |
Некроз |
Характер процесса |
Физиологический или |
Только патологический |
|
патологический |
|
|
|
|
217

Регуляция |
Генами через их белки |
Нерегулируемый |
|
|
|
Причина |
Сигнальная молекула |
Токсичные и мембра- |
|
для мембранного ре- |
нотропные агенты, не |
|
цептора, или отсутствие |
адекватные внешние |
|
сигнальной молекулы |
условия |
|
|
|
Скорость развития |
1-12 ч. |
В пределах 1 ч. |
|
|
|
Локализация перви- |
В ядре |
В клеточной мембране |
чного повреждения |
|
|
|
|
|
Плазматическая мем- |
Интактна до последней |
Разрушается в началь- |
брана |
стадии |
ной стадии |
|
|
|
Распространѐнность |
Отдельные клетки |
Много клеток |
|
|
|
Причина гибели кле- |
Деградация ДНК, на- |
Нарушение целостно- |
тки. |
рушение работы генов |
сти клеточной мем- |
|
|
браны |
|
|
|
Размер клетки |
Уменьшение (сморщи- |
Увеличение (набуха- |
|
вание) |
ние) |
|
|
|
Изменения ядра |
Конгломераты хрома- |
Набухание |
|
тина, фрагментация |
|
|
|
|
Изменение клеточной |
Образование апоптоз- |
Нарушение целостно- |
мембраны |
ных телец, фагоцитоз |
сти, разрушение и де- |
|
их |
зинтеграция клетки |
|
|
|
Состояние ДНК |
Разрывы с образовани- |
Неупорядоченная де- |
|
ем крупных, затем мел- |
градация |
|
ких фрагментов |
|
|
|
|
Исход для ткани |
Без воспаления и рубца |
С воспалением и руб- |
|
|
цом |
|
|
|
Методы выявления: |
|
|
- морфологические |
Сморщивание клетки |
Набухание клетки |
- электрофоретические |
Формирование «лесен- |
Размазанное пятно при |
|
|
|
218

ки» при электрофорезе электрофорезе ДНК ДНК
Апоптоз клеток сопровождает человека на протяжении всей его жизни,
начиная с оплодотворенной яйцеклетки. Из неѐ берут начало все типы клеток,
их более 200 типов, а организм взрослого человека состоит из 5∙1013-14 клеток.
Взаимодействия между разными типами клеток объединяет функции организма в единое целое. Клетка каждого типа является частью той или иной ткани и ор-
ганизма в целом. В организме человека каждый день рождается за счѐт деления более тысячи миллиардов клеток и столько же отмирает через апоптоз, и мы не ощущаем этого.
Причины апоптоза клеток В физиологических условиях для:
- сохранения генетически заданной численности клеток в каждой ткани,
стабилизации границ ткани; - ликвидации клеток, случайно оказавшихся вне своей ткани: каждая
клетка на поверхности имеет рецепторы, с которыми связывается антиапоптоз-
ный белок, специфический для каждой ткани. Эти белки непрерывно посылают клетке сигнал: «живи дальше» (В.П. Скулачѐв, 2001). При выходе же клетки из своей ткани, клетка лишается этого белка, сигнал исчезает, и клетка кончает с собой;
- ликвидации клеток, к которым не поступает сигнал к делению от сосед-
них клеток, например, при отсутствии молекулы фактора роста;
- уничтожения нормальных клеток после 50±10 делений – лимит Хейфли-
ка; из-за предельного укорочения теломер на концах ДНК геном такой клетки включает апоптоз;
В патологических условиях для:
-уничтожения клетки с повреждениями ДНК – эпимутации в генах свойств клетки, чтобы она не превратилась в раковую клетку;
-уничтожения клетки с повреждениями ДНК – раковая клетка, чтобы не дала потомства с такими дефектами ДНК, т.е. рак;
219
