
[Rukavishnikov_A.I.]_Azbuka_raka(BookFi.org)
.pdf
- моноклональными антителами блокировать рецептор VEGFR-1, что предотвратит миграцию гемопоэтических клеток костного мозга для формиро-
вания преметастазных ниш и миграцию раковых клеток в их места;
- введение моноклональных антител против VEGFR-2, что предотвратит миграцию эндотелиальных клеток стромы костного мозга в места формирова-
ния преметастазных ниш, а значит, не будет ангиогенеза в них, и остановится формирование ниш.
- предотвратить секрецию в нише гемопоэтическими клетками костного мозга вязкого фибронектина, что будет мешать раковой клетке «встраиваться» в ткань органа-мишени.
«Так в корне может измениться лечение рака – пока оно направлено на уничтожение раковых клеток в организме. Но теперь расширяются возможно-
сти определять степень риска образования метастазов у каждого пациента и проводить профилактическое лечение», – говорит проф. Д. Лайден.
Исследования были выполнены только на мышах, но учѐные считают, что подобные молекулярные причины существуют у людей. Они планируют начать клинические испытания на людях в течение следующего года.
Открытие проф. Д. Лайдена и его группы, а также других учѐных сущест-
венно дополняют молекулярные причины процесса метастазирования раковых клеток.
Это открыло белки-сигналы и белки-рецепторы метастазирования рако-
вых клеток, и возможность предсказания «угрозы образования» метастазов, их ранней диагностики и избирательного уничтожения.
Однако, что заставляет раковые клетки мигрировать в окружающие ткани и метастазировать, – ответов нет. Теперь, когда мы знаем, что раковая клетка, –
это стволовая клетка, можно дать и ответ: причиной инвазии и метастазирова-
ния является хоуминг раковой стволовой клетки – миграция еѐ в «нужное ме-
сто», в свою стволовую нишу.
Стволовые клетки имеют естественную способность создавать себе
«дом», т.е. нишу, чтобы находиться в благоприятной среде и самообновляться.
170

«Нам всем нужен дом, и стволовые клетки с их сильным инстинктом к выжива-
нию являются активными строителями жилья», – сказала проф. Руохола-Бейкер
(2006) из США.
171

Глава 7. Методы для ранней диагностики раковых клеток
7.1. ПЦР-ММК – метод ранней диагностики раковых клеток
Из первой раковой клетки за счѐт еѐ деления вначале в ткани образуется узелок в 1-2 мм в диаметре. Но уже с этого размера раковые клетки индуциру-
ют внутри узелка ангиогенез и лимфангиогенез. С началом оттока крови и лимфы из узелка раковые клетки отделяются от него и с кровью и лимфой раз-
носятся по организму пациента – рак становится болезнью всего организма па-
циента.
Из этого следует, что диагностика рака, любого размера, видимого глазом и с помощью приборов – это поздняя диагностика. Пока в практике врача-
онколога диагностика рака тогда, когда рак проявляет себя симптомами.
Учѐные разных стран и нашей страны разными методами стремятся пе-
рейти к диагностике рака задолго до его симптомов. Именно на таком этапе бо-
лезни, можно надеяться на излечение от рака.
Нормальная клетка превращается в раковую после воздействия на неѐ ка-
кого-либо канцерогена. Это вызывает в ней изменения экспрессии генов, соз-
дающих ее свойства. Вторая причина – изменения экспрессии генов-
супрессоров в этой клетке метилированием их промотора, а также мутации. Эти изменения происходят в генах, регулирующих процесс деления клетки, в генах,
ингибирующих деление клетки при нарушениях в еѐ геноме, а также в генах,
вызывающих апоптоз в таких клетках.
Каждый дефект в геноме раковой клетки является маркером такой клетки.
Термин маркер (от англ. mark – метка). Диагностика первой раковой клетки и еѐ близких потомков по генам-маркерам – это ранняя диагностика рака у паци-
ента.
Но как найти в организме пациента раковую клетку и еѐ потомки от пер-
вых делений среди 5 1013-14 клеток организма взрослого человека.
Как и любая клетка, раковая клетка микроскопического размера, возник-
нув в ткани, ничем не беспокоит пациента. За счѐт свойства к инвазии еѐ по-
172

томки распространяются в окружающие здоровые ткани и по всему организму,
где, оседая, дают новые очаги рака – метастазы.
Задача диагностики разрозненных раковых клеток в тканях различных органов сопоставима даже не с поиском иголки в стоге сена, а с поиском кон-
кретного пучка сена в этом стоге. Поэтому не нужно быть слишком большим пессимистом, чтобы предположить всю «тупиковость» такой ситуации в прак-
тике врача-онколога.
Но все изменил метод ПЦР, т.е. полимеразная цепная реакция, а в сочета-
нии с ММК – методом молекулярных колоний, разработанным нашими учѐны-
ми – чл.-корр. А.Б. Четвериным и Е.В. Четвериной (2002), стал для ранней ди-
агностики весьма точным.
При любой локализации рака в кровь пациента попадают: а) сами рако-
вые клетки – из стенок мозаичных капилляров узелка из раковых клеток в 1-2
мм в диаметре и б) гены-маркеры из погибших раковых клеток еще задолго до проявления как первичного очага рака, так и его метастазов. Это и позволяет выявлять рак у пациента с самого начала, т.е. с размера узелка в 1-2 мм в диа-
метре.
Ещѐ в 60-70-х гг. XX в. Ф. Анкер (Ph. Anker) из Швейцарии сделал пер-
вые попытки доказать возможность обнаружения дефектных генов из раковых клеток в крови от пациента.
Наш учѐный, проф. А.С. Белохвостов еще в 1960 г. XX в. обнаружил де-
фектные гены из раковых клеток яичника и желудка в асцитной жидкости. Он же с коллегами в 1978 г. XX в. доказал выход дефектных генов из раковых кле-
ток в кровоток из опухолей в эксперименте на животных.
Теперь дефектные гены из раковых клеток обнаруживают с помощью ПЦР, а также ПЦР-ММК не только в крови, но и в других выделениях от паци-
ента – слюна, слѐзная жидкость, слизь, мокрота, моча и др., в зависимости от типа раковой клетки.
Раковые клетки разрушаются в тканях за счѐт апоптоза как клетки с де-
фектами в геноме, а также при уничтожении Т-клетками. ДНК из них попадает
173

в межклеточную жидкость, а из неѐ в кровь. В кровь попадают раковые клетки из первичного очага рака и метастазов. В крови они разрушаются, в том числе Т-клетками.
Молекулы ДНК и иРНК не могут быть вне клетки, в частности, раковой клетки, а раковая клетка не может быть без ДНК и иРНК. Поэтому выявление этих молекул является эквивалентом обнаружения их носителя – раковой клет-
ки.
Точно также по молекулам ДНК, РНК диагностируют бактерии и вирусы
– возбудителей различных инфекций у пациентов.
Выявление генов-маркеров раковых клеток в их ДНК является идеальным методом для ранней диагностики раковых клеток, контроля лечения и излече-
ния, а также предсказания и диагностики рецидива и метастаза рака у пациен-
тов.
ПЦР-диагностика раковых клеток по плазме крови Процесс, благодаря которому можно получать копии генов из ДНК в не-
ограниченном количестве, называют полимеразной цепной реакцией – ПЦР.
ПЦР открыл в 1983 г. американский ученый К. Мюллис (Kary B. Mullis),
за что он был удостоен Нобелевской премии.
Мишенями ПЦР являются – фрагмент ДНК с находящимся в нѐм геном и иРНК – копия гена.
Цель ПЦР – размножить фрагмент ДНК из образца плазмы крови пациен-
та, т.е. получить его копии, а также размножить иРНК до уровня, детектиру-
емого стандартными методами. Чтобы размножить иРНК, еѐ сначала нужно с помощью обратной транскриптазы перевести в комплементарную ей ДНК, т.е.
кДНК.
Таким методом можно обнаружить экспрессию гена или генов по уровню их мРНК, а также мутации в гене, что явилось причиной превращения нор-
мальной клетки в раковую.
Принцип ПЦР
174

Для ПЦР-метода из клинического образца – плазмы крови выделяют смесь всех содержащихся там ДНК и РНК. Далее, чтобы понять принцип копи-
рования этих молекул, нам не обойтись без некоторых знаний об их природе.
Молекула ДНК состоит из двух цепей, построенных из нуклеотидов, ос-
новной частью которых являются азотистые основания: аденин – А, цитозин – Ц, гуанин – Г и тимин – Т. Азотистые основания несут в себе генетическую ин-
формацию о структуре белков, а через них – строение клетки и еѐ функции, а
также еѐ воспроизведение, т.е. деление на две дочерние клетки.
В английском языке есть слово ―complement‖ – дополнять, дополнение.
От него в молекулярной биологии появился термин – комплементарность.
Смысл его в том, что молекулы узнают друг друга участками, которые допол-
няют друг друга как «ключ и замок».
По этому принципу цепи нуклеотидов составляют комплементарную па-
ру: А одной цепи всегда против Т другой цепи, а Г против Ц. Когда А и Т в двух цепях ДНК расположены друг против друга, между ними образуются две водородные связи. То же происходит с Г и Ц, но между ними возникает три во-
дородные связи.
Из комплементарности пар оснований следует, что последовательность или порядок размещения азотистых оснований на одной цепи ДНК, определяет порядок азотистых оснований в еѐ другой цепи. Концы цепей ДНК химически различны: у каждой цепи есть 3’-конец и 5’- конец (Рис. 1, 2, 3).
Рис 1. Фрагмент молекулы ДНК.
Цепь ДНК, которая служит матрицей для синтеза матричной РНК на-
зывается матричной цепью.
175

Рис. 2. Цепь мРНК – это копия матричной цепи ДНК, последовательность азотистых оснований в ней та же, что и в нематричной цепи ДНК, но с заменой Т на У.
Цепь мРНК с помощью ПЦР размножают, но сначала еѐ с помощью об-
ратной транскриптазы переводят в комплементарную ей матричную цепь ДНК
– кДНК.
Рис. 3. кДНК синтезирована на матрице мРНК – копии гена.
Образование водородных связей между парами оснований: А-Т и Г-Ц – это спонтанный процесс, т.е. без участия фермента. Эти связи слабые и легко рвутся при нагревании – цепи ДНК отделяются друг от друга, а при охлажде-
нии раствора – вновь спариваются в прежнее комплементарное состояние.
Спонтанный процесс образования пар оснований А-Т и Г-Ц называют гибриди-
зацией.
В основе ПЦР-анализа и лежит гибридизация пар оснований, как спон-
танный процесс.
Выделенные из образца плазмы крови ДНК и иРНК являются мишенями для ПЦР. Их смешивают с реакционным буфером и другими компонентами ПЦР в специальную пробирку и помещают в прибор – ДНК-амплификатор,
дающий циклические изменения температуры реакции.
Цикл ПЦР для размножения молекул-мишеней – ДНК и иРНК состоит из трѐх стадий:
1) расплавление двухцепочечной ДНК путем повышения температуры ре-
акционной среды до 90° С; 2) зная порядок оснований на концах фрагмента ДНК, взятого для раз-
множения, т.е. амплификации, синтезируют химическим путѐм олигонуклеоти-
ды, комплементарные этим участкам – это праймеры;
176
3) присоединение праймеров к матрицам, т.е. к однотяжевым цепям ДНК,
полученными в результате первой стадии. Температура реакционной среды –
50-60°С.
На этой стадии происходит удлинение, т.е. элонгация гибридизованных праймеров ДНК-полимеразой при температуре для работы фермента 70-75°С,
что превращает каждую из цепей в двухцепочечную молекулу ДНК (Рис. 4).
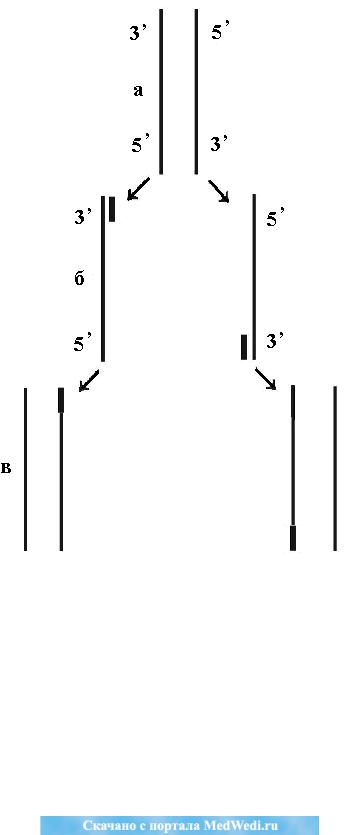
Рис. 4. Схема ПЦР [рис. и цит. по: А.С. Белохвостов (1995) с изменения-
ми]. На схеме цикл удвоения молекулы ДНК из исследуемого образца:
а – цепи исходной молекулы ДНК изображены двумя прямыми линиями;
б – после разделения цепей ДНК, к их концам присоединены по одному комплементарному праймеру в виде прямоугольника;
в – идѐт синтез новых цепочек ДНК.
177

Примечание. Стрелками показано направление синтеза новых цепей в
ПЦР.
По окончании одного первого цикла из одной молекулы двухцепочечной ДНК получены две, в следующем цикле каждая из двух молекул снова удваива-
ется и так далее, с нарастанием числа молекул (N) по формуле: N = 2n, где n –
число циклов. Отсюда и название реакции – цепная.
Теоретически ПЦР позволяет размножить до легко детектируемых коли-
честв даже единственною молекулу-мишень ДНК, даже если она находится среди множества других молекул ДНК и РНК. Стандартная ПЦР постоянно со-
вершенствуется.
Продукты ПЦР – молекулы ДНК, а значит гены и иРНК подвергаются анализу рядом методов, например электрофорезом в геле с окраской молекулы ДНК бромидом этидия и др. Определяются ген(-ы) и мутации в них: замена – пара оснований меняется на другую; вставка – в молекулу введена новая пара оснований; делеция – отсутствие пары комплементарных оснований в гене. По количеству копий иРНК гена судят о степени его экспрессии в клетке.
Различают два варианта ПЦР-диагностики: 1) качественный тест и 2) ко-
личественный тест.
Для качественного теста требуется лишь дать ответ: «да» или «нет», т.е.
содержится ли в образце ДНК или иРНК. Для диагностики вирусной инфекции обычно достаточен факт обнаружения в образце вирусной ДНК или иРНК.
Для обнаружения раковой клетки в образце недостаточно, например, об-
наружить иРНК, так как она может быть продуктом и нормальной, и раковой клетки.
Количественный тест определяет титр, т.е. число копий молекул-
мишеней в определенном количестве образца, здесь крайне важны мишени – ДНК и иРНК.
Ведь для ранней диагностики рака крайне важно обнаружить его на са-
мом раннем этапе – на уровне первой раковой клетки и еѐ первых потомков, а
еще лучше на уровне предраковой клетки по генетическим маркерам в молеку-
178

лах-мишенях – ДНК и иРНК. На уровне одной из этих клеток титр мишени бу-
дет минимальным.
Титр мишеней – ДНК и иРНК и их генетические маркеры необходимы:
1)для исследования молекулярных причин превращения нормальной клетки в раковую клетку в конкретном случае;
2)для слежения за течением скрытого ещѐ рака на уровне первой раковой клетки и еѐ первых потомков, но также и для рака с симптомами;
3)для оценки эффективности лечения рака, коррекции лечения рака в процессе его лечения по состоянию генетических маркеров раковых клеток.
Чувствительность стандартной ПЦР разные авторы оценивают по-
разному; причиной этого может быть и степень чувствительности еѐ в специфи-
ческом обнаружении молекул-мишеней, но и характер клинического образца – плазма крови, ткань опухоли, слюна, моча и другие различные выделения.
ПЦР-ММК-метод для ранней диагностики раковой клетки или клеток по плазме крови
Стандартная ПЦР может давать сбои и ошибки, в результате чего: 1) мо-
лекулы-мишени не будут выявлены из-за потери их в процессе подготовки об-
разца; 2) молекулы-мишени могут быть не размножены в процессе ПЦР, тем бо-
лее что в обычной клинической практике молекулы-мишени представляют не-
значительную долю среди ненужных матриц в образце.
Чл.-корр. А.Б. Четверин и Е.В. Четверина – сотрудники Института белка РАН – открыли метод молекулярных колоний – ММК, для прямого определе-
ния титра молекулы-мишени и пространственное разделение размножения нужных молекул-мишеней от ненужных. Этот метод запатентован учѐными в РФ и в США (1995, 1998).
Принцип метода в том, что молекулы-мишени – ДНК и иРНК – размно-
жаются не в жидкости, а в геле. Это создает отдельные колонии, каждая из ко-
торых является потомством единственной молекулы, т.е. клон.
179
