
[Rukavishnikov_A.I.]_Azbuka_raka(BookFi.org)
.pdf
3. Е3 распознаѐт белок-мишень, который должен быть уничтожен. Он принимает убиквитин от Е2, соединяется с белком-мишенью и «пришивает» к
нему цепочку убиквитина (Рис. 1).
Рис. 1. Этапы образования цепочки белка-убиквитина и присоединения к нему белка-мишени (цит. и рис. из работы Е.Б. Абрамова, В.Л. Карпов, 2003).
4. Цепочку убиквитина узнаѐт субъединица специального регулятора и связывается с ней, а значит с белком-мишенью. Этот процесс также требует АТФ.
Линейная молекула белка-мишени протягивается через регулятор, иг-
рающего роль «молекулярных ворот» протеасомы и через отверстие проникает в центральную камеру.
Белок-мишень расщепляется на полипептиды короткой длины, они вы-
свобождаются из протеасомы и в цитоплазме разрушаются протеазами до ами-
нокислот. Цепочка молекул убиквитина перед входом в протеасому отделяется и разрушается протеазами на мономеры (Рис. 2).
60

Рис. 2. Расщепление белка-мишени в протеасоме до пептидов и молекул убиквитина (цит. и рис. из работы Е.Б. Абрамова, В.Л. Карпов, 2003).
Так учѐным впервые удалось открыть молекулярные причины регули-
руемого генами распада или деградация «ненужных» белков, а значит, вредных для ряда процессов жизни в нормальной клетке.
Белок-убиквитин регулирует в клетке время функционирования всех бел-
ков, удаляет из неѐ чужеродные и дефектные белки, создаѐт в результате раз-
ложения белков полипептиды в качестве антигенов в комплексе с МНС I клас-
са. По ним NK-клетки и Т-клетки иммунного контроля определяют в одних случаях, – здоровье клетки, в других – болезнь клетки.
Белок-убиквитин путѐм разложения «ненужных» белков в клетке упра-
вляет делением клеток, репарацией ДНК клеток, проверкой качества только что синтезированных белков в клетке, синтезом белков, участвующих в апоптозе клеток, а также в синтезе важных белков для иммунного ответа организма.
Сбои в работе убиквитина ведут к нарушениям в этих процессах, следст-
вием чего является возникновение ряда тяжелых болезней, в частности, воз-
никновения раковой клетки.
Теперь возможно понять на молекулярном уровне, как в клетке проте-
кают важнейшие процессы путем избирательного действия белка убиквитина – разрушает «ненужные» белки, не трогая нормальные.
61

За открытие «убиквитин-опосредованного расщепления белков» в клетке,
названные трое учѐных, в 2004 г. были награждены Нобелевской премией.
Зная роль убиквитина в том или ином процессе в нормальной клетке,
можно понять молекулярные причины возникновения определенных болезней.
Влиянием на этот процесс при болезни, можно достигать еѐ излечения, а также осуществлять профилактику болезни. Основным условием разработки методов лечения и создания лекарств является, конечно, понимание того, какой белок или белки являются причиной данной болезни.
В информации о вручении Нобелевской премии учѐным, а также после этого ряд учѐных сделали акценты на возможные пути применения в медицине этого открытия.
1. При вручении премии учѐным было отмечено, что понимание убикви-
тина приведѐт к созданию новых видов лекарств. Учѐные будут изменять про-
цесс, предотвращая выход из строя белков, либо заставляя клетку уничтожать те из них, которые приводят к болезням.
2. Р. Айкеда: «Открытие учѐных имеет очень важное применение. Оно особенно важно, поскольку показало, что разрушение составных частей клетки поддаѐтся контролю. Каждый из элементов клетки должен оставаться в ней оп-
ределѐнный отрезок времени, а потом выведен вовне подконтрольно, иначе он может стать канцерогеном».
3. Открытие, сделанное этими учѐными, привело к созданию средства от рака в США под названием Velcade.
Как подчѐркивают учѐные, этот препарат «бьѐт прицельно по больным клеткам. Ранее при лечении рака клетки убивались неизбирательно, что зачас-
тую приводило к тяжѐлым осложнениям и летальным исходам».
4. В. Грибанов: «Открытие лауреатов позволило понять на молекулярном уровне механизм регуляции ремонта ДНК, транскрипцию гена и управление качеством синтезируемых клеткой белков. Они также пролили свет на возник-
новение дефектов иммунной системы, которые приводят к ряду тяжѐлых бо-
лезней, включая рак».
62

5. Наши учѐные Е.Б. Абрамова, В.Л. Карпов (2003). «Сбои в деградации белков протеасомой нарушают равновесие между пролиферацией и апоптозом и этим служат причиной разных болезней». Они делят болезни на две группы:
болезни, «обусловленные тем, что деградационная система не работает, и бо-
лезни, которые возникают из-за усиления еѐ функции. Первые – это результат стабилизации субстратов», т.е. белков-мишеней, быстро разрушаемых в норме, «вторые, наоборот, аномально быстрого распада белков-мишеней».
a) Регуляция клеточного цикла. Клеточный цикл состоит из нескольких фаз, их смена регулируется белками-циклинами. Так как каждую фазу регули-
рует свой регулятор, – белок-циклин, жизнь его должна быть короткой. Это де-
лает 26S протеасома.
Белки-циклины в качестве метки для узнавания ферментом Е3 содержат разные участки в молекуле белка-циклина. Узнанный «по той или иной метке» регуляторный белок, т.е. циклин «сшивается» своим ферментом из семейства Е3 с убиквитиновой цепочкой и разрушается 26S протеасомой. Исходя из этого,
учѐные подчеркивают, что «сбой в еѐ работе вызовет остановку клеточного цикла в той или иной фазе».
б) Перерождение нормальной клетки в раковую клетку. В нормальной клетке белки скорости транскрипции, определяют во многих случаях судьбу этой клетки: станет ли делиться как нормальная клетка, пойдѐт ли по пути бес-
контрольного деления, как раковая клетка, или будет разрушена, как опасная клетка.
Поэтому регуляторные белки могут быть или белками, вызывающими не-
контролируемое деление клетки, или, наоборот, белками-онкосупрессорами.
Пример. Белок р53. Его уровнем в нормальной клетке удерживается рав-
новесие между делением и апоптозом. Но ситуация может меняться, например,
при заражении человека вирусом папилломы. Его белок Еб находит белок р53 и
подаѐт сигнал ферменту Е3 присоединить к р53 цепочку убиквитинов. Фермент выполняет свою функцию, и р53 становится белком-мишенью для деградации
63

протеасомой. В результате его быстрого разрушения нормальная клетка пере-
рождается в раковую.
в) Иммунная система. 26S протеасома участвует в иммунном ответе клет-
ки. Она расщепляет аномальные или чужеродные белки до полипептидов, неко-
торые из них – короткой длины аминокислот, выставляет в качестве антигенов.
Такие полипептиды в цитозоле клетки соединяются с белком-транспортѐром и переносятся в эндоплазматический ретикулум. Там они взаимодействуют с белками МНС1 и переносятся на поверхность клетки. Как незакодированные в геноме этой клетки белки-антигены, их обнаруживают Т-клетки иммунной сис-
темы и разрушают эти клетки, так как в них синтезируются необычные для них белки.
6. Исследования учѐных из разных стран показали, что от того, как функ-
ционирует в клетке белок-убиквитин, которого некоторые учѐные называют клеточный «дворник», зависит продолжительность фаз деления клеток, т.е. кле-
точный цикл, репликация ДНК перед делением клетки, структура хромосом. И
когда в работе «дворника» случаются неполадки, возникают тяжѐлые болезни.
Так, сбой в деградации белка, отвечающего за разделение хромосом в процессе деления клетки, приводит к неправильному числу хромосом в дочер-
них клетках. Это может быть причиной превращения нормальной клетки в ра-
ковую клетку, а также вызывать другие болезни.
Понимание молекулярного механизма разрушения «ненужных» белков может быть полезно для лечения рака и ряда других болезней путѐм уничто-
жения определенного белка введением протеасомных стимуляторов. В других случаях, уменьшать или увеличивать содержание того или иного белка в де-
фектной или больной клетке.
Итак, процесс распада молекул белка в клетке интересовал учѐных в те-
чение многих десятилетий значительно меньше, чем синтез белка.
Теперь оказалось, напрасно: нарушения в молекулярных механизмах расщепления белков в клетке, а значит, в организме человека, могут привести к последствиям не менее тяжѐлым, чем сбои в синтезе новых молекул белка.
64

Учѐные открыли такой молекулярный механизм, который может ликви-
дировать угрозу любой болезни в зародыше, уничтожая опасные белки.
По этой причине Шведская академия наук заявила, что это открытие в будущем «даст возможность побороть рак: знания химических механизмов по-
могут создать нужные лекарства».
65

Глава 3. Нормальная соматическая клетка
3.1. Смертность нормальной соматической клетки: молекулярные
причины
В 1891 г. известный биолог А. Вейсманн (A. Wesmann) впервые предпо-
ложил, что соматические клетки животных и человека «должны иметь ограни-
ченный потенциал деления», т.е. они смертны. Но учѐный не дал подтвержде-
ний этому предположению.
Знания о том, что соматическая клетка того или иного типа у человека смертна или бессмертна очень важно для понимания раковой клетки.
Для решения вопроса – смертна или бессмертна сама по себе нормальная клетка, имеются два метода:
1) нормальную клетку после выделения из ткани организма можно пе-
ренести на питательную среду, т.е. в культуру и проследить еѐ способность к размножению;
2) нормальную клетку из ткани организма можно пассировать на изоген-
ных лабораторных животных, пометив еѐ специфическим маркером для от-
личия от нормальных клеток хозяина.
По наличию размножения клетки можно сделать вывод – смертна или бессмертна нормальная клетка.
В начале XX в. А. Каррель – известный специалист по культуре клеток, –
изучал этот вопрос в культуре фибробластов, взятых из сердца цыпленка.
По его данным, фибробласты в культуре имели неограниченную способ-
ность к размножению, т.е. они бессмертны. Это было признано открытием. Но оно просуществовало до 1961 г., когда было доказано, что это не так.
В 1961 г. Л. Хейфлик и П. Мурхед (Hayflick L. and Moorhead P.S.) на нор-
мальных фибробластах от человека показали ограниченную способность фиб-
робластов в культуре к делению, т.е., что они смертны. Перед началом своих опытов они исключили все артефакты и неадекватные условия культуры для изучаемых клеток.
66

В этих опытах учѐные обнаружили, что фибробласты от эмбриона чело-
века были живыми, т.е. удваивались в числе, в среднем до 50±10 раз. Чем стар-
ше донор, тем меньше удвоений делали взятые от него клетки. Фибробласты от человека 20 лет, уже делились только 30±10 раз. К концу среднего срока ни од-
на клетка уже не делилась, и клетки гибли. Этим было доказано, что нормаль-
ные клетки человека имеют ограниченную продолжительность жизни.
Предел числа деления нормальной клетки – 50±10, в литературе стали обозначать словами – «лимит Хейфлика».
В другом опыте учѐные хранили часть клеток в жидком азоте при темпе-
ратуре –190° ниже нуля. В таких условиях клетки могут храниться сколько угодно. Но как только фибробласты оттаивали и помещали в питательную сре-
ду, они снова начинали делиться. При этом оказалось, что клетки «считают»,
сколько удвоений у них было до того, как их поместили в холодильную камеру,
так как доводят число удвоений до положенного значения – 50±10. Например,
клетки, помещѐнные на хранение после 30 делений, удваивались ещѐ, но только
20 раз. Это означает, что причина ограниченного числа делений нормальной клетки, а затем еѐ смерть, является «внутренним свойством» самой клетки. Но какая причина делает клетки неспособными к делению и затем приводит их к смерти, учѐные не смогли установить.
На основе анализа процесса репликации ДНК, проф. А.М. Оловников – предположил, что с каждым делением клетки «как-то меняется длина еѐ ДНК».
Если это так, то причина «лимита Хейфлика» должна быть в процессе, который происходит в области концов каждой из цепей ДНК во время еѐ удвоения перед делением клетки. Так он в 1971 г. впервые в мире предсказал причину ограни-
ченного числа деления нормальной клетки, предложив гипотезу – «маргиното-
мии». От лат. слова ―margo‖ – край и греч. ―tome‖ – отсечение, то есть усечение копии ДНК с краѐв.
Цепи ДНК расходятся, и на каждой из цепей достраивается еѐ копия с помощью фермента ДНК-полимеразы. Ясно, что цепь исходной ДНК – это ма-
трица, по ней строится дочерняя цепь путѐм комплементарного связывания азо-
67
тистых оснований. В результате перед делением клетки удваивается ДНК, а с
этим и хромосома.
Всвоей гипотезе учѐный исходил из того, что фермент ДНК-полимераза
–это не «точка», а объѐмная молекула. Еѐ каталитический центр достраивает дочернюю цепь ДНК, но занимает «лишь ничтожную часть молекулы». Ос-
тальные участки фермента каталитически неактивны. С их помощью фермент узнаѐт матрицу и движется по ней, но в копировании цепи ДНК эти участки «не заняты».
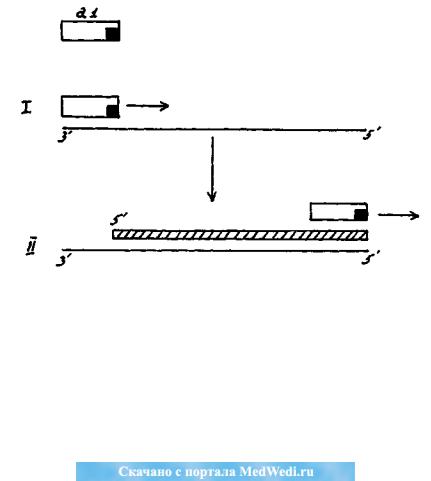
По причине неактивных участков фермент синтезирует копию цепи: «ли-
бо не с самого начала матрицы (Рис. 1), либо не до самого еѐ конца» (Рис. 2). В
результате дочерняя цепь получается короче, чем матрица. Поэтому после каж-
дого деления дочерние клетки получают «в наследство» всѐ более короткие мо-
лекулы ДНК. В этом и заключается «усечение копии ДНК с краев».
Еще в 1932 г. Нобелевский лауреат Г. Мюллер задолго до открытия ст-
руктуры ДНК, понял, что концевые участки хромосом содержат материал, за-
щищающий проксимально расположенные гены от разрушения. Он назвал эти концевые структуры теломерами (от греч. – telos – конец, meros – часть, доля).
Рис. 1. Схема проксимальной маргинотомии ДНК. а1 – молекула ДНК-
полимеразы с «правокраевым» расположением каталитического центра (рис. и
цит. по: А.М. Оловников, 1971).
68
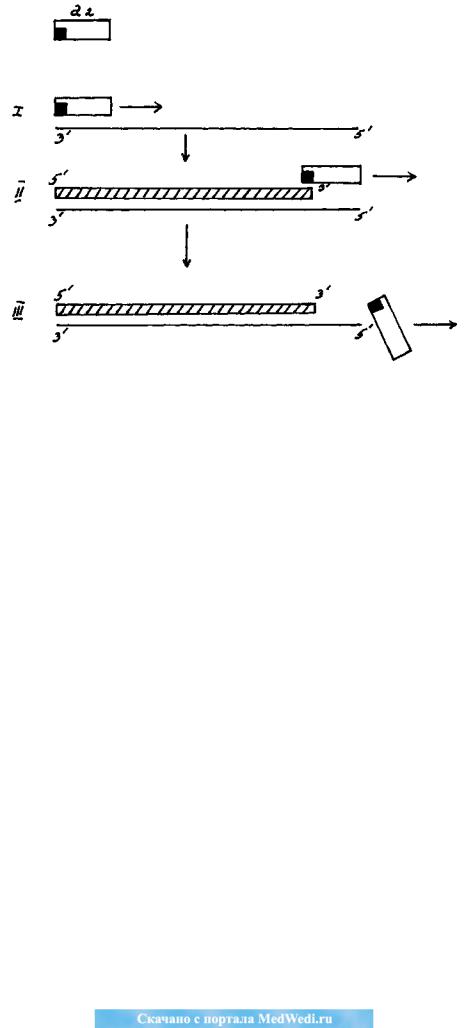
Рис. 2. Схема дистальной маргинотомии ДНК. а2 – молекула ДНК-
полимеразы с «левокраевым» расположением каталитического центра (рис. и
цит. по: А.М. Оловников, 1971).
По мнению A.M. Оловникова, усечение копии ДНК не дойдѐт до «исчер-
пания всей длины ДНК, а значит хромосомы», клетка перестанет делиться и по-
гибнет раньше. Он допускал, что на концах ДНК находятся «буферные» гены,
которые не кодируют белки, а лишь «страхуют клетку». Концевые гены назы-
вали телогенами. На каждом конце хромосомы находится по одному телогену.
Гены, кодирующие белки, расположены ближе к середине хромосомы; если усечение не затрагивает их, клетка будет функционировать нормально.
«Буферный» ген состоит примерно из 50 сегментов. В процессе маргино-
томии сегменты телогена утрачиваются. A.M. Оловников даже предположил,
как это происходит. В процессе каждой репликации не воспроизводится край-
ний сегмент телогена, и так к 50-му делению клетки все сегменты телогена рас-
ходуются. Вместе с этим клетка утрачивает способность удваиваться, затем по-
гибает.
69
