
- •1 Движение электрона в кристалле. Уравнение Шрёдингера, волновая функция
- •1.2 Движение электронов в атоме
- •1.3 Зонная теория твердого тела
- •Глава 2. Электропроводность полупроводников
- •2.1 Собственные и легированные полупроводники. Уравнение электронейтральности
- •2.2 Статистика электронов и дырок
- •2.2.1 Заполнение электронами зон вырожденного полупроводника
- •2.2.1 Заполнение электронами и дырками зон невырожденного полупроводника
- •2.2 Положение уровня Ферми и расчет концентрации носителей
- •2.2.1 Донорный полупроводник
- •2.3 Электропроводность полупроводников
- •2.3.1 Электронная проводимость
- •2.3.2 Дырочная проводимость
- •2.3.3 Собственная проводимость
- •Глава 3. Неравновесные электронные процессы
- •3.4 Диффузионный и дрейфовый токи
- •3.2. Неравновесные носители в электрическом поле
- •3.2.1. Уравнение непрерывности тока
- •5 Контакт электронного и дырочного полупроводников
- •5.1 Возникновение потенциального барьера. Контактная разность потенциалов.
- •5.2 Вольтамперная характеристика p-n-перехода
- •5.3 Температурные зависимости вах pn-перехода
- •5.3 Влияние генерационно-рекомбинационных процессов на вах pn-перехода.
- •5.4 Барьерная емкость pn-перехода
- •5.5 Диффузионная емкость pn-перехода
- •5.6 Пробой pn-перехода
- •5.6.1 Лавинный пробой pn-перехода
- •5.6.2 Туннельный (полевой, зинеровский) пробой pn-перехода
- •5.6.3 Тепловой пробой pn-перехода
- •5.7 Влияние сопротивления базы на вах pn-перехода. Полупроводниковый диод
- •5.8 Выпрямление на полупроводниковом диоде
- •5.8.2 Переходные процессы в полупроводниковых диодах
- •5.9 Полупроводниковые диоды
- •5.9.1 Выпрямительные диоды
- •5.9.2 Стабилитроны
- •5.9.3 Туннельные диоды
- •6 Биполярные транзисторы
- •6.1 Включение транзистора по схеме с общей базой
- •6.1.1 Статические вольт-амперные характеристики транзистора, включенного по схеме с общей базой
- •6.1.2 Усиление транзистора, включенного по схеме с общей базой
- •6.2 Включение транзистора по схеме с общим эмиттером
- •6.2.1 Статические вольт-амперные характеристики транзистора, включенные по схеме с общим эмиттером
- •6.3 Включение транзистора по схеме с общим коллектором
- •6.4. Дифференциальные параметры биполярного транзистора
- •6.4.1 Температурная зависимость параметров биполярных транзисторов
- •6.5 Работа транзистора в импульсном режиме
- •7 Тиристоры
- •7.1 Вольт-амперная характеристика тиристора
- •7.2 Типы тиристоров
- •8 Униполярные транзисторы
- •8.1 Полевой транзистор с управляющим pn- переходом (птуп)
- •8.1.1 Вольт-амперные характеристики птуп
- •Мдп–структура
- •1. Идеальная мдп-структура
- •2 Вольт-амперные характеристики мдп-транзистора
- •8.2.2 Схемы включения мдп-транзистора
- •4.2. Барьер на границе металла с полупроводником (барьер Шоттки)
- •4.2.1 Выпрямление тока на контакте металла с полупроводником
- •Фотоэлектрические полупроводниковые приборы
- •7.2. Полупроводниковые источники оптического излучения
- •10 Классификация интегральных микросхем
- •10.2 Условные обозначения микросхем
- •10.3 Элементы микросхем
- •10.4 Технология изготовления микросхем
- •10.4.1 Корпуса микросхем
1.2 Движение электронов в атоме
Каждый атом или молекула может находиться в том или другом энергетическом состоянии. Иначе говоря, их внутренняя энергия квантована.
Взаимодействие частиц в квантовой механике характеризуют потенциальной энергией, формула которой заимствуется из классической механики. Например, потенциальная энергия заряженной частицы (например, электрона с зарядом минус q) в электрическом поле другой заряженной частицы (например, ядра атома водорода c зарядом плюс q) выражается формулой
|
|
(1.12) |
Эту формулу и переносят в квантовую механику как формулу, характеризующую электрическое взаимодействие двух заряженных частиц.
В этом случае уравнение Шрёдингера примет вид:
|
|
(1.13) |
Уравнение в частных производных (1.13) имеет множество решений. В каждой конкретной задаче из этого множества следует выбрать одно решение, отвечающее условиям задачи.
Геометрический
образ, соответствующий
 и представляющий
область наиболее
вероятного пребывания электрона в
атоме,
называют атомной
орбиталью
данного электронного состояния.
Кстати, из-за
неопределенности координат нельзя
говорить и о траектории электрона, в
частности об орбитах электронов в
атомах.
и представляющий
область наиболее
вероятного пребывания электрона в
атоме,
называют атомной
орбиталью
данного электронного состояния.
Кстати, из-за
неопределенности координат нельзя
говорить и о траектории электрона, в
частности об орбитах электронов в
атомах.
Для описания электронной системы, будь то атом, молекула или кристалл необходимо знать все её возможные квантовые состояния, характеризуемые энергетическим спектром системы (кристалла, атома). Если электронная система находится в равновесии и не подвергается никаким внешним воздействием, то находящиеся в ней электроны должны занимать состояния с минимальной энергией.
Решения уравнения Шрёдингера существуют только для волновых функций, характеризуемых набором целых чисел (которые называют квантовыми): n, l, m и соответствующих им дискретных значений энергий.
Главное квантовое число n может принимать любые целые положительные значения от 1 до ∞. Оно определяет величину энергии и влияет на размеры атомной орбитали – пространства, в котором велика вероятность нахождения электрона. С увеличением n расстояние между энергетическими уровнями и энергия связи электронов с ядрами уменьшается, значение энергетического зазора между уровнями падает.
|
|
(1.14) |
|
|
(1.15) |
Здесь Z – порядковый номер элемента в таблице Д.И. Менделеева.
Орбитальное квантовое число l определяет форму орбитали. Значение орбитального числа l=(n-1)= 0, 1, 2, 3, … , (n-1). Также вводят буквенные обозначения: 0-s, 1-p, 2-d, 3-f.
Магнитное квантовое число характеризует величину магнитного поля, создаваемого при вращении электрона вокруг ядра. Поэтому значение магнитного квантового числа m связано со значением орбитального квантового числа и изменяется от –l до + l, а всего число может принимать (2l + 1) значение, включая нулевое. Например, для l = 2: m = -2, -1, 0, 1, 2.
Сколько электронов может находиться на одной орбите? Вольфганг Паули в 1925 г. сформулировал принцип запрета: на любой атомной орбите может находиться не более двух электронов. Если бы этого не наблюдалось, все электроны в сложных атомах перешли бы на самый нижний энергетический уровень.
В том же 1925 г. голландец Ральф Кронинг и независимо Джордж Уленбек и Самюэль Гаудсмит предположили, что электрон вращается вокруг собственной оси. Внутренний момент импульса, связанный с этим вращением, назвали спином (от англ. spin – вращение), а момент, связанный с вращением вокруг ядра – орбитальным моментом. Но какая ось у электрона – материальной точки? Там не менее, существенно, что электрон помимо координат и импульса характеризуется вектором спина, спин, подобно заряду, - внутренняя характеристика электрона, в классической теории аналогичного понятия быть не может. Спиновое число s =+½. Спин – это одно из проявлений принципа тождественности частиц, который применительно к электронам звучит так: все электроны Вселенной неразличимы. В квантовой теории сама постановка вопроса: что в этой точке находится электрон №8, не имеет смысла. Электроны, как и фотоны, можно изучать лишь в совокупности.
В 1940 г. тот же Паули выдвинул теорему, согласно которой для частиц с полуцелым спином (фермионов) выполняется принцип запрета (на одной орбитали находится не более 2s+1 частиц).
У фотона, глюона (осуществляет обмен между кварками) s =1 – целое число, в одном состоянии может находиться любое число частиц.
Свое название – фермионы, частицы с полуцелым спином (электроны, дырки) получили по имени итальянского физика Энрико Ферми. Частицы с целым спином (включая нуль) – бозоны, по имени индийского ученого Шатьендраната Бозе.
Схема заполнения атомных оболочек отражена в периодической таблице элементов Менделеева: порядковый номер элемента Z соответствует числу электронов атома, номер периода, показывает значение главного квантового числа внешней оболочки атома (n = 1, 2, 3, 4, 5, 6, 7). Группа, в которой находится элемент, указывает число электронов, находящихся на внешней оболочке, для которой главное квантовое число соответствует номеру периода.
Электрону, находящемуся в атоме, можно сообщить энергию, достаточную для того чтобы он не только перешел на более высокий возбужденный уровень, характеризующийся следующим главным квантовым числом n, но и стал свободным. Атом при этом превращается в положительно заряженный ион. Соответствующую энергию называют энергией ионизации атома.

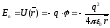 ,
,
 ,
,
